脑挫伤早期神经细胞凋亡和Caspase-3表达变化的观察
2012-12-11李庭玉马书玲
李 凡,张 浩,李庭玉,马书玲
颅脑损伤(外伤、交通事故)在法医学实践中非常多见,颅脑损伤标志着案件的发生;准确推断脑损伤时间,直接关系到案件的侦破;在临床实践中脑损伤后神经细胞坏死、凋亡直接关系到伤者的神经功能丧失和伤残程度。以往有关脑损伤神经细胞凋亡的研究主要关注脑缺血、缺氧性损伤和神经细胞病变,如老年痴呆症、帕金森症和癫痫等[1-2]。对创伤性脑损伤的神经细胞凋亡动物试验研究很有限,对人脑损伤的研究报道更少[3]。本文对不同损伤时间的人脑挫伤组织进行TUNEL染色和Caspase-3免疫组化染色,探讨脑挫伤后神经细胞凋亡和调控因子Caspase-3表达的时间和空间变化,有望探索推断脑损伤时间的新方法。
1 材料与方法
1.1材料36例人脑挫伤组织蜡块选自死于颅脑损伤的检验案例,死者性别不限,年龄18~60岁,既往健康,死亡原因为严重颅脑损伤,大体检验脑挫伤明显。脑组织蜡块均经常规HE方法处理制备。根据损伤时间不同分为6个实验组,即2 h以内组、4~6 h组、11~13 h组、23~25 h组、48 h及以上组,每组6例;对照组6例,为同年龄组,既往健康,因机械性损伤致心脏或大血管破裂引起急性失血短时间(1 h)内死亡者脑组织标本。所有脑组织标本均在死后2~56 h通过尸体解剖取材。主要试剂:TUNEL染色试剂(美国ROCH公司产品);Caspase-3 免疫组化试剂(一抗、二抗等)由武汉博士德公司提供(BA0588,SA1022)。主要仪器:奥林匹斯显微镜和Image-Pro Plus 专业图像分析系统。
1.2方法
1.2.1 常规HE染色 所有脑挫伤组织标本(约1.5 cm×1.5 cm×0.2 cm),用中性10%福尔马林固定24~48 h,梯度酒精脱水,二甲苯置换,石蜡包埋,连续切片(5 μm),常规HE染色、封片。
1.2.2 TUNEL染色 TUNEL染色根据文献报道的方法略加改进[4]。石蜡切片经脱蜡、水化置换入双蒸水中;用蛋白酶K(20 μg/mL)消化,37 ℃ 孵育30 min,PBS洗2次;滴加50 μL的TUNEL反应混合液(1份TdT酶—末端脱氧核糖核酸转移酶,9份dUTP标记溶液),在湿盒内37 ℃孵育60 min,PBS冲洗3次;擦干样品周围的水分,滴加50 μL用PBS 1∶100 稀释的转化剂POD,放入湿盒37 ℃ 孵育30 min,PBS冲洗3次,滴加50~100 μL DAB溶液显色,室温孵育10 min,PBS冲洗3次,苏木素复染5 min。切片经脱水、透明、封片。TUNEL染色的阴性对照以pH7.4,0.01 M/L PBS代替TUNEL反应混合液。在相同试验条件下、同批次染色挫伤组(不同损伤时间)和对照组脑组织切片。
1.2.3 免疫组化染色 按照试剂盒中说明书操作方法进行,厚度为5 μm 的石蜡切片经脱水置换入双蒸水;用3% H2O2室温、10 min,消除内源性过氧化物酶,双蒸水洗3次;在枸橼酸钠缓冲液(pH6.0)中,微波(700 W)80~90 ℃抗原修复4 min,PBS洗2次;滴加可溶性人血清白蛋白封闭非特异性抗原,室温15 min,甩去人血清白蛋白,滴加50 μL一抗(1∶50稀释),在湿盒内37 ℃ 孵育60 min,4 ℃过夜,PBS(pH 7.2~7.6)冲洗3次;滴加50 μL 二抗,放入湿盒37 ℃ 孵育30 min,PBS冲洗3次,滴加SABC试剂,同样37 ℃ 孵育30 min,PBS冲洗3次;DAB显色5~10 min(显微镜下控制染色进程),苏木素复染5 min,切片经脱水、透明、封片。在相同试验条件下、同批次染色挫伤组(不同损伤时间)和对照组脑组织切片。Caspase-3一抗稀释度为1∶50,Caspase-3免疫组化阴性对照以PBS代替一抗。

2 结果
2.1 HE染色脑挫伤组织可见有:出血,神经细胞肿胀、坏死,尼氏小体消失,细胞核溶解,周围脑组织水肿明显,局灶性蛛网膜下腔出血;随着损伤时间的延长,脑组织内神经细胞坏死明显,小胶质细胞和少突胶质细胞增多,蛛网膜下腔可见中性粒细胞浸润。
2.2 TUNEL染色TUNEL阳性细胞核呈棕黄色—黄色,阴性细胞核为蓝色。阳性细胞核主要分布于挫伤灶的中央区和周围的半影区,两者有显著差异,P<0.05,半影区比中央区更显著;远隔部位和对照组呈阴性。并且,挫伤半影区阳性细胞数目和染色深度随损伤时间延长,逐渐增加。统计分析发现,挫伤半影区阳性率和阳性细胞IOD与损伤时间之间呈线性关系,r分别为0.89和0.93(见表1和图1)。中央区不同损伤时间组之间差异没有统计学意义,P>0.05。
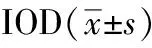
表1 不同损伤时间脑挫伤组织TUNEL染色阳性率和
① 组间比较P<0.05, ② 半影区与中央区相比P<0.05
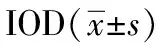
表2 不同损伤时间脑挫伤组织Caspase-3染色的阳性率和
① 组间比较P<0.05,② 半影区与中央区相比P<0.05
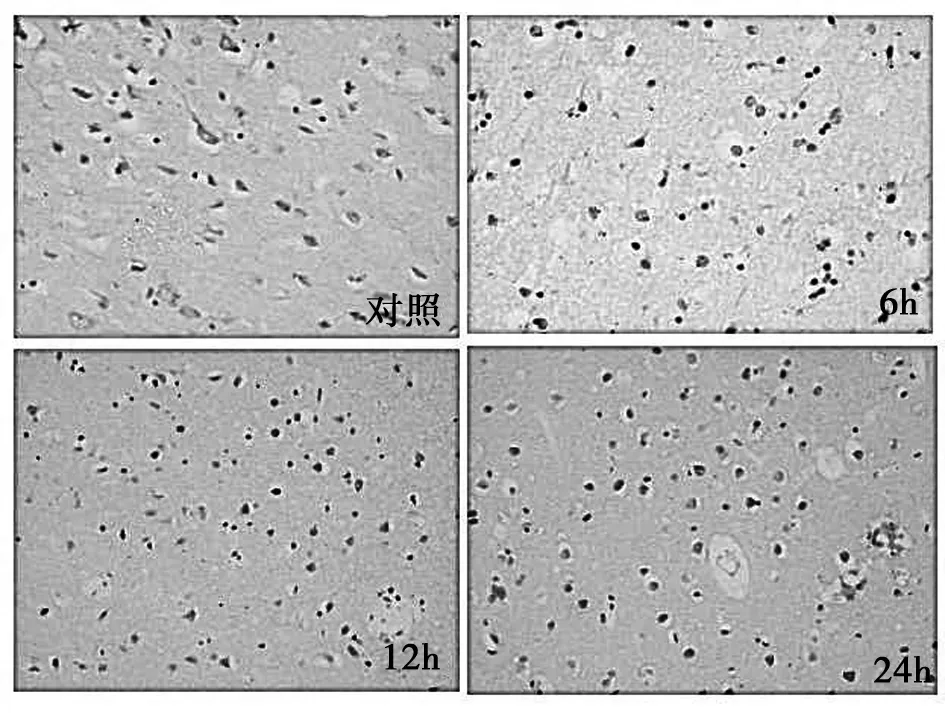
图1 不同损伤时间人脑挫伤半影区TUNEL染色结果(TUNEL×400)

图2 不同损伤时间人脑挫伤半影区Caspase-3免疫组化染色结果(免疫组化×400)
2.3 Caspase-3免疫组化染色阳性染色呈棕黄色,位于神经细胞浆内,阴性细胞为蓝色。Caspase-3染色阳性部位和TUNEL染色阳性细胞分布相似,主要分布在挫伤灶中央及其周围的半影区,两者有显著差异,P<0.05,半影区比中央区更显著;其他部位呈阴性;表达的时序性改变与TUNEL染色基本平行。半影区阳性率和阳性细胞的IOD均与损伤时间之间呈线性关系,r分别为0.92和0.90(见表2和图2)。中央区不同损伤时间组之间差异没有统计学意义,P>0.05。
3 讨论
脑损伤时间推断是法医病理学领域里的研究热点,许多学者试图通过检测颅脑损伤后病理生理过程中出现的某些细胞和细胞因子等指标,研究其在脑损伤后的表达变化,探索脑损伤时间推断的新方法。颅脑损伤后神经细胞凋亡是由许多调控基因和调节因子表达水平不断变化,引发的一系列级联反应的结果,在这一过程中存在时间—空间的规律性变化[5-6]。在法医学领域里对颅脑损伤后神经细胞凋亡及其调节因子表达变化的观察进行损伤时间推断的研究,国内仅有少量动物实验报道,尚无对人脑挫伤组织的研究报道;国外仅有少数几位学者的研究报道。Hausmann 等在证实大鼠脑损伤后神经细胞凋亡的实验研究基础上,提出人脑损伤后神经细胞凋亡数目的时序性变化,可以用于法医学损伤时间推断的设想[7]。Drebler 等观察到脑损伤时间与神经细胞及胶质细胞凋亡之间有相关性,认为神经细胞和胶质细胞的凋亡情况可以用于脑损伤早期推断损伤时间[8]。本研究发现,人脑挫伤半影区阳性细胞数目和染色深度随损伤时间延长,逐渐增加;TUNEL染色阳性率和IOD均与损伤时间之间有较好的线性关系,可以用于脑挫伤损伤时间推断。与Hausmann 和Drebler 等学者的观点一致。Caspase-3是天门冬氨酸特异性半胱氨酸蛋白酶Caspases超家族成员中较活跃的成员之一,参与细胞凋亡信号传导的级联反应,与细胞凋亡关系密切[9]。本研究表明,Casepase-3染色阳性部位和TUNEL染色阳性细胞相似,分布在脑挫伤灶的中央区及其周围的半影区,远隔部位和对照组呈阴性。表达的时序性变化与TUNEL染色基本平行。半影区的阳性细胞率和IOD有缓慢上升趋势。
脑损伤后神经细胞凋亡已在多种创伤性脑损伤动物模型中得到证实,HE染色难以反映,TUNEL染色和Caspase-3免疫组化则容易区分[10]。在法医损伤学方面,神经细胞凋亡被认为是脑损伤后引起继发性损害的主要原因,特别是迟发性神经元的坏死机制与神经细胞凋亡密切相关;神经细胞凋亡发生的部位比坏死出现的部位范围更广。本研究也观察到,人脑挫伤后2 h就会发生神经细胞凋亡;凋亡细胞主要分布在脑挫伤灶的中央区及其周围的半影区,半影区比中央区更显著,P<0.05;与远隔部位和对照组的阴性染色形成鲜明对比。与文献报道的人脑外伤后存在神经细胞凋亡,且与患者的病情严重程度、病程和愈后相关的结果一致[11]。因此,通过对神经细胞凋亡以及调控因子变化的观察,有助于鉴别生前、死后损伤和判断脑挫伤部位,为颅脑损伤的法医学鉴定和研究带来新的课题。
对比TUNEL染色和Caspase-3免疫组化染色的结果发现,两种染色方法的阳性率和阳性细胞IOD与脑损伤时间之间的线性关系基本相同。而且,检测半影区的阳性细胞率和IOD 2个参数,采用多元回归的方法分析,更有利于提高脑损伤时间推断的准确性。本研究中使用的人脑挫伤组织均来源于实际检案的案例尸检标本,而且TUNEL染色和Caspase-3免疫组化染色结合图像分析技术,结果客观、可靠,能够直接应用到法医学实践中。但TUNEL染色操作技术难度高、试剂昂贵,影响该技术的普及和应用。而Caspase-3免疫组化染色技术可以广泛应用于法医病理学检验实践[12]。
(致谢:感谢四川大学华西基础医学和法医学院法医病理教研室老师们对本课题研究的指导和支持,在此深表感谢!)
参考文献:
[1] Seth Love.Apoptosis and brain ischemia[J].Progress Neuro-Psychopharmacology Biological Psychiatry,2003,27:267-282.
[2] Tong-Chun Wena, Marta Rogidoa, Pierre Gressensb, et al.A reproducible experimental model of focal cerebral ischemia in the neonatal rat[J]. Brain Research Protocols,2004,13:76-83.
[3] Tashlykov V,Katz Y,Gazit V,et al.Apoptotic changes in the cortex and hippocampus following minimal brain trauma in mice[J].Brain Res,2007,1130: 197.
[4] Akira Hara, Masayuki Niwa, Tomohiko Iwai,et al. Neuronal apoptosis studied by a sequential TUNEL technique: a method for tract-tracing[J].Brain Research Protocols,1999,4:140-146.
[5] Dressler J,Vemuganti R. Apoptosis and gene expression after TBI[J].Legal Medicine,2009,11:54-55.
[6] 冰峰,苏宁.创伤性脑损伤后神经细胞凋亡的基因调控与干预[J].内蒙古医学杂志,2009,41(2):201-204.
[7] Hausmann R,Biermann T,Wiest I,et al.Neuronal apoptosis following human brain injury[J].Int J Legal Med,2004,118:32-36.
[8] Drebler J,Hanish U,Busuttil A, et al. Comments on Hausmann Neuronal apoptosis following human brain injury[J]. Int J Legal Med,2007,121(5):365-375.
[9] Slemmer J E,Zhu C,Landshamer S,et al.Causal role of apoptosis-inducing factor for neuronal cell death following traumatic brain injury [J]. Am J Pathol, 2008,173(6):1795-1805.
[10] Shaw K,MacKinnon MA,Raghupthi R. TUNEL-positive staining in white and gray matter after fatal head injury in man[J]. Clinic Neuropathology,2001,20(1):106-112.
[11] 段磊,王维平,张建生,等.创伤性颅脑损伤后神经细胞凋亡的研究[J].中国急救医学,2003,23(9):324-325.
[12] 吴旭,王保捷,张国华,等.大鼠脑损伤后Caspase-3表达的时间规律性研究[J].中国医科大学学报,2004,33(4):324-328.
