硫化氢对TGF-β1诱导的HK-2细胞上皮间充质转化的抑制作用
2012-06-20曹慧霞牛福坤尤冠巧邵凤民
曹慧霞,牛福坤,尤冠巧,阎 磊,朱 清,邵凤民
河南省人民医院肾病风湿免疫科郑州450003
肾小管间质纤维化是各种慢性肾脏疾病进展为终末期肾功能衰竭的共同途径,而肾小管上皮细胞发生上皮间充质转化(epithelial-mesenchymal transition,EMT)则是纤维化发生与进展的重要机制之一。转化生长因子-β1(transforming growth factor-beta 1,TGF-β1)是公认的EMT 调节因子[1],参与启动和完成体内整个EMT过程,同时它也能够诱导体外培养的肾小管上皮细胞发生转分化。硫化氢(H2S)是近年继CO、NO之后发现的第三种内源性气体分子,具有较强的抗炎症、抗氧化应激和抗细胞凋亡等生理功能[2]。已有研究[3]发现,血清 H2S可能在慢性肾脏病进程中发挥重要作用。H2S可以抑制TGF-β1诱导的人肺泡上皮细胞EMT进程,也可以抑制胰腺星状细胞的EMT[4-5]。而有关H2S是否可以抑制肾小管上皮细胞EMT进程还不清楚。该研究旨在探讨H2S对 TGF-β1诱导肾小管上皮细胞HK-2转分化的影响,并探讨其可能机制,为临床针对肾脏纤维化的治疗提供依据。
1 材料与方法
1.1 材料 HK-2细胞系(ATCC公司),DMEM/F12培养基(Gibco公司),胎牛血清(杭州四季青公司),TGF-β1(Peprotech 公司),2.5 g/L 胰蛋白酶(Genview公司),谷氨酰胺和DMSO(Amresco公司),青霉素及链霉素(华北制药厂),小鼠抗人E-cadherin及小鼠抗人α-平滑肌肌动蛋白(α-SMA)单克隆抗体、NaHS(Sigma公司),兔抗人磷酸化Smad 2/3(p-Smad2/3)多克隆抗体、小鼠抗人Smad2单克隆抗体(Santa Cruz公司),HRP标记大鼠抗小鼠标记IgG、HRP标记羊抗兔IgG(北京中杉金桥生物技术有限公司)。
1.2 细胞培养 HK-2细胞复苏后,用含体积分数10%胎牛血清、100 kU/L青霉素、100 kU/L链霉素的DMEM/F12培养液,在37℃、体积分数5%CO2条件下培养,当传代细胞长至70% ~80%融合,用无血清培养液静止24 h进行同步化处理后,用于实验。
1.3 实验分组 实验分4组。正常对照组:常规培养;NaHS组:选用NaHS作为H2S供体,根据预实验结果选用 100 μmol/L NaHS 干预;TGF-β1 组:用 10 μg/L TGF-β1 干预;NaHS+TGF-β1 组:用 TGF-β1(10 μg/L)与 NaHS(100 μmol/L)共同干预。分别于培养 0、15、30和60 min后,收集各组细胞,进行p-Smad2/3和Smad2蛋白检测;培养48 h后,收集各组细胞,进行细胞形态观察和α-SMA及E-cadherin蛋白检测。
1.4 目标蛋白的Western blot检测 在相应时间点弃培养基,PBS清洗细胞2次,加入细胞裂解液裂解细胞,4℃ 1 000 g离心20 min,留取上清。Bradford法测定蛋白浓度。待测样品按80 μg/孔上样,行100 g/L SDS-PAGE电泳,然后将蛋白转移到PVDF膜上。50 g/L脱脂奶粉于37℃封闭1 h,加小鼠抗人α-SMA、E-cadherin单克隆抗体(按200倍稀释)或兔抗人p-Smad2/3多克隆抗体、小鼠抗人Smad2单克隆抗体(按1 000倍稀释)4℃孵育过夜,加HRP标记的大鼠抗小鼠IgG(按5 000倍稀释)37℃孵育1 h,ECL显影成像。以GAPDH为内参,应用Quantity One系统对特异性条带进行吸光度测定,以目标蛋白与GAPDH条带吸光度的比值表示目标蛋白的相对表达量。以(p-Smad2/3)/Smad2相对表达量的比值表示Smad2/3磷酸化水平。实验重复3次。
1.5 统计学处理 应用SPSS 15.0进行数据分析。4组细胞α-SMA和E-cadherin蛋白相对表达量以及同一时间点(p-Smad2/3)/Smad2的比较采用2×2析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 4组细胞的形态表现 4组细胞孵育48 h后的形态见图1。正常对照组细胞多呈圆形或卵圆形,偶有细胞呈轻度多角形变;NaHS组细胞形态与正常对照组相似;TGF-β1组细胞形态发生明显改变,大多数细胞呈长梭形,细胞间隙明显增宽,类似肌成纤维细胞;NaHS+TGF-β1组细胞发生梭形变的程度较TGF-β1组明显减轻。
2.2 4组细胞α-SMA和E-cadherin蛋白的表达结果见图2、表1和2。
2.34 组细胞不同时间点(p-Smad2/3)/Smad2的比较 结果见图3、表3。

图1 4组细胞的形态(倒置显微镜,×200)
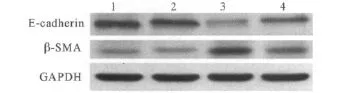
图2 4组细胞E-cadherin和α-SMA蛋白的表达

表1 4组细胞E-cadherin蛋白表达的比较(n=3)
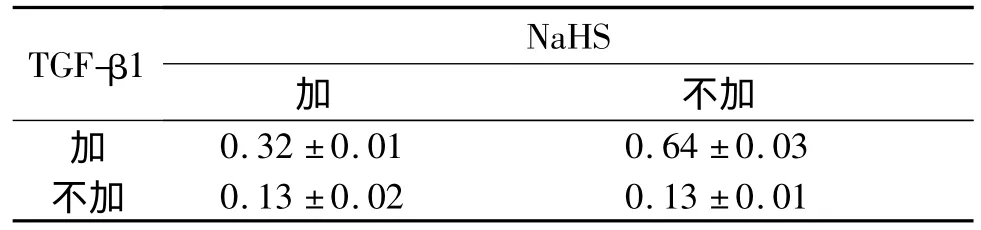
表2 4组细胞α-SMA蛋白表达的比较(n=3)

图3 4组细胞p-Smad2/3和Smad2蛋白的表达

表3 4组细胞(p-Smad2/3)/Smad2比值的比较(n=3)
3 讨论
肾小管EMT作为肾小管间质纤维化的重要机制之一,近年来一直备受关注。2002年,Iwano等[6]的研究显示,在肾间质纤维化进程中约36%肾间质成纤维细胞来源于EMT,而这些转分化来源的成纤维细胞具有更强的分泌细胞外基质的能力。Liu等[7]将EMT的主要过程归结为4步:①失去上皮细胞特征,失去上皮间紧密连接,如E-cadherin的表达受抑。②表达间充质细胞特征分子,肌动蛋白重排。③肾小管基底膜破坏。④细胞移动性和侵袭性增强。而TGF-β1则被认为是惟一的必须参与启动和完成整个EMT过程的细胞因子[8]。该研究结果显示,应用 10 μg/L TGF-β1 刺激 HK-2 细胞48 h,HK-2细胞发生了转分化,而转分化后的细胞E-cadherin蛋白表达下降,α-SMA蛋白表达升高,证实TGF-β1在肾小管上皮细胞EMT中发挥了重要作用。
H2S之前一直作为有毒气体被大家所认识,近些年人们才发现H2S还是一种具有生理/病理生理功能的内源性气体信号分子。已有的研究显示,H2S在体内心血管、神经、消化、呼吸等多个系统均发挥着重要的生物学效应,其在肾脏中的作用也正受到越来越多的重视。Xia等[9]的研究结果显示,肾组织自身可表达胱硫醚γ-裂解酶(CSE)、胱硫醚合成酶(CBS)等主要的H2S合成酶,用以独立合成内源性H2S;而内源性H2S不仅可以通过调节肾血管和肾小管活性来参与肾功能的调控,也可通过维持肾小球结构完整性、感受肾实质氧分压的变化等途径调控肾功能。Perna等[10]发现,血液透析患者血浆H2S浓度显著降低,体内CBS等表达减少,而血中H2S浓度的减少可能是血液透析患者心血管并发症形成的重要原因之一。Aminzadeh等[11]在大鼠5/6肾切除模型中同样发现H2S浓度和H2S合成酶表达的下降,而体内相关氧化应激产物则显著增加,推测H2S对慢性肾脏病的影响与其抗氧化应激的作用有关。陈燊等的系列研究[12-13]结果显示,补充外源性H2S有可能通过抑制糖尿病肾病模型大鼠肾脏中成肌纤维细胞的生成,减轻细胞外基质的过度积聚,从而有效地抑制糖尿病肾病的病理改变。
虽然到目前为止有关H2S与EMT或脏器纤维化的关系研究相对较少,但已有的报道[4-5]结果均提示H2S可延缓EMT或脏器纤维化进程。该研究以体外培养的HK-2细胞为研究对象,以NaHS作为H2S供体,观察 H2S对 TGF-β1诱导的 HK-2细胞EMT的影响,结果发现 NaHS+TGF-β1组细胞较TGF-β1组细胞 E-cadherin蛋白表达显著升高,α-SMA蛋白表达则明显下降,同时也部分保留了上皮细胞的形态特征,表明H2S对TGF-β1诱导的人肾小管EMT有抑制作用。
TGF-β/Smad信号转导通路目前被认为是惟一介导TGF-β1胞内信号转导的通路,而p-Smad2/3是TGF-β1/Smad信号通路中的重要信号转导分子,其蛋白表达量则是TGF-β1/Smad信号通路激活程度的标志。作者分别观察了TGF-β1组和NaHS组HK-2细胞中p-Smad2/3表达的变化,发现TGF-β1组p-Smad2/3水平较正常对照显著增高,NaHS+TGF-β1组却较 TGF-β1组显著下降,这与 Fang等[4]在肺泡上皮细胞中的研究结果一致。提示H2S可能通过抑制Smad2/3磷酸化来干扰TGF-β1诱导的EMT的进程,但其具体的作用机制尚有待进一步研究。
综上所述,该研究证实H2S可抑制TGF-β1诱导的HK-2转分化进程,而该作用可能在一定程度上通过影响Smad2/3磷酸化水平来完成。
[1]Derynck R,Akhurst RJ.Differentiation plasticity regulated by TGF-β family proteins in development and disease[J].Nat Cell Biol,2007,9(9):1000
[2]Predmore BL,Lefer DJ,Gojon G.Hydrogen sulfide in biochemistry and medicine[J].Antioxid Redox Signal,2012,17(1):119
[3]Perna AF,Ingrosso D.Low hydrogen sulphide and chronic kidney disease:a dangerous liaison[J].Nephrol Dialy Transplant,2012,27(2):486
[4]Fang LP,Lin Q,Tang CS,et al.Hydrogen sulfide attenuates epithelial-mesenchymal transition of human alveolar epithelial cells[J].Pharmacol Res,2010,61(4):298
[5]Schwer CI,Stoll P,Goebel U,et al.Effects of hydrogen sulfide on rat pancreatic stellate cells[J].Pancreas,2012,41(1):74
[6]Iwano M,Plieth D,Danoff TM,et al.Evidence that fibroblasts derive from epithelium during tissue fibrosis[J].J Clin Invest,2002,110(3):341
[7]Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212
[8]Iwano M.EMT and TGF-beta in renal fibrosis[J].Front Biosci(Schol Ed),2010,2:229
[9]Xia M,Chen L,Muh RW,et al.Production and actions of hydrogen sulfide,a novel gaseous bioactive substance,in the kidneys[J].J Pharmacol Exp Ther,2009,329(3):1056
[10]Perna AF,Luciano MG,Ingrosso D,et al.Hydrogen sulphide-generating pathways in haemodialysis patients:a study on relevant metabolites and transcriptional regulation of genes encoding for key enzymes[J].Nephrol Dial Transplant,2009,24(12):3756
[11]Aminzadeh MA,Vaziri ND.Downregulation of the renal and hepatic hydrogen sulfide(H2S)-producing enzymes and capacity in chronic kidney disease[J].Nephrol Dial Transplant,2012,27(2):498
[12]陈燊,黄雯,张红,等.内源性硫化氢在糖尿病肾病大鼠肾组织中表达[J].中国血液净化,2010,9(8):433
[13]黄雯,陈燊,杨敏,等.硫化氢对糖尿病大鼠肾脏病变的减缓作用[J].中国糖尿病杂志,2009,17(12):943
