胰腺癌组织中XAF1基因启动子区甲基化状态及XAF1蛋白的表达
2012-06-20赵永福杨红星卢宾宾
赵永福,杨红星,唐 哲,卢宾宾
郑州大学第一附属医院肝胆外科郑州450052
X染色体连锁凋亡抑制因子(X-linked inhibitor of apoptosis protein,XIAP)相关因子1(XIAP-associated factor-1,XAF1)是一个新发现的可以拮抗XIAP抗凋亡作用的蛋白,其在所有胚胎组织及成人正常组织中广泛表达,但在许多肿瘤组织和肿瘤细胞株中低表达甚至不表达,是一种潜在的肿瘤抑制因子[1-2]。XAF1位点的杂合性缺失及XAF1启动子区的CpG岛甲基化可能是其表达被抑制的机制[3-4]。作者采用甲基化特异性聚合酶链反应(methylationspecific PCR,MSP)及免疫组化SP法观察胰腺癌、胰腺良性疾病及正常胰腺组织中XAF1基因启动子区甲基化状态及XAF1蛋白的表达,探讨XAF1在胰腺癌发生、发展中的作用及意义。
1 材料与方法
1.1 标本来源 收集郑州大学第一附属医院2008年1月至2011年1月手术切除的胰腺癌、胰腺良性疾病和正常胰腺标本,标本均经病理学证实。胰腺癌组48例,患者中男36例,女12例,年龄37~75岁,≤55岁13例,>55岁35例;肿瘤位于胰头35例,位于胰腺体尾部13例;肿瘤直径<3 cm 33例,≥3 cm 15例;组织学类型为高分化13例,中分化27例,低分化8例;按照2002年国际抗癌联盟(UICC)制定的TNM分期标准,Ⅰ期6例,Ⅱ期19例,Ⅲ期16例,Ⅳ期7例;有淋巴结转移19例,无淋巴结转移29例。胰腺良性疾病组26例,患者中男9例,女17例;胰岛素瘤20例,慢性胰腺炎6例。正常胰腺组15例,患者中男9例,女6例,其中外伤切除胰腺6例,十二指肠肿物切除获得的正常胰腺9例。所有患者术前均未给予放化疗。
1.2 胰腺组织中XAF1基因启动子区甲基化检测采用上海生工生物工程有限公司的UNIQ-10柱式动物基因组DNA抽提试剂盒提取组织DNA。采用EZ DNA Methylation-GoldTM试剂盒(ZYMO公司),按照说明书操作,对DNA进行亚硫酸盐修饰。采用GENMED公司MSP试剂盒进行扩增。引物参考文献[5],甲 基 化 上 游 引 物 序 列 5’-TTTGTA AGAAACGAAATTTAATCGA-3’,位置 -45~ -21;下游引物序列 5’-CCTACCCTTAAAACCCACGAT-3’,位置+182~+161;扩增产物大小228 bp。未甲基化上游引物序列5’-TTTGTAAGAAATGAAATT TAATTGA-3’,位置 -45~ -21;下游引物序列 5’-CTCCTACCCTTAAAACCCACAAT-3’,位置 +182 ~+161;扩增产物大小230 bp。MSP反应体系为25 μL。甲基化循环参数:95℃预变性9 min;95℃变性30 s,55 ℃退火30 s,72 ℃ 延伸30 s,35 个循环;72℃终延伸5 min。未甲基化循环参数:94℃预变性9 min;94℃变性30 s,54℃退火45 s,72℃延伸30 s,35个循环;72 ℃终延伸5 min。取产物5 μL,15 g/L琼脂糖凝胶电泳,紫外灯下观察并照相。
1.3 胰腺组织中XAF1蛋白检测
1.3.1 主要步骤 标本4 μm厚连续切片,按免疫组化SP法进行染色。切片脱蜡至水,pH 6.8枸橼酸钠缓冲液微波加热10 min进行抗原修复。PBS冲洗,加内源性过氧化物酶阻断剂室温孵育10 min,非免疫动物血清37℃封闭30 min。加一抗4℃孵育过夜(XAF1一抗按250倍稀释)。PBS冲洗,加二抗、三抗孵育,PBS洗3次,每次5 min。滴加现配的 DAB显色5 min,PBS终止,苏木素复染30 s,盐酸乙醇分化10 s,氨水返蓝后梯度乙醇脱水,二甲苯透明,树脂封片,显微镜下观察。阳性对照为试剂盒内提供的阳性玻片,以PBS代替一抗作为阴性对照。兔抗人XAF1多克隆抗体购自美国Santa Cruz公司,SP9001试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3.2 结果判断 XAF1蛋白阳性细胞主要表现为胞核和胞质棕黄色颗粒或团块状着色,亦可表达于核膜。每例观察5个高倍视野,根据肿瘤细胞染色程度及阳性细胞百分率进行评分。按阳性细胞百分率计分:无阳性细胞着色为0分,阳性细胞百分率<20%为1分,20% ~75%为2分,>75%为3分;按染色强度计分:无着色为0分,淡黄色为1分,黄色为2分,棕黄或棕褐色为3分。两项积分的乘积为总分,总分达0~3分为阴性,4~9分为阳性。
1.4 统计学处理 数据均利用SPSS 17.0进行分析,3组组织中XAF1基因启动子区甲基化率及XAF1蛋白阳性表达率的比较采用Fisher精确概率法或χ2检验,不同临床特征胰腺癌患者2指标的比较采用χ2检验,采用Pearson列联系数分析胰腺癌组织中2指标表达的关联性,检验水准α=0.05。
2 结果
2.1 3组胰腺组织中XAF1基因启动子区甲基化检测结果 分别用甲基化引物和未甲基化引物扩增经修饰的(甲基化阳性对照)和未修饰(甲基化阴性对照)的健康人外周血DNA,只有M引物和U引物得到预期大小的扩增片段,提示实验技术、引物正确,实验结果可靠。胰腺癌、胰腺良性疾病及正常胰腺组织中XAF1基因启动子区甲基化检测结果见图1、表 1。

图1 胰腺癌和正常胰腺组织中XAF1基因启动子区甲基化检测结果
2.2 3组胰腺组织中XAF1蛋白的表达 见图2和表1。

图2 胰腺癌(A)、良性疾病(B)和正常(C)组织中XAF1蛋白的表达(SP,×200)
2.3 胰腺癌组织中XAF1基因启动子区甲基化状态及蛋白表达与临床病理特征的关系 XAF1基因启动子区甲基化及其蛋白的表达与胰腺癌临床分期、分化程度及淋巴结转移有关,与患者性别、年龄、肿瘤大小、肿瘤位置无关,见表2。
2.4 胰腺癌组织中XAF1基因启动子区甲基化及蛋白表达的相关性 见表3,可以看出,胰腺癌组织中XAF1基因启动子区甲基化率与XAF1蛋白阳性表达率呈负关联(rP= -0.463,P <0.001)。

表1 3组胰腺组织中XAF1基因启动子区甲基化状态及XAF1蛋白的表达 例(%)
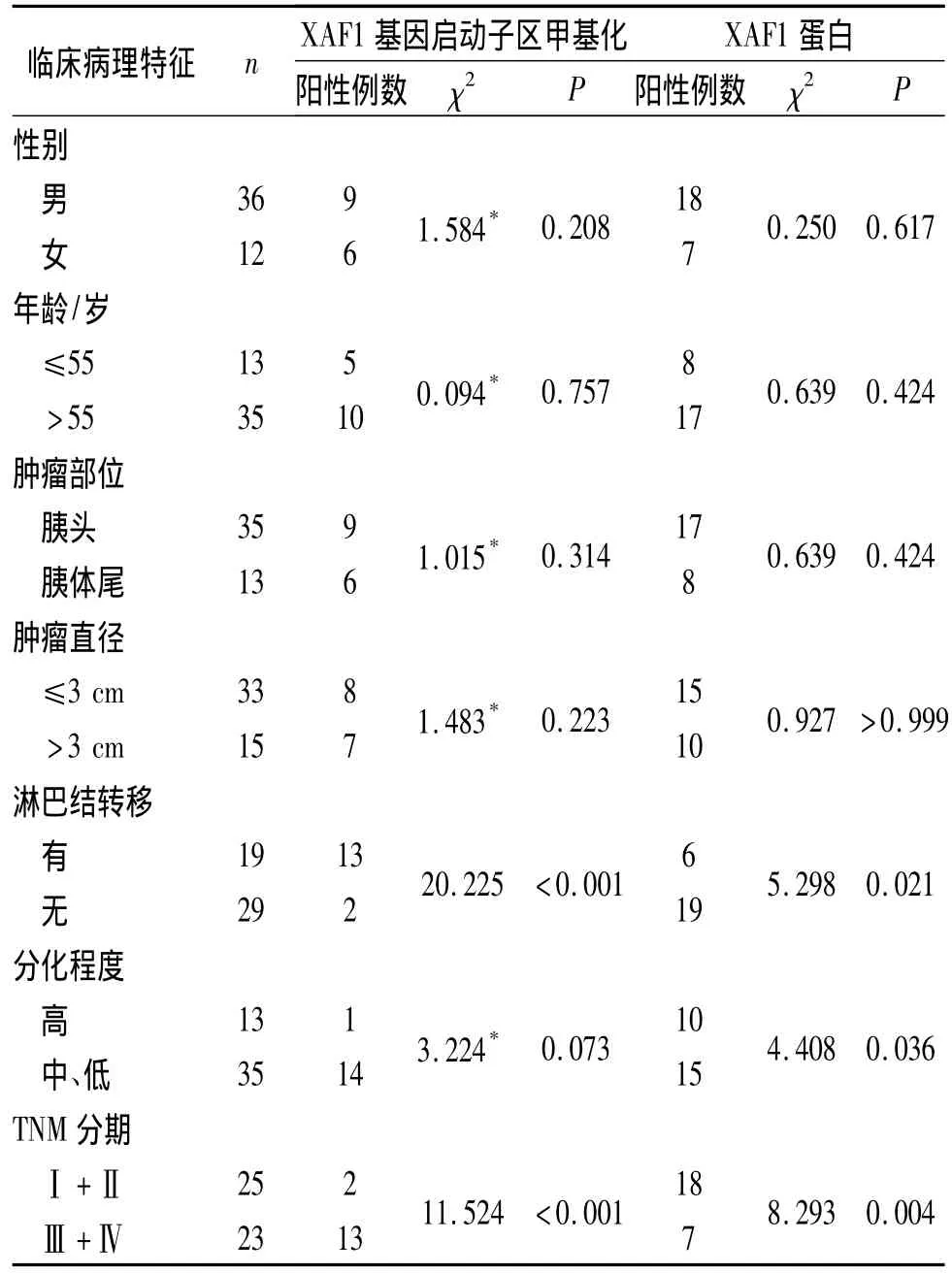
表2 胰腺癌中XAF1基因启动子区甲基化及蛋白表达与临床病理特征的关系

表3 胰腺癌组织中XAF1基因启动子区甲基化和XAF1蛋白表达的关联性
3 讨论
DNA甲基化是表观遗传学上研究最深入的一种机制,被认为是继突变、等位基因丢失后致抑癌基因失活的第二次打击[6]。抑癌基因由于5’端启动子区域CpG岛异常高甲基化从而抑制了mRNA的转录作用,导致该基因的沉默。抑癌基因的功能失活引发的下游事件导致了正常细胞的生长分化调控失常,与多种肿瘤的形成密切相关。
XAF1基因位于人类染色体17p13.2位点,有8个外显子,由301个氨基酸组成,相对分子质量为33 100,含有7个锌指结构。XAF1蛋白定位于胞质和胞核内,与XIAP相互作用后,从胞质转移至胞核,成为核内包涵体。XAF1蛋白可拮抗XIAP对细胞凋亡蛋白酶(caspase)的抑制作用,通过调控G2/M检查点,使G2/M细胞周期停滞,从而抑制肿瘤细胞生长[4]。XAF1 mRNA已被发现在多种肿瘤细胞株及肿瘤组织中低表达,如胃癌、结直肠癌、肝癌、肾透明细胞癌、前列腺癌和小细胞肺癌等[6-9]。有研究[3,6-9]表明,在肿瘤细胞和组织中,XAF1 基因存在启动子区异常高甲基化,甲基化程度与XAF1 mRNA表达水平呈负相关,并且与肿瘤的分期、分级有关。
在该研究中作者用MSP法检测胰腺癌、胰腺良性疾病及正常胰腺组织中XAF1基因启动子区的甲基化状态,结果显示胰腺癌组织中XAF1基因启动子区甲基化率达31.3%,明显高于胰腺良性疾病组织及正常胰腺组织。同时作者用SP法检测XAF1蛋白表达,结果显示,胰腺癌组织中XAF1蛋白阳性表达率明显低于良性疾病组织和正常胰腺组织。进一步的分析结果显示,XAF1基因启动子区甲基化及XAF1蛋白的表达与胰腺癌临床分期、肿瘤组织分化程度及淋巴结转移有关,提示XAF1启动子区高甲基化可能是导致该蛋白不表达的重要机制之一,最终参与了肿瘤的发生和发展。
因此,联合检测这两个因子可能对胰腺癌的辅助诊断及恶性程度评价有一定意义。通过对这两个因子在肿瘤细胞凋亡调控机制方面的进一步研究,有望寻找到一个有助于胰腺癌的早期诊断、恶性程度和预后判断的新指标。由于XAF1具有拮抗XIAP凋亡抑制作用和控制肿瘤生长的特性,恢复XAF1的表达和功能,以降低XIAP的表达,有可能成为胰腺癌药物治疗的一个新思路。
[1]Li T,Chen CL,Wang JD,et al.Expression of heat-shock transcription factor 1 and X-linked inhibitor of apoptosis protein-associated factor-1 in gastrointestinal cancer[J].Nan Fang Yi ke Da Xue Xue Bao,2008,28(3):487
[2]Arora V,Cheung HH,Plenchette S,et al.Degradation of survivin by the X-linked inhibitor of apoptosis(XIAP)XAF1 complex[J].J Biol Chem,2007,282(36):26202
[3]Xing Z,Zhou Z,Yu R,et al.XAF1 expression and regulatory effects of somatostatin on XAF1 in prostate cancer cells[J].J Exp Cin Cancer Res,2010,29:162
[4]Wang J,Gu Q,Li M,et al.Identification of XAF1 as a novel cell cycle regulator through modulating G2/M checkpoint and interaction with checkpoint kinase 1 in gastrointestinal cancer[J].Carcinogenesis,2009,30(9):1507
[5]Zou B,Chim CS,Zeng H,et al.Correlation between the single-site CpG methylation and expression silencing of the XAF1 gene in human gastric and colon cancers[J].Gastroenterology,2006,131(6):1835
[6]Byun DS,Cho K,Ryu BK,et al.Hypermethylation of XIAP-associated factor 1,a putative tumor suppressor gene from the 17p13.2 locus,in human gastric adenocarcinomas[J].Cancer Res,2003,63(21):7068
[7]姚宝珍,刘艳红,王则胜,等.凋亡抑制因子X-相关细胞凋亡抑制蛋白基因在肝细胞癌中的表达及临床意义[J].中华实验外科杂志,2007,24(5):624
[8]马天乐,金承荣,刘晓天,等.XAF1基因与p53基因在结直肠肿瘤中的表达研究[J].中华消化杂志,2005,25(6):351
[9]Hervouet E,Vallette FM,Cartron PF,et al.Impact of the DNA methyltransferases expression status of apoptosis-associated genes in glioblastoma multiforme[J].Cell Death Dis,2010,1:1
