山奈酚对CNE-2细胞周期及CyclinB1、Cdk1 mRNA表达的影响*
2012-06-20陈育华吴国才周碧云
陈育华,吴国才,王 珍,周碧云
1)广东医学院附属医院检验科湛江524001 2)广东医学院附属医院血液内科湛江524001 3)广东医学院附属医院肿瘤中心四区湛江524001
目前对于鼻咽癌的治疗仍以放疗辅助化疗为主,但不管是针对原发灶还是转移灶的放化疗,都不可避免地存在一定的毒副作用,因此,寻找一种高效低毒的抗鼻咽癌药物尤为重要。山奈酚主要是从姜科植物山奈根茎中提取的一种黄酮类化合物,能抑制食管癌细胞、类淋巴母细胞、骨肉瘤细胞等肿瘤细胞的生长[1-2]。该课题组前期研究发现山奈酚能抑制人鼻咽癌CNE-2细胞的增殖,诱导细胞凋亡,但作用机制尚不清楚。作者进一步观察了山奈酚对CNE-2细胞周期及相关调控基因CyclinB1、Cdk1表达的影响,以期阐明山奈酚抗鼻咽癌的作用机制,为鼻咽癌治疗药物的开发提供实验依据。
1 材料与方法
1.1 材料 山奈酚购自陕西慧科植物开发有限公司,用二甲基亚砜(DMSO)稀释成50 mmol/L的母液,-20℃保存,临用前用RPMI 1640培养液稀释成相应的浓度备用。CNE-2细胞由广东医学院肿瘤研究所传代并保存。2.5 g/L胰蛋白酶、MTT细胞增殖及细胞毒性检测试剂盒购自碧云天生物技术研究所;胎牛血清购自杭州四季青生物工程材料有限公司;RPMI 1640培养基、PI、RNase A为美国Sigma公司产品;总RNA抽提试剂盒及RT-PCR反应试剂盒为QIAGEN Germany公司产品;其余试剂均为国产分析纯。
1.2 山奈酚处理后CNE-2细胞活力的测定 将对数生长期的CNE-2细胞消化并制备成单细胞悬液,调整细胞密度为 5.0 ×104mL-1,按每孔 100 μL 接种于96孔培养板。待细胞贴壁后吸除全部培养液,分别换上含 0(对照)、20、40、60、80、100 μmol/L 山奈酚的培养液在孵箱中分别培养24、48、72 h,每个条件下设5个复孔。然后弃细胞培养液,每孔加入5 g/L的MTT 20 μL,继续培养4 h。小心吸弃各培养孔内上清液,加入DMSO 200 μL,充分振荡摇匀后以570 nm为测定波长、630 nm为参比波长,在全自动酶标仪上测各孔吸光度(A)。实验重复3次。细胞活力=实验孔平均A值/对照孔平均A值×100%。
1.3 山奈酚处理后CNE-2细胞周期的测定 按1.2接种CNE-2细胞于96孔培养板。待细胞贴壁后吸除全部培养液,分别换含 0、20、40、60、80、100 μmol/L山奈酚的培养液,在体积分数5%CO2培养箱中于37℃分别培养24和48 h。然后,经PI染液(含50 mg/L PI,10 mg/L Rnase A,体积分数 0.1%Triton X-100,1 g/L柠檬酸钠和生理盐水)悬浮细胞,4℃避光染色30 min,400目尼龙网过滤后上Epics-XL型(美国)流式细胞仪检测细胞周期。实验重复3次。
1.4 山奈酚处理后 CNE-2细胞 CyclinB1、Cdk1 mRNA的表达 收获经不同浓度山奈酚处理24 h的CNE-2细胞,提取细胞总 RNA,反转录得cDNA,以此为模板,进行PCR。用Primer Premier 5.0软件设计PCR引物,由上海生工生物工程技术服务有限公司合成。CyclinB1上游引物序列:5’-GCAAC CTCCAAGCCCGGACTG-3’,下游引物序列:5’-AAATAGGCTCAGGCGAAAGTT-3’,产物大小为265 bp;Cdk1上游引物序列:5’-CTGGGGTCAGCTCGT TACTCA-3’,下游引物序列:5’-TTTGGGAAATG TATTCTTATA-3’,产物大小为 204 bp;β-actin 上游引物序列:5’-AACGGCTCCGGCATGTGCAAG-3’,下游引物序列:5’-CACAGCCTGGATAGCAACGTA-3’,产物大小为384 bp。扩增条件:95℃预变性3 min;94℃变性30 s,55℃(CyclinB1和β-actin)或50℃(Cdk1)退火30 s,72℃延伸30 s,进行30个循环;最后再72℃继续延伸5 min。取目的产物6 μL,琼脂糖凝胶上电泳,溴化乙啶显色,用紫外灯观察并拍照,用Quantity one软件进行条带光密度测定,以目的基因与β-actin条带光密度的比值作为目的基因mRNA的相对表达量。实验重复3次。
1.5 统计学处理 数据采用SPSS 13.0进行分析,采用6×3析因设计的方差分析对细胞活力进行分析,应用单因素方差分析对细胞周期及CyclinB1、Cdk1 mRNA相对表达量进行分析,两两比较用LSD-t检验,检验水准 α =0.05。
2 结果
2.1 山奈酚处理后CNE-2细胞活力测定结果 见表1。
2.2 山奈酚处理后CNE-2细胞周期的变化 见表2、表 3。
2.3 山奈酚处理后CNE-2细胞CyclinB1及Cdk1 mRNA的表达 见图1、表4。

表2 山奈酚处理24 h后CNE-2细胞周期测定结果(n=3)%
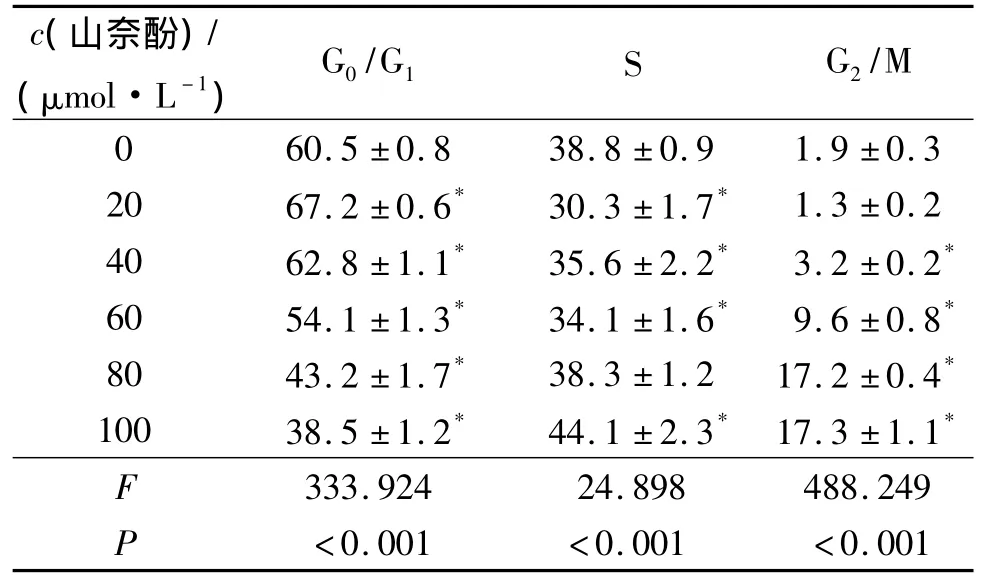
表3 山奈酚处理48 h后CNE-2细胞周期测定结果(n=3)%
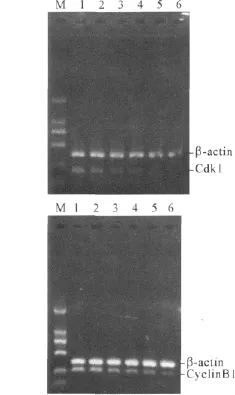
图1 山奈酚对CNE-2胞CyclinB1及Cdk1 mRNA表达的影响

表4 山奈酚处理24 h后CNE-2细胞CyclinB1及Cdk1 mRNA的相对表达量(n=3)
3 讨论
肿瘤的发生与细胞增殖及凋亡失衡有关,而细胞周期的调控在细胞增殖、分化、凋亡过程中发挥着重要作用。该实验发现,山奈酚能显著抑制鼻咽癌CNE-2细胞的生长。山奈酚作用后CNE-2细胞G0/G1期比例降低,S期及G2/M期比例增加,说明山奈酚可使CNE-2细胞DNA合成增加,但阻止其分裂,使细胞周期阻滞于G2/M期,使之无法完成有丝分裂,从而抑制其增殖活性。这与山奈酚能使人食管鳞癌细胞株 KYSE-510[3]、人宫颈癌 HeLa 细胞[4]发生G2/M期阻滞的报道相一致。
细胞周期有 G0/G1、G1/S、G2/M 3个调控点,其调控因子包括细胞周期素(Cyclin)、周期素依赖性激酶(CDK)和周期素依赖性激酶抑制剂(CDKI)。在所有参与M期调控的激酶中,Cdk1是最重要的,它与CyclinB1形成复合物CyclinB1/Cdk1,控制真核细胞从G2到M期的移行过程。该实验结果表明,20~100 μmol/L山奈酚作用 24 h后,CNE-2细胞CyclinB1及Cdk1 mRNA的表达均随山奈酚浓度的增加而下降,两者的变化趋势相似。提示山奈酚能通过下调 CyclinB1及 Cdk1的转录水平而阻滞CNE-2细胞于G2/M期。目前有关黄酮类化合物对肿瘤细胞CyclinB1及Cdk1表达的影响有不同报道。Xu等[4]研究发现山奈酚能以非p53依赖的方式诱导人宫颈癌HeLa细胞发生G2/M期阻滞,在mRNA及蛋白水平下调CyclinB1及 Cdk1的表达。而另一些学者研究[5]发现槲皮素能使人白血病细胞阻滞于G2/M期,这与Cyclin B1及p21(Cip1)在细胞内的大量积累以及 Cyclin B1、Cdc2、Cdc25C、MPM-2磷酸化状态的改变有关。在人乳癌SK-BR-3细胞,芹菜(苷)能诱导G2/M期细胞的积累,从而导致Cdc2、Cyclin A 及 Cyclin B 蛋白表达的下调[6]。而 Li等[7]发现槲皮素(大于 40 μmol/L)既可以通过降低CyclinB1蛋白表达将结肠癌细胞SW480阻滞在G2/M期,又可以通过增强CyclinB1的表达以及增加CDC2激酶的活性将肺癌细胞株NCI-H209周期阻滞于G2/M期。可见黄酮类化合物对肿瘤细胞CyclinB1/Cdk1复合物的影响因黄酮类化合物种类及其作用的肿瘤细胞类型不同而不同。
综上所述,山奈酚通过下调 CyclinB1及Cdk1 mRNA的表达水平,阻滞CNE-2细胞于G2/M期,这可能是山奈酚抑制CNE-2细胞增殖的机制之一,但能否在蛋白水平也下调CyclinB1及Cdk1的表达以及山奈酚对Cdk1的磷酸化程度影响如何仍有待进一步研究。
[1]Bhouri W,Bouhlel I,Boubaker J,et al.Induction of apoptosis in human lymphoblastoid cells by kaempferol 3-O-β-isorhamninoside and rhamnocitrin 3-O-β-isorhamninoside from Rhamnus alaternus L.(Rhamnaceae)[J].Cell Prolif,2011,44(3):283
[2]Huang WW,Chiu YJ,Fan MJ,et al.Kaempferol induced apoptosis via endoplasmic reticulum stress and mitochondria-dependent pathway in human osteosarcoma U-2 OS cells[J].Mol Nutr Food Res,2010,54(11):1585
[3]Zhang Q,Zhao XH,Wang ZJ.Cytotoxicity of flavones and flavonols to a human esophageal squamous cell carcinoma cell line(KYSE-510)by induction of G2/M arrest and apoptosis[J].Toxicol In Vitro,2009,23(5):797
[4]Xu W,Liu J,Li C,et al.Kaempferol-7-O-β-D-glucoside(KG)isolated from Smilax china L.rhizome induces G2/M phase arrest and apoptosis on HeLa cells in a p53-independent manner[J].Cancer Lett,2008,264(2):229
[5]Torres F,Quintana J,Estévez F.5,7,3'-Trihydroxy-3,4'-dimethoxyflavone inhibits the tubulin olymerization and activates the sphingomyelin pathway[J].Mol Carcinog,2011,50(2):113
[6]Choi EJ,Kim GH.Apigenin causes G(2)/M arrest associated with the modulation of p21(Cip1)and Cdc2 and activates p53-dependent apoptosis pathway in human breast cancer SK-BR-3 cells[J].J Nutr Biochem,2009,20(4):285
[7]Li RQ,Shan BE.Effects of Quercetin on proliferation,cell cycle and cyclin B1 protein expression of colon carcinoma cell line SW480[J].Carcinogenesis,Teratogenesis &Mutagenesis,2007,19(5):384
