LTQ-Orbitrap液-质联用技术对水牛奶酪蛋白的鉴定
2012-04-01王丽娜徐明芳成希飞向明霞李子超李昀锴
王丽娜,徐明芳,成希飞,向明霞,李子超,李昀锴
(暨南大学生命科学技术学院,广东 广州 510632)
LTQ-Orbitrap液-质联用技术对水牛奶酪蛋白的鉴定
王丽娜,徐明芳*,成希飞,向明霞,李子超,李昀锴
(暨南大学生命科学技术学院,广东 广州 510632)
建立一种快速、高效的分析酪蛋白组分氨基酸序列的LTQ-Orbitrap质谱方法。为了研究水牛奶酪蛋白、乳牛奶酪蛋白和山羊奶酪蛋白的氨基酸序列组成及氨基酸的替换现象,采用LTQ-Orbitrap液-质联用技术分别对乳源酪蛋白的4种主要组分进行分析,搜索数据库获得4种组分的氨基酸全序列。与水牛奶4种酪蛋白组分进行比对。结果表明,乳牛奶的4种酪蛋白发生氨基酸替换的部位和比率明显小于山羊奶。这意味着与水牛奶酪蛋白相比,乳牛奶酪蛋白氨基酸的稳定性优于山羊奶酪蛋白。
水牛奶;酪蛋白;氨基酸序列;酪蛋白结构;LTQ-Orbitrap质谱
水牛奶是我国奶业特别是我国南方奶业的一个重要发展方向,其主要营养成分高于荷斯坦乳牛奶,是未来最具市场竞争力的乳品[1]。国内外对水牛奶的研究越来越多,主要是常规营养成分[2-3]、理化性质[4-5]、稳定性[6]、乳蛋白质的组成和特性[7-8]以及蛋白分离分析[9-12]等方面的研究,在水牛奶酪蛋白(casein,CN)组分的肽质指纹谱、氨基酸序列谱等方面的研究则未见报道。
质谱(mass spectrometry,MS)是蛋白质组学研究的关键技术,在对蛋白质结构分析的研究中占据了重要地位。蛋白质鉴定是蛋白质组学研究的分支,传统的鉴定方法有Edman降解法、氨基酸分析法等。Edman降解法测定的肽序列非常准确,但速度较慢,费用较高。氨基酸分析法经济快速,但灵敏度低[13]。二维线性离子阱高分辨静电场组合质谱仪(LTQ Orbitrap XL)是目前最先进的质谱仪,它将LTQ与获得专利的Orbitrap技术整合,具有无可超越的MS和MSn的灵敏度、快速扫描率、高质量精确度和高达100K的分辨能力,并具有新的HCD八极碰撞单元的特性,可以在MS/MS裂解应用中增加灵活性,具有直接从复杂样品中快速、灵敏、可靠的检测化合物的能力。LTQ Orbitrap XL质谱可提供蛋白质定量信息,如SILAC、O18等标记定量的蛋白,分析蛋白质的分子质量,氨基酸序列、蛋白质磷酸化位点、差异蛋白比较等信息。
本实验主要利用LTQ-Orbitrap组合型傅里叶转换质谱仪对水牛奶酪蛋白的酶解肽段进行质谱分析,检测各产物肽的相对分子质量,然后在数据库中检索,寻找蛋白的氨基酸序列,并与乳牛奶酪蛋白和山羊奶酪蛋白相对应组分的氨基酸序列比对,研究其氨基酸序列间的差异性。
1 材料与方法
1.1 材料、试剂与仪器
水牛奶、荷斯坦乳牛奶、山羊奶 市售。
乙腈、碳酸氢铵、三氟乙酸(TFA)、DL-二硫苏糖醇(DTT)、吲哚-3-乙酸(IAA) 美国Sigma公司;胰蛋白酶 美国Promega公司;30g/100mL丙烯酰胺贮备液、1.0mol/L Tris-HCl缓冲液(pH6.8)、1.5mol/L Tris-HCl缓冲液(pH8.8)、10g/100mL过硫酸铵、10g/100mL SDS溶液、N, N, N,, N, -四甲基乙二胺(TEMED)溶液;5×样品缓冲液(1.25mL 1.0mol/L Tris-HCl缓冲液(pH6.8),0.5g SDS,2.5mL 100%甘油,25mg溴酚蓝,0.25mL β-巯基乙醇,全部混合后用水稀释定容至5mL);电极缓冲液(0.025mol/L Tris,0.192mol/L甘氨酸,0.1g/100mL SDS,pH8.3);染色液(0.2g/100mL考马斯亮蓝R-250,45%甲醇,10%冰醋酸);脱色液(10%冰醋酸,25%乙醇)。
LTQ Orbitrap XL质谱仪 美国Thermo公司;C18反相色谱柱 美国Michrom Bioresources公司;SCIENTZ-11D型超声波细胞破碎仪 宁波新芝生物仪器公司;小型高速冷冻离心机 德国Eppendorf公司。
1.2 方法
1.2.1 酪蛋白的提取
取20mL新鲜水牛奶,4000r/min离心20min,收集下层脱脂乳,1mol/L HCl溶液调pH值至4.6,4000r/min离心15min,弃上清。沉淀用蒸馏水洗涤两次,丙酮洗涤两次,每次4000r/min离心10min,收集沉淀,风干,-2 0℃保存备用。
1.2.2 酪蛋白溶液的酶解实验
SDS-PAGE电泳:上样量10μL;5%浓缩胶,10%分离胶;浓缩电压60V,分离电压100V。
蛋白酶解:目标蛋白切胶回收,纯化水洗胶两次,加入70μL脱色液,37℃水浴30min,然后用100%乙腈脱水处理。加入还原剂,于57℃水浴1h,随后加入同体积的烷基化试剂,室温避光放置30min,经乙腈脱水至胶块完全变白后于每管中加入胰蛋白酶溶液2~ 4μL,冰浴20min,再加20μL覆盖液,37℃水浴酶解16h。酶解结束后于真空干燥仪中冻干。
1.2.3 质谱分析
冻干的酶解片段用样品溶解液溶解,充分振荡涡旋,于13200r/min、4℃离心10min,取上清液进行质谱分析。样品经C18反相柱(100mm×75μm,3μm)分离后,直接用LTQ-Orbitrap XL检测。肽段在反相柱上的洗脱梯度是5%~45%乙腈(含0.1%甲酸)洗脱60min,流速为300nL/min。
质谱主要参数设置如下:离子传输管温度为200℃;电喷雾电压是1.85kV。一级质谱在Orbitrap里扫描,扫描范围是400~2000D,二级质谱在LTQ里用CID碰撞模式完成,标准化碰撞能量为35%,活化q值为0.25和活化时间为30ms。所以信息用Mascot软件进行数据库检索,得到最合适的鉴定结果。
2 结果与分析
2.1 水牛奶酪蛋白的总离子流色谱
图1 水牛奶酪蛋白酶解液的总离子流指纹图谱Fig.1 Total ion current fingerprint of water buffalo milk casein hydrolysate
胰蛋白酶酶解的水牛奶酪蛋白的多肽混合物经LTQOrbitrap XL液-质联用分析,获得样品的总离子流色谱图,见图1。在质谱分析过程中,精确质量数扫描可以确定离子所带电荷数,利用二级质谱得到的碎片离子可识别肽段的氨基酸序列。如多肽混合物中检测出离子的m/z分别为684.4、844.5、995.6、1014.4,精确质量数扫描表明该4种离子均带有两个电荷,二级质谱扫描结果表明,4种离子的氨基酸序列分别为ALNEINQFY QK(图2A)、HQGLPQGVLNENLLR(图2B)、SPAQILQWQ VLPNTVPAK(图2C)和FQSEEQQQMEDELQDK(图2D),经鉴定,这些序列分别是αs2-、αs1-、κ-和β-酪蛋白的部分肽段。

图2 LTQ质谱鉴定得到的肽段的二级质谱图Fig.2 MS-MS spectra of peptides identified by LTQ mass spectrometry
2.2 αs1-酪蛋白的氨基酸序列测定结果
酪蛋白酶解得到的肽混合液经LC分离后直接用LTQ-Orbitrap质谱仪检测,识别出的部分肽段信息见表1。经鉴定明,此酪蛋白是αs1-酪蛋白前体,含有一个由15个氨基酸残基组成的高度保守的信号肽序列。αs1-酪蛋白由199个氨基酸残基组成,其完整的氨基酸序列见图3。同样的方法用于乳牛奶和山羊奶αs1-酪蛋白的氨基酸序列的分析,并将3种品种的αs1-酪蛋白进行序列比对,结果发现,水牛奶αs1-酪蛋白的序列与乳牛奶和山羊奶的αs1-酪蛋白存在多处氨基酸替换,但与山羊奶αs1-酪蛋白的差异更大,特别是在3~16位氨基酸区段。
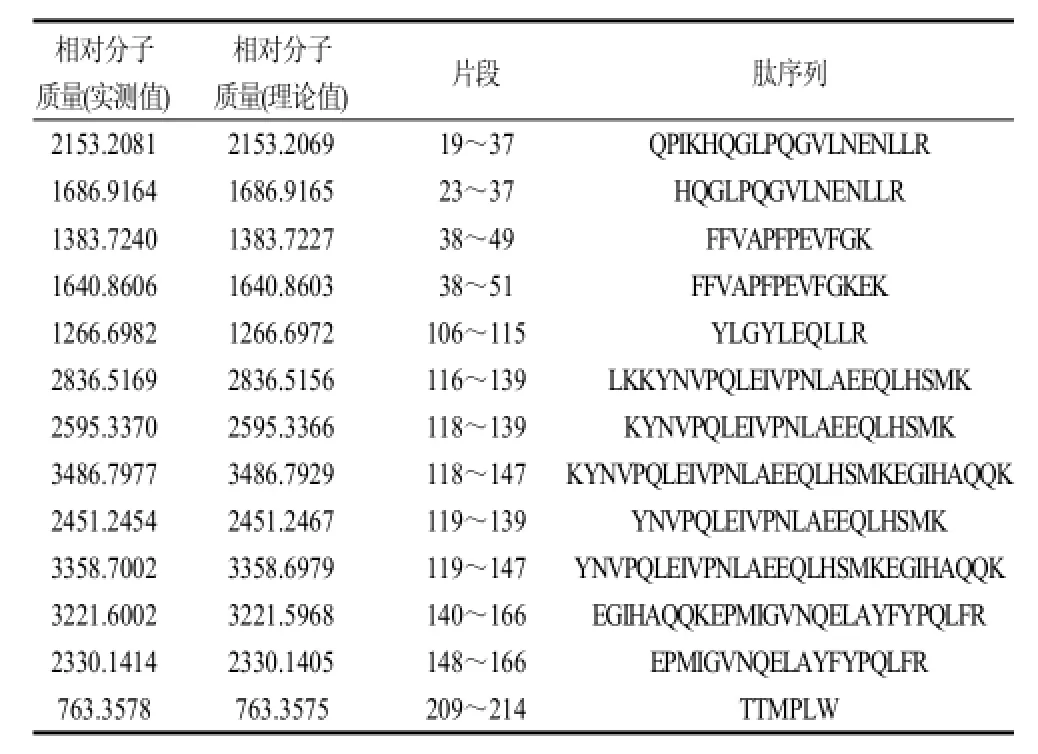
表1 水牛奶αs1-酪蛋白的肽段鉴定Table1 Peptides identified in water buffalo milk αs1-casein

图3 水牛奶、乳牛奶和山羊奶αs1-酪蛋白的氨基酸序列对比Fig.3 Comparison of amino acid sequences of water buffalo, cow and goat milkαs1-caseins
2.3 αs2-酪蛋白的氨基酸序列测定结果
实验中未搜索到与水牛奶αs2-酪蛋白相匹配的氨基酸序列,按Mascot得分、匹配的片段数和覆盖率等进行综合评判,仅搜索到乳牛奶αs2-酪蛋白前体相关信息(表2)。这可能是因为水牛奶中αs2-酪蛋白的氨基酸序列与乳牛奶αs2-CN的氨基酸序列高度一致,结果有待进一步的证明。从实验结果可推测,在鉴定酪蛋白的种属来源时,以αs2-CN的氨基酸序列为标准容易发生错误。

表2 乳牛奶αs2-酪蛋白的肽段鉴定Table2 Peptides identified in cow milkαs2-casein

图4 乳牛奶和山羊奶αs2-酪蛋白的氨基酸序列对比Fig.4 Comparison of amino acid sequences of water buffalo, cow and goat milkαs2-caseins
图4是乳牛奶与山羊奶αs2-酪蛋白的氨基酸序列对比。与αs1-酪蛋白一样,αs2-酪蛋白也含有一个由高度保守的15个氨基酸组成的信号肽序列。以乳牛奶αs2-酪蛋白的序列为基准,山羊奶αs2-酪蛋白在14~15个氨基酸区段多了一个氨基酸(N),即天冬酰胺,在29~41氨基酸区段与乳牛奶的差异最大,氨基酸替换频繁。如乳牛奶αs2-酪蛋白序列中第16位上的丝氨酸残基(S)被替换为山羊奶αs2-酪蛋白上的苯丙氨酸残基(F),G55替换为R55,R170替换为Y170,等。
2.4 β-酪蛋白的氨基酸序列的测定结果

表3 水牛奶β-酪蛋白的肽段鉴定Table3 Peptides identified in water buffalo milk β-casein
表3是水牛奶β-酪蛋白前体的部分肽段信息。β-酪蛋白有一个高度保守的15个氨基酸残基的信号肽序列,成熟的β-酪蛋白序列随物种的改变而发生不同氨基酸的替换。质谱鉴定结果表明,水牛奶β-酪蛋白由209个氨基酸残基组成,其序列与乳牛奶β-酪蛋白仅有5个氨基酸的替换,该结论与Fiat等[14]的研究结果一致。

图5 水牛奶、乳牛奶和山羊奶β-酪蛋白的氨基酸序列对比Fig.5 Comparison of amino acid sequences of water buffalo, cow and goat milkβ-caseins
由图5可知,5个氨基酸替换分别发生在第25、41、68、92、148位残基上。山羊奶β-酪蛋白只含有207个氨基酸残基,在第180、181氨基酸位点上缺失了两个氨基酸:酪氨酸(Y)和脯氨酸(P),与水牛奶β-酪蛋白相比,共有12处的氨基酸被替换。
2.5 κ-酪蛋白的氨基酸序列测定结果

表4 水牛奶κ-酪蛋白的肽段鉴定Table4 Peptides identified in water buffalo milk κ-casein
κ-酪蛋白与其他酪蛋白组分不同,是唯一对钙不敏感且含有糖基的组分,在酪蛋白胶体的稳定性方面也起着重要的作用。LTQ-Orbitrap质谱鉴定结果表明,κ-酪蛋白前体含有190个氨基酸,部分肽段信息见表4。与其他3种酪蛋白组分不同[15],κ-酪蛋白有一个由21个高度保守的氨基酸残基组成的信号肽序列。
水牛奶κ-酪蛋白完整的氨基酸序列以及与乳牛奶和山羊奶的κ-酪蛋白的氨基酸序列的对比见图6。

图6 水牛奶、乳牛奶和山羊奶κ-酪蛋白的氨基酸序列对比Fig.6 Comparison of amino acid sequences of water buffalo, cow and goat milk κ-caseins
如图6所示,水牛奶和乳牛奶的κ-酪蛋白都是由169个氨基酸残基组成的,而山羊奶的κ-酪蛋白则是由171个氨基酸残基组成的,在131~132氨基酸区段增加了两个氨基酸:缬氨酸(V)和组氨酸(H)。经比对,3种不同品种来源的κ-酪蛋白在第120~169氨基酸区段的差异较其他区段的差异大,氨基酸替换现象频繁。
3 结 论
酪蛋白经胰蛋白酶酶解的肽段,通过C18反相柱分离后直接用LTQ-Orbitrap质谱仪进行鉴定分析。搜索数据库获得来源于水牛奶的αs1-、β-、κ-酪蛋白的氨基酸全序列,αs2-酪蛋白仅分析到与之匹配度最高的来源于乳牛奶的氨基酸序列。同样的方法分析乳牛奶和山羊奶酪蛋白组分的氨基酸序列,并与水牛奶相对应的组分的序列比对,结果表明,不同品种的乳源酪蛋白的氨基酸序列均不相同,存在氨基酸替换现象。在酪蛋白的氨基酸序列对比中,水牛奶与山羊奶的差异比与乳牛奶的差异大。
[1]谢秉锵, 解冠华, 陈红兵. 水牛奶乳制品深加工的研究进展[J]. 食品科技, 2007, 32(7): 9-12.
[2]梁明振, 杨炳壮, 苏安伟, 等. 水牛奶营养价值评价[J]. 广西畜牧兽医, 2007, 23(3): 124-126.
[3]许小刚, 周雪松, 曾建新. 粒径分析法快速判定均质工艺对水牛奶稳定性的影响[J]. 中国乳品工业, 2009, 37(1): 42-44.
[4]韩刚, 丁庆波. 中国水牛奶理化性状研究[J]. 华南农业大学学报, 1994, 15(4): 92-97.
[5]曾庆坤, 杨炳壮, 梁坤, 等. 不同品代水牛奶理化性质的研究[J]. 中国乳品工业, 2007, 35(5): 13-15.
[6]TUINIER R, de KRUIF C G. Stability of casein micelles in milk[J]. Journal of Chemical Physics, 2002, 117(3): 1290-1295.
[7]ZICARELLI L. Buffalo milk: its properties, dairy yield and mozzarella production [J]. Veterinary Research Communications, 2004, 28(Suppl 1): 127-135.
[8]NAYAK S K, ARORA S, SINDHU J S, et al. Effect of chemical phosphorylation on solubility of buffalo milk proteins[J]. International Dairy Journal, 2006, 16(3): 268-273.
[9]FELIGINI M, BONIZZI I, BUFFONI J N, et al. Identification and quantification of αs1-, αs2-, β- and κ-caseins in water buffalo milk by reverse phase-high performance liquid chromatography and mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2009, 57 (7): 2988-2992.
[10]HAM J S, JEONG S G, LEE S G, et al. Irradiation effect on α- and βcaseins of milk and Queso Blanco cheese determined by capillary electrophoresis[J]. Radiat Phys Chem, 2009, 78(2): 158-163.
[11]BRAMANTI E, SORTINO C, RASPI G. New chromatographic method for separation and determination of denatured αs1-, αs2-, β- and κcaseins by hydrophobic interaction chromatography[J]. Journal of Chromatography A, 2002, 958(1/2): 157-166.
[12]CHEVALIER F, HIRTZ C, SOMMERER N, et al. Use of reducing/ nonreducing two-dimensional electrophoresis for the study of disulfidemediated interactions between proteins in raw and heated bovine milk[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5948-5955.
[13]张鹏, 朱育强, 陈新娟, 等. 差异蛋白质组学技术及其在园艺植物中的应用[J]. 中国农学通报, 2011, 27(4): 212-218.
[14]FIAT A M, JOLLES P. Caseins of various origins and biologically active casein peptides and oligosaccharides: structural and physiological aspects[J]. Molecular and Cellular Biochemistry, 1989, 87(1): 5-30.
[15]GINGER M R, GRIGOR M R. Comparative aspects of milk caseins[J]. Comparative Biochemistry and Physiology Part B, 1999, 124(2): 133-145.
Identification of Water Buffalo Caseins by Liquid Chromatography and LTQ-Orbitrap Mass Spectroscopy
WANG Li-na,XU Ming-fang*,CHENG Xi-fei,XIANG Ming-xia,LI Zi-chao,LI Yun-kai
(College of Life Science and Technology, Jinan University, Guangzhou 510632, China)
A rapid and efficient method to analyze the amino acid sequence of casein was presented using LTQ-Orbitrap mass spectroscopy coupled with liquid chromatography. In order to understand the amino acid sequence and substitution of cow, water buffalo and goat caseins, LTQ-Orbitrap mass spectroscopy coupled with liquid chromatography was used to analyze 4 major casein components, and their complete amino acid sequences were acquired by database searching. The amino acid substitutions of cow milk caseins were markedly lower than those of goat milk caseins. Thus, this study demonstrates that the amino acid sequences of cow milk caseins are more stable than those of goat milk caseins.
water buffalo milk;casein;amino acid sequence;casein structure;LTQ-Orbitrap mass spectrometry
Q657.6
A
1002-6630(2012)01-0098-05
2011-07-18
广东省科技计划项目(2009B011300003)
王丽娜(1985—),女,硕士,研究方向为应用微生物及微生物工程。E-mail:wln4828@163.com
*通信作者:徐明芳(1962—),女,教授,博士,研究方向为乳品科学与工程。E-mail:txmfxmf2006@126.com
