真空结合加热、冷冻浓缩羊奶理化品质分析
2022-08-18朱丽李林强鱼喆喆刘永峰
朱丽,李林强,鱼喆喆,刘永峰
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710062)
羊奶的营养价值丰富且具有较好的保健功能[1]。与牛奶相比,羊奶的蛋白质含量较多且球蛋白颗粒较小,易被机体消化吸收,因此以羊奶为原料的产品受到了人们的广泛关注[2]。羊奶粉是羊奶主要的加工产品,而浓缩是生产羊奶粉的关键环节[3]。
浓缩的常见方法有加热浓缩(heating concentration,HC)、真空加热浓缩(vacuum heating concentration,VHC)和真空冷冻浓缩(vacuum freezing concentration,VFC)等。HC是一种在常压和加热条件下除去食品中水分的方法,这种方法浓缩效率低且容器壁会有聚集体或沉淀物的形成,产品感官品质较差[4]。VHC是在减压条件下,通过加热将食品中水分除去的方法,能在较短时间内完成浓缩,同时能提供较高浓缩程度的浓缩羊奶,但真空加热会影响羊奶中的营养组成而且与HC相比,VHC对食品品质的影响较小,并且浓缩效率更好[5]。VFC是一种将食品中的水分冻结,并辅以真空条件除去食品中冻结水的方法[6]。VFC与HC相比具有能较好保存食品中的风味、色泽和营养价值等优点,但VFC需要的时间较长[7]。根据QB/T 5395 2019《中华人民共和国轻工行业标准 浓缩乳》现行全脂浓缩奶的乳固体含量>25%,因此本试验确定浓缩奶的总固形物含量(total solids,TS)分别为25%和35%。目前HC和冷冻浓缩对产品品质影响的研究较多,但有关加热、冷冻结合真空浓缩方法对羊奶品质影响的相关报道并不多见。
本研究采用加热、真空加热和真空冷冻3种浓缩方法,将鲜羊奶分别浓缩至25%和35% TS,探究其对羊奶营养成分、理化品质的影响,为得到较高质量的浓缩羊奶提供理论依据及技术路线。
1 材料与方法
1.1 材料
鲜羊奶购于陕西省西安市长安区奶山羊养殖大户,用冰盒运回,鲜羊奶分为7组,25%TS浓缩羊奶分3组,35%TS浓缩羊奶分3组,鲜羊奶作为对照,相同浓缩程度的3种浓缩羊奶分别用HC、VHC和VFC方法进行浓缩;尼罗红,美国阿拉丁公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC),美国Sigma公司;NaH2PO4、Na2HPO4,天津市科密欧化学试剂有限公司。
1.2 主要仪器
FV 1200激光共聚焦显微镜,奥林巴斯公司;Chirascan圆二色谱仪,英国应用物理公司;FD-1A-50真空冷冻干燥机,北京博美康试验仪器有限公司;BI-90 Plus激光粒度仪,美国布鲁克海文仪器公司;NS800色差仪,深圳三恩驰科技有限公司;UV-1200紫外可见分光光度计,上海美析仪器有限公司;RE-52旋蒸仪,上海亚荣生化仪器厂;PHS-3C型雷磁精密pH酸度计,上海精密科学仪器有限公司;TGL-16gR离心机,上海安亭科学仪器厂。
1.3 浓缩羊奶的制备方法
HC在80 ℃水浴条件下进行;VHC在真空度0.1 MPa,75 ℃条件下使用旋蒸仪进行浓缩;VFC羊奶经过-80 ℃冷冻过夜后,在真空冷冻干燥机中进行;采用烘干法对所得浓缩羊奶进行TS测定,得到(25±5)%和(35±5)% TS的浓缩羊奶。
1.4 浓缩羊奶理化指标测定
1.4.1 浓缩羊奶pH值测定
参考ZHAO等[8]的方法,在室温条件下进行。
1.4.2 浓缩羊奶浊度的测定
参考ZHAO等[9]的方法,并稍作改进。从不同浓缩组中取样0.5 mL分别置于100 mL容量瓶中,并用蒸馏水稀释定容,混合均匀后,在室温条件下使用紫外分光光度计对浓缩羊奶进行测定,测定波长为633 nm。
1.4.3 浓缩羊奶色值的测定
参考TRIBST等[10]的方法,按照说明使用标准黑白板对仪器进行校准,校准结束后对浓缩羊奶进行测定。将样品放置在光学测量口处进行测量,记录L*、a*、b*值,并以鲜羊奶作为初始参数(L0、a0、b0),色差ΔE计算如公式(1)所示:
(1)
1.4.4 浓缩羊奶粒度的测定
参考MARKOSKA等[11]的方法。从不同浓缩羊奶中取样0.5 mL,用蒸馏水稀释200倍,混合均匀后使用激光粒度仪测定羊奶的粒度。
1.4.5 浓缩羊奶酪蛋白二级结构的测定
参考孙静丽[12]的方法,并稍作改进。浓缩羊奶离心得到脱脂样品;等电点沉降酪蛋白并烘干沉淀;用磷酸盐缓冲盐溶液(pH 8.0)配制0.1 mg/mL蛋白溶液,然后用0.45 μm过滤器过滤,在波长190~260 nm处使用圆二色谱仪进行测定。
1.4.6 激光共聚焦显微镜观察浓缩羊奶微观结构
参考YU等[13]的方法。各处理组的浓缩羊奶取1 mL分别置于1.5 mL的离心管中,分别加入20 μL 1 mg/mL的尼罗红乙醇溶液和20 μL 1 mg/mL的FITC乙醇溶液混合染色30 min。最后,通过激光共聚焦显微镜观察浓缩羊奶脂肪球结构。尼罗红和FITC的激发波长分别为534和488 nm。
1.5 数据处理
所有测定均重复3次。使用SPSS 20软件对所得数据进行单因素方差分析,结果用平均值±标准差表示。
2 结果与分析
2.1 不同浓缩方法对羊奶pH值的影响
如图1所示,3种浓缩羊奶的pH值比鲜羊奶低2.90%~4.26%(P<0.05);在25%TS水平,VFC、VHC羊奶的pH值比HC羊奶高1.43%,VFC羊奶和VHC羊奶的pH值无差异;在35%TS水平,HC羊奶比VHC、VFC羊奶的pH值均高0.95%,VHC、VFC羊奶的pH值无差异。
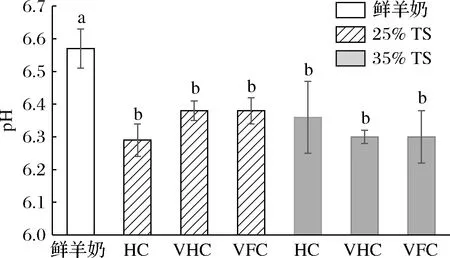
图1 不同浓缩方法对羊奶pH值的影响Fig.1 Effects of different concentrated methods on pH value of goat milk注:不同字母表示各处理组之间具有显著性差异(P<0.05)(下同)
2.2 不同浓缩方法对羊奶浊度的影响
如图2所示,3种方法制备的浓缩羊奶的浊度比鲜羊奶高13.34%~62.92%(P<0.05);在25%TS水平,VHC羊奶浊度比HC、VFC羊奶高10.10%和4.71%(P<0.05);在35%TS水平,VHC羊奶的浊度比HC、VFC羊奶高25.41%和22.20%(P<0.05);VFC方法制备的35%TS浓缩羊奶的浊度显著大于25%TS浓缩羊奶(P<0.05)。可见,VHC方法对羊奶的浊度影响最大,其次为VFC、HC方法。
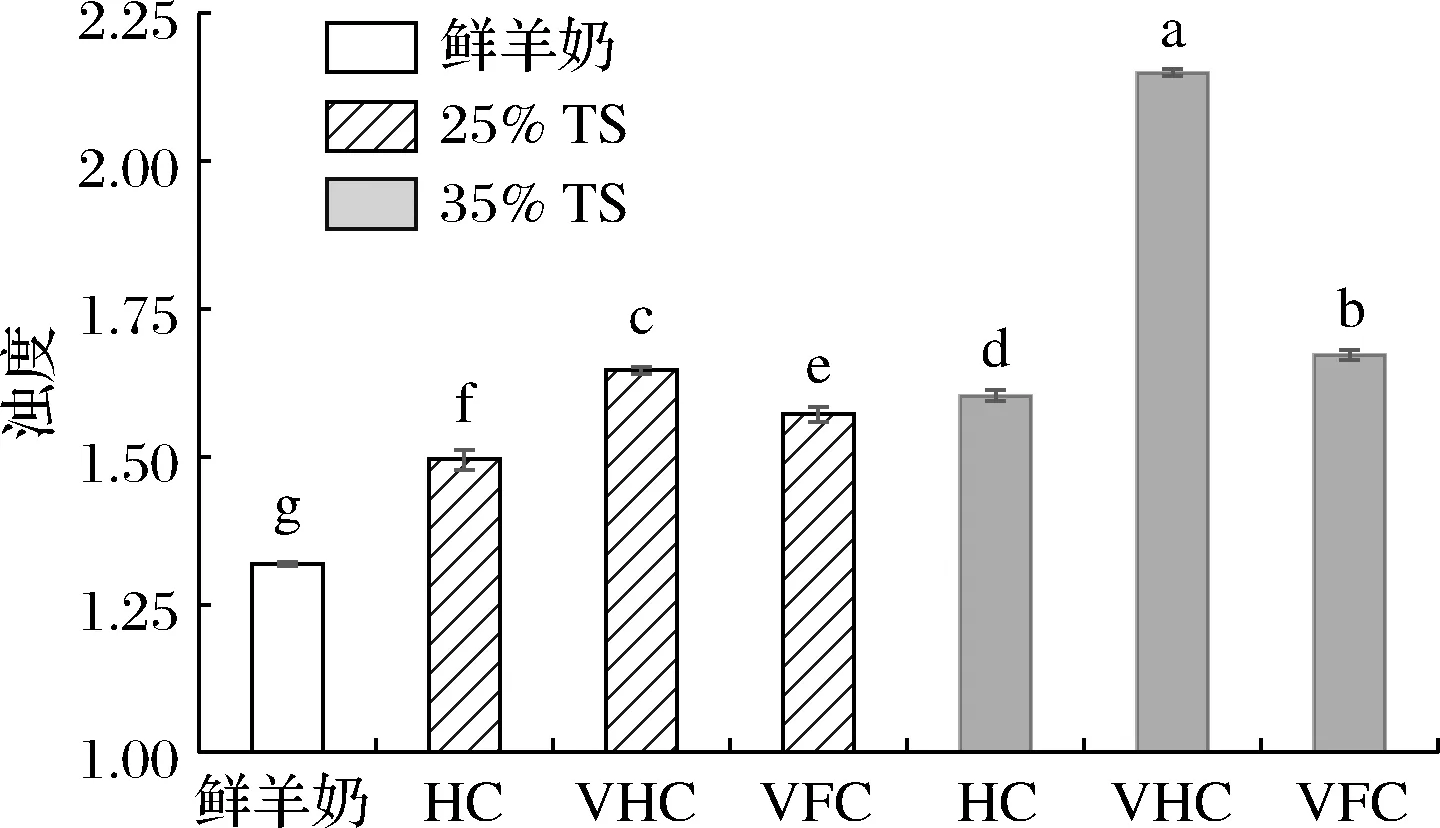
图2 不同浓缩方法对羊奶浊度的影响Fig.2 Effects of different concentrated methods on turbidity of goat milk
2.3 不同浓缩方法对羊奶的色值影响
如表1所示,HC、VHC方法中,25%TS、35%TS羊奶的L*值、b*值较鲜羊奶显著变化(P<0.05);VFC方法制备2种浓缩程度羊奶的a*值较鲜羊奶无显著差异(P>0.05),b*值显著高于鲜羊奶(P<0.05),25%TS羊奶的L*值较鲜羊奶无显著差异(P>0.05),35%TS羊奶的L*值较鲜羊奶显著降低(P<0.05);25%TS水平,VFC羊奶的L*值显著低于HC、VHC羊奶(P<0.05),a*值比HC、VHC羊奶高58.11%和64.19%(P<0.05),b*值比VHC羊奶小10.97%(P<0.05),但与HC羊奶无显著差异(P>0.05),色差比VHC羊奶小43.41%(P<0.05);HC羊奶的L*值显著大于VHC羊奶(P<0.05),b*值比VHC羊奶低18.42%(P<0.05),a*值与VHC羊奶无显著差异(P>0.05);35%水平,VFC羊奶的L*值显著低于HC羊奶(P<0.05),但与VHC无显著差异(P>0.05),a*值比HC、VHC羊奶高49.40%和52.41%(P<0.05),b*值比VHC羊奶低7.56%(P<0.05),但与HC羊奶无显著差异(P>0.05),色差比VHC羊奶低16.41%(P<0.05),比HC羊奶高30.61%(P<0.05)。因此,使用真空冷冻方法制备的25%TS羊奶对色差的影响最小。
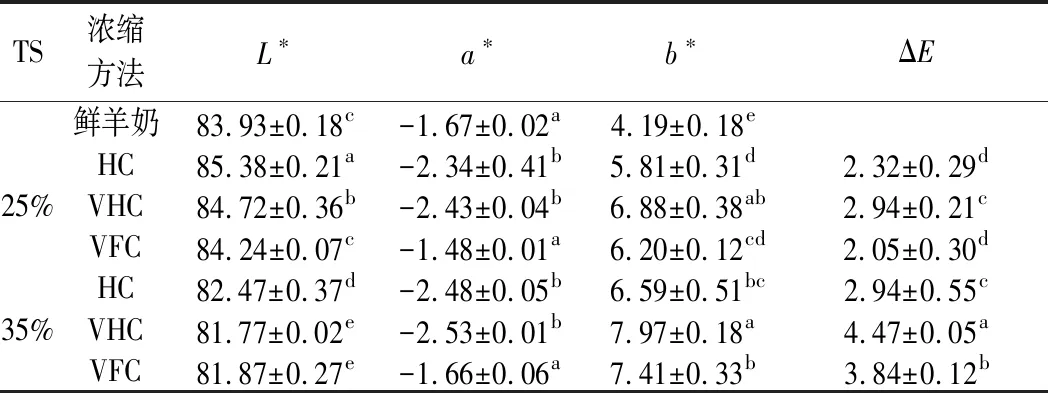
表1 不同浓缩方法对羊奶色值的影响Table 1 Effects of concentrated methods on color value of goat milk
2.4 不同浓缩方法对羊奶粒度的影响
如图3所示,2种浓缩程度VHC羊奶的粒度较鲜羊奶无显著差异(P>0.05);HC方法中25% TS羊奶粒度与鲜羊奶无显著差异(P>0.05),35% TS羊奶的粒度较鲜羊奶显著增大(P<0.05);VFC方法中,25% TS比鲜羊奶低17.5%(P<0.05),35% TS羊奶与鲜羊奶无显著差异(P>0.05)。25% TS水平,VFC羊奶的粒度比HC、VHC羊奶小35.07%和23.10%(P<0.05);HC羊奶的粒度与VHC羊奶无显著差异(P>0.05)。35% TS水平,VFC羊奶的粒度比HC羊奶小34.34%(P<0.05),与VHC羊奶无显著差异(P>0.05);HC羊奶的粒度比VHC羊奶大25.52%(P<0.05)。因此,对羊奶粒度影响最小的是VFC方法。

图3 不同浓缩方法对羊奶粒度的影响Fig.3 Effects of concentrated methods on particle size of goat milk
2.5 不同浓缩方法对羊奶酪蛋白二级结构的影响
如表2所示,羊奶中酪蛋白二级结构主要以α-螺旋和无规则卷曲结构为主。HC、VHC方法中,25%TS浓缩羊奶的α-螺旋结构比鲜羊奶高39.50%和61.88%(P<0.05),其他结构均显著降低(P<0.05);HC方法中,35%TS浓缩羊奶的α-螺旋结构比鲜羊奶低25.26%(P<0.05),其他结构均显著增大(P<0.05);VHC方法中,35%TS浓缩羊奶的酪蛋白二级结构较鲜羊奶均无显著差异(P>0.05);VFC方法中,25%TS浓缩羊奶α-螺旋结构显著低于鲜羊奶(P<0.05),无规则卷曲结构显著低于鲜羊奶(P<0.05),35%TS浓缩羊奶α-螺旋结构显著高于鲜羊奶(P<0.05),其他结构显著低于鲜羊奶(P<0.05)。25%TS水平,VFC羊奶α-螺旋结构比HC、VHC羊奶低65.03%和91.50%(P<0.05),其他结构均显著增大(P<0.05);VHC羊奶α-螺旋结构显著高于HC羊奶(P<0.05),平行、β-转角和无规则卷曲结构显著低于HC羊奶(P<0.05)。35%TS水平,VFC羊奶α-螺旋结构分别比HC、VHC羊奶高117.30%、69.73%,其他结构均显著降低(P<0.05);VHC羊奶的α-螺旋结构比HC羊奶高28.03%(P<0.05),其他结构较HC羊奶均显著减少(P<0.05)。因此,25%浓缩程度中VFC方法和35%TS浓缩程度的VHC方法对羊奶的影响较小。
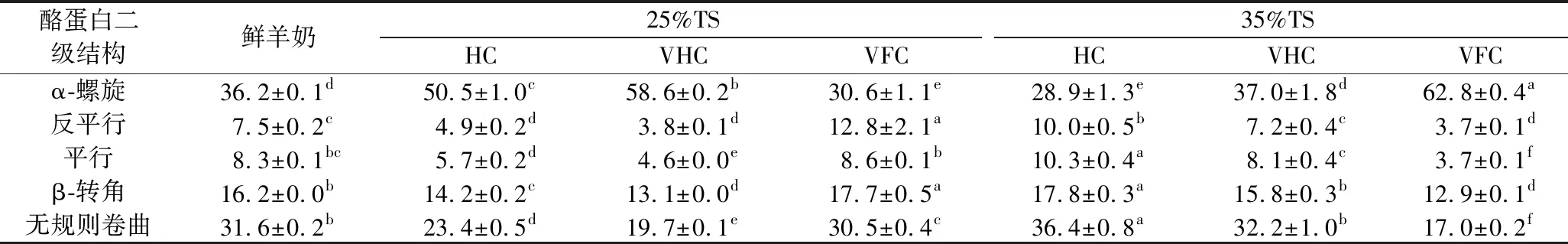
表2 不同浓缩方法对羊奶酪蛋白二级结构的影响 单位:%
2.6 不同浓缩方法对羊奶脂肪球大小的影响
如图4所示,在镜像下可以观察到红色的乳脂肪球以微小颗粒分布在整个羊奶体系中。鲜羊奶(图4-a)的脂肪球大小和分布比较均匀,为2~4 μm。HC和VHC羊奶脂肪球直径比鲜羊奶大,而且TS为25%~35%HC羊奶脂肪球直径增大趋势比VHC羊奶大;VFC羊奶的脂肪球直径与鲜羊奶无差异。25%TS水平,HC(图4-b)和VHC羊奶脂肪球(图4-c)变大,且脂肪球间的距离变小;VFC羊奶脂肪球(图4-d)在体系中分散较均匀,为2~4 μm。35%TS水平,HC羊奶脂肪球(图4-e)的距离减小,分布不均匀,且大于VFC羊奶(图4-g)的脂肪球,直径≥5 μm;真空加热使浓缩羊奶脂肪球(图4-f)的密集程度增加且大于VFC羊奶脂肪球(图4-g)。因此,不同浓缩方法对羊奶脂肪球直径的影响最大的是HC方法,其次是VHC、VFC方法。

a-鲜羊奶;b-25%TS水平的HC羊奶;c-25%TS水平的VHC羊奶;d-25%TS水平的VFC羊奶;e-35%TS水平的HC羊奶;f-35%TS水平的VHC羊奶;g-35%TS水平的VFC羊奶图4 不同浓缩方法对羊奶脂肪球结构的影响Fig.4 Effects of concentrated methods on structure of fat globule of goat milk注:图中绿色表示浓缩羊奶中的蛋白质,红色表示浓缩羊奶中的脂肪球
3 讨论
鲜羊奶在浓缩过程中乳糖发生了降解,产生的有机酸或可溶性磷酸钙经过一系列反应转化成胶体磷酸钙并且羊奶酪蛋白脱磷酸作用也会加强,一些酸性物质如磷酸盐、碳酸盐等浓度增加,导致浓缩羊奶pH值降低[14]。此外,电离状态活性氢离子的含量影响pH值,浓缩过程中,羊奶的电离平衡被打破,增加了活性氢离子的含量,使浓缩羊奶的pH降低[15]。浓缩羊奶的pH值降低,酪蛋白和乳清蛋白之间发生了相互作用,胶束表面形成酪蛋白-乳清蛋白的聚集体,导致浓缩羊奶浊度增加[16],这与本试验所得结果一致。
羊奶浓缩过程中体系的蛋白质发生一系列变化,热处理对羊奶的粒度有增大的作用,这可能是由于羊奶中的蛋白质主要以酪蛋白为主,热处理过程中酪蛋白胶束会发生聚集作用,浓缩程度增加,酪蛋白胶束的聚集程度变大;此外,乳清蛋白通过二硫键结合形成聚合物,β-乳球蛋白和κ-酪蛋白在硫醇-二硫键交换作用下生成酪蛋白-乳清蛋白的聚集体,酪蛋白本身发生的聚集和酪蛋白-乳清蛋白聚集反应高于酪蛋白自身的解聚程度时,羊奶粒度增大[16]。VFC方法中,35%TS浓缩羊奶的粒度显著大于25%TS浓缩羊奶(P<0.05),这可能是因为蛋白胶束与脂肪颗粒的相互吸附作用能使部分脂肪颗粒聚集或部分蛋白胶束发生凝集,VFC时羊奶中的水结晶析出会增加脂肪和酪蛋白的密集程度,进一步促进了酪蛋白胶束和脂肪的凝聚,因此增加了浓缩羊奶的粒度[10,15]。
色值的变化影响羊奶感官品质,不同浓缩方法对浓缩羊奶的L*值产生了较大的影响,35%TS浓缩羊奶L*值均显著降低(P<0.05),可能是鲜羊奶使用不同浓缩方法浓缩到35%TS过程中,羊奶凝胶体系变得松散,减弱了反射光和散射光作用,影响了羊奶的透过性[17]。此外,L*值的变化还与浓缩羊奶中的一些有效成分有关,例如核黄素和类胡萝卜素等[18]。浓缩羊奶的b*值较鲜羊奶增加,可能是乳脂肪含量的存在对羊奶b*值的变化有着重要影响,浓缩过程使羊奶脂肪含量增大,脂肪中存在的类胡萝卜素使浓缩羊奶中的b*值发生了明显的变化[19]。浓缩过程中脂肪含量的增加对a*值的影响较大[20]。加热和VHC使羊奶中乳糖与酪氨酸发生羰基反应,5-羟甲基糠醛作为该反应的中间产物之一,对乳制品的色泽产生了重要的影响,使羊奶色泽变黄[21]。
α-螺旋结构在酪蛋白二级结构中是最稳定的,加热使酪蛋白α-螺旋结构中的氢键断裂,使得螺旋结构解旋进而发生变化[22]。YE等[23]研究表明α-螺旋结构在70~85 ℃内表现为先增加后减少,β-转角减少可能是由于向α-螺旋结构转变的原因,同时也会向无规则卷曲方向转变。因此,HC和VHC羊奶酪蛋白的α-螺旋结构的比例先增加后减少,β-转角结构、平行结构、反平行结构、无规则卷曲结构的比例先减少后增加。在冷冻浓缩的过程中,羊奶中冻结的冰晶破坏了酪蛋白α-螺旋结构中的氢键,引起蛋白分子的交联作用,使蛋白质的二级结构发生了变化[24]。真空冷冻浓缩使反平行结构增加,可能是因为α-螺旋结构受到外部作用力的影响后发生了解旋,并且解旋后的二级结构向反平行结构改变。随着浓缩时间的延长,α-螺旋结构增加可能是其它结构发生交联作用引起的。
有研究表明乳脂肪球的大小和分布发生变化可能是由于乳中的脂肪发生了一定程度的变化[21]。加热和真空加热方法对羊奶进行浓缩时,羊奶中脂肪含量增加,整个体系中的乳脂密度增大,体系中的布朗运动使得乳脂之间的相互撞击几率增大,乳脂肪球聚集的几率变大[25]。此外,热处理可能也会加快布朗运动过程中颗粒的撞击几率,使脂肪球直径增大。因此羊奶乳脂肪球的微观结构观察表明常压HC羊奶的乳脂肪球直径显著增大。
4 结论
VHC羊奶的蛋白质、脂肪和乳糖等营养成分均高于其他2种浓缩方法,且VHC对羊奶的浊度和色差影响较大;HC对羊奶的粒度和脂肪球影响较大;VFC对羊奶的色差、粒度和脂肪球微观结构影响较小,因此VFC羊奶品质较好。25%TS VFC较35%TS VFC对羊奶的粒度、色差、酪蛋白二级结构影响较小。综合比较,TS为25%的VFC羊奶较其他浓缩羊奶品质最好。
