快速分析彝药桃树寄生抗氧化成分
2012-04-01朴香兰邓长芹陈虎彪
朴香兰,邓长芹,陈虎彪,王 进
(1. 中央民族大学中国少数民族传统医学研究院,北京 100081;2. 香港浸会大学中医药学院,香港)
快速分析彝药桃树寄生抗氧化成分
朴香兰1,邓长芹1,陈虎彪2,王 进1
(1. 中央民族大学中国少数民族传统医学研究院,北京 100081;2. 香港浸会大学中医药学院,香港)
目的:快速分离、鉴定彝药桃树寄生的抗氧化成分。方法:通过1,1-二苯基-2-三硝基苯肼(DPPH) 自由基清除实验,评价彝药桃树寄生的甲醇提取物及其二氯甲烷、正丁醇及水萃取物的抗氧化作用,利用生物活性-高效液相跟踪方法,快速分离、鉴定其有效成分。结果:从彝药桃树寄生的二氯甲烷萃取物中分离、鉴定出有效成分为松脂酚(pinoresinol)。结论:利用生物活性-高效液相跟踪方法可以快速分离、鉴定彝药桃树寄生中的抗氧化成分,可应用于其他天然植物活性成分的快速筛选。
彝药桃树寄生;DPPH自由基清除作用;生物活性-高效液相跟踪方法;松脂酚
随着基础医学和生命科学的不断发展,人们对自由基的研究越来越多,其中就有大量关于自由基与疾病的研究。自由基作为机体的正常代谢产物,在平衡状态下,其在抗菌、消炎和抑制肿瘤等方面具有重要作用和意义;一旦平衡被打破,如机体受到疾病或某些外源性药物和毒物的侵害,自由基便会产生强大的伤害作用,造成生物膜的脂质过氧化损伤,引起酶、氨基酸、蛋白质的氧化破坏,对内脏器官、免疫系统的形态功能产生影响,从而引起机体疾病,甚至死亡[1]。
近年来,天然植物倍受推崇,如何首乌、黄芪、人参、红景天等,我国少数民族地区的天然植物的应用亦表现出良好的应用前景[2-5]。通过前期对部分少数民族常用植物的筛选,发现彝药桃树寄生具有较强的抗氧化活性。
彝药桃树寄生为桑寄生科(Loranthaceae)钝果寄生属(Taχillus)的柳叶钝果寄生(Taχillus delavayi (Van Tiegh.) Danser)的寄生全株,又名柳树寄生,主产于云南、四川、贵州、广西、广东、湖南、江西、福建、台湾,为蔷薇科植物桃树上寄生的寄生全株。性温、味涩,具有温经活血、调经暖宫之功效。彝医药书《聂苏诺期》就有收载桃树寄生[6],彝医用于治疗不孕症、妇科附件炎等。而桑寄生科在《神农本草经》列为上品,有补肝肾、强筋骨、祛风湿、安胎元功能。《中国药典》2005年版收载的桑寄生为桑寄生科植物桑寄生(Taχillus chinensis (DC.)Danser)的干燥带叶茎枝,用于风湿痹痛、腰膝酸软、筋骨无力、崩漏经多、妊娠漏血、胎动不安、高血压等[7]。彝药桃树寄生与中药桑寄生是同一科同一属而不同种植物,它们的功能主治也有所不同。桑寄生的物质基础及其生物活性研究有些报道[8-11],然而,彝药桃树寄生的有效成分的研究报道较少,因此本研究选择彝药桃树寄生进行抗氧化有效成分的分析。
然而,天然产物中成分多而复杂,用传统的分离方法,不但需要很多时间,而且浪费不必要的溶剂及劳动力。本研究采用生物活性-高效液相色谱跟踪(bioassay-linked HPLC)方法,快速分离、鉴定桃树寄生中的抗氧化成分,以期为天然植物的开发研究提供参考。
1 材料与方法
1.1 材料与试剂
彝药桃树寄生采集于云南省昆明市禄劝县乌蒙乡,经香港浸会大学陈虎彪教授鉴定为桑寄生科钝果寄生属的柳叶钝果寄生。
1,1-二苯基-2-三硝基苯肼(DPPH) 日本Wako Pure Chemical Industries公司;硅胶 青岛海洋化工厂分厂;所有化学试剂均为分析纯 北京化工厂。
1.2 仪器与设备
DPBRUKER DPX 300核磁共振仪 瑞士Bruker公司;Agilent 1100 Series LC/MSD Trap (VL) 液相色谱-质谱联用仪 美国Agilent公司;Waters 600色谱仪高效液相色谱仪(配Waters2996检测器) 美国Waters公司;YMC柱(RP-18,250mm × 4.6mm,5μm) 日本YMC公司; Benchmark Plus 酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 彝药桃树寄生有效成分的提取、分离
彝药桃树寄生5.0kg,用10、8、8倍量的80% 甲醇加热回流提取3次,每次3h,合并3次提取液,减压浓缩,真空干燥,得甲醇提取干膏(301.8g)。甲醇提取物用水混悬,依次用二氯甲烷(3次)、正丁醇(3次)萃取。分别得到二氯甲烷(TDD)、正丁醇(TDB)和水萃取物(TDW)11.3、224.6、48.0g,并对各部位进行DPPH自由基清除实验。
1.3.2 DPPH自由基清除实验
参照参考文献[12]稍加修改。用乙醇溶解的不同质量浓度的样品100μL与60μmol/L DPPH溶液100μL,加入96孔板中,混匀后,室温避光放置30min,然后在波长517nm处测OD值,测定DPPH自由基清除率,与不加样品的对照组进行DPPH自由基清除效果的比较,然后用半数有效值IC50(抑制50%的DPPH自由基生成所需样品的质量浓度)表示抗氧化活性。DPPH自由基清除率的计算公式如式(1)。

式中:OD空为加DPPH的空白溶液孵育后的OD值;OD空0为空白溶液孵育前的OD值;OD样为加DPPH的样品溶液孵育后的OD值;OD样0为样品溶液孵育前的O D值。
1.3.3 TDD部位有效成分的分离
桃树寄生的二氯甲烷萃取物(TDD)上样于硅胶柱,用乙酸乙酯、石油醚作为洗脱液,以1:100、1:50、1:30、1:15、1:10、1:1和100%乙酸乙酯顺序洗脱。对流出液进行硅胶板点样与展开,根据Rf值将TDD分成10个组分(TDD1~TDD10),并对各组分进行DPPH自由基清除实验,比较它们的抗氧化活性。
对抗氧化活性较强的TDD8进行生物活性-高效液相跟踪,鉴定有效成分。TDD8用甲醇配成2mg/mL的溶液,进样20μL于高效液相分析柱(YMC柱)。高效液相使用水和甲醇作为溶剂系统,以甲醇50%(0min)~甲醇100%(30min)洗脱,流速为1mL/min,流出液以300μL/孔的速度接样于96孔板,并放在通风厨中挥发溶剂。溶剂挥发后的96孔板用于DPPH自由基清除实验,在9.8min处出现的峰显示较高的DPPH自由基清除活性,并用半制备分析柱(YMC柱)进行分离、纯化有效成分TDD8-2。
1.3.4 统计学分析方法
2 结果与分析
2.1 桃树寄生DPPH自由基清除活性
对桃树寄生的甲醇提取物及其TDD、TDB和TDW进行DPPH自由基清除实验,结果表明各部位样品均显示浓度依赖性的抗氧化活性,TDD对DPPH的半数抑制率IC50达到(74.50 ± 1.24 )μg/mL,尤其是TDB抗氧化效果最强,其IC50值为(22.21 ± 2.05)μg/mL(图1)。

图1 桃树寄生的DPPH自由基清除活性Fig.1 DPPH radical scavenging activity of the methanol extract and its different solvent fractions
2.2 TDD部位有效成分的分离、鉴定
为了系统地进行桃树寄生的抗氧化有效成分的研究,首先从非极性的TDD着手进行抗氧化有效成分的分析,然后陆续对桃树寄生的正丁醇及水萃取物进行有效成分的分离、鉴定。桃树寄生的TDD经硅胶柱分离,得到10个组分(TDD1~TDD10),通过DPPH自由基清除实验对上面的10个组分及TDD总样进行分析,结果表明,除TDD1和TDD2以外,其他组分均有质量浓度依赖性清除DPPH自由基清除活性,尤其是TDD8和TDD10显示较强的抗氧化活性,而且TDD8组分的量相对较多,在质量浓度50μg/mL时就对DPPH自由基清除率超过60% (图2)。

图3 桃树寄生二氯甲烷萃取物活性组分的高效液相色谱(A)-抗氧化活性(B)图Fig.3 HPLC separation peaks and antioxidant activity peaks of TDD8
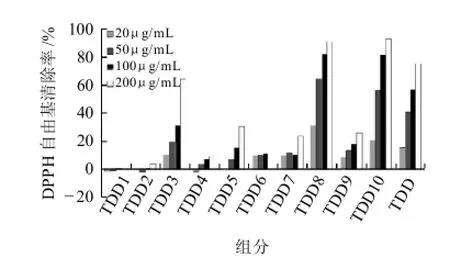
图2 桃树寄生的二氯甲烷萃取物各组分DPPH自由基清除活性Fig.2 DPPH radical scavenging activity of different components of the dichloromethane-soluble fraction

图4 化合物TDD8-2的氢谱Fig.4 1H-NMR spectrum of compound TDD8-2

图5 化合物TDD8-2的碳谱Fig.5 13C-NMR spectrum of compound TDD8-2
为了分离、鉴定活性较强的TDD8中的有效成分,利用生物活性-高效液相跟踪方法,快速确定TDD8中的有效峰。实验结果表明,以甲醇50%(0min)~甲醇100%(30min)洗脱,流速为1mL/min的条件下,在9.8min处出现的峰显示较高的DPPH自由基清除活性。因此,采用半制备分析柱,使用甲醇和水的溶剂系统,选择甲醇50%等度洗脱,有选择地针对有效成分的峰进行分离、纯化,得到有效成分TDD8-2单体化合物(图3)。
化合物TDD8-2为白色油状物,分子式C20H22O6。有效成分TDD8-2在ESI-MS显示准分子离子峰m/z 381 [M+Na]+,357 [M-H]+,1H-NMR (300MHz, CD3OD)δ:6.92 (2H, d, J=1.25, H-2,2'), 6.78 (2H, bdd, J=8.2,1.6Hz, H-6,6'), 6.75 (2H,bdd, J=8.2,1.7Hz, H-5,5'), 4.67 (2H, b, J=4.5Hz, H-7,7'), 4.19 (2H, m, Hb-9), 3.82 (3H, s, OCH3), 3.79 (2H, m, Ha-9), 3.09 (2H, m, H-8,8')(图4)。13C-NMR (75MHz, CD3OD) δ:149.1(C-3,3'), 147.3 (C-4,4'), 133.8 (C-1,1'), 120.0 (C-6,6'), 116.1 (C-5,5'), 111.0 (C-2,2'), 87.4 (C-7,7'), 72.6 (C-9,9'), 56.4 (OCH3), 55.3 (C-8,8')(图5)。结合文献[13]确定抗氧化成分TDD8-2为松脂酚(pinoresinol)(图6)。

图6 桃树寄生抗氧化成分的结构式Fig.6 Chemical structure of compound TDD8-2
2.3 桃树寄生有效成分的抗氧化活性
利用DPPH自由基清除活性检测方法,以VC作为阳性对照,比较桃树寄生中分离的有效成分松脂酚对DPPH自由基清除作用,结果表明它们均有质量浓度依赖性清除DPPH自由基作用,松脂酚对DPPH自由基的IC50为(30.95 ± 1.75)μmol/L,接近VC的IC50值(23.24 ± 1.09)μmol/L。
3 结 论
桃树寄生的甲醇提取物及其二氯甲烷、正丁醇和水萃取物都具有较强的抗氧化活性。针对量较多的桃树寄生的二氯甲烷萃取物进行组分分离,并对活性较强的组分进行生物活性-高效液相跟踪,快速分离、鉴定桃树寄生的有效成分,通过ESI-MS、1H-NMR、13C-NMR光谱数据,与相关文献对照,抗氧化有效成分被鉴定为松脂酚。与阳性对照组VC比较,松脂酚显示较强的DPPH自由基清除活性,其IC50为(30.95 ± 1.75) μmol/L,接近VC的IC50(23.24 ± 1.09)μmol/L。利用生物活性-高效液相跟踪方法,可以快速分离、鉴定天然植物中的抗氧化成分,可应用于食品中抗氧化有效成分的快速分析。
[1]李勇, 孔令清, 高洪, 等. 自由基与疾病研究进展[J]. 动物医学进展杂志, 2008, 29(4): 85-88.
[2]孙明杰, 于友华. 清热解毒中药防治老年性痴呆症之理论探讨[J]. 中国中医基础医学杂志, 2003, 9(2): 17-24.
[3]颜承云, 谷继伟, 宗希明, 等. 我国民族药资源概述[J]. 黑龙江医药科学, 2003, 26(6): 46-47.
[4]崔箭, 唐丽. 中国少数民族传统医学概论[M]. 北京: 中央民族大学出版社, 2007: 15-23.
[5]诸国本. 中国民族医药散论[M]. 北京: 中国医药科技出版社, 2006: 70-78.
[6]聂鲁, 赵永康, 马光发, 等. 聂苏诺期[M]. 昆明: 云南民族出版社, 1981.
[7]国家药典委员会. 中国药典: 一部[M]. 北京: 化学工业出版社, 2005: 210-211.
[8]李永华, 卢栋, 朱开昕, 等. 桑寄生及其夹竹桃科寄主植物强心苷含量相关性研究[J]. 时珍国医国药, 2010, 21(6): 1397-1398.
[9]李永华, 陈士林, 卢栋, 等. 不同寄主植物桑寄生总黄酮含量研究[J].时珍国医国药, 2009, 20(12): 3009-3010.
[10]董政起, 朱静, 金光株. HPLC指纹图谱鉴别桑寄生和槲寄生[J]. 吉林中医药, 2007, 27(2): 56-57.
[11]李兵, 卢汝梅, 陈翰. 两种不同寄主桑寄生总黄酮的含量测定[J]. 亚太传统医药, 2010, 6(1): 37-38.
[12]HATANO T, EDAMATSU R, HIRAMATSU M, et al. Effects of the interaction of tannins with co-existing substances[J]. Chemical & Pharmaceutical Bulletin, 1990, 38(5): 1224-1229.
[13]XIE L H, AKAO T, HAMASAKI K, et al. Biotransformation of pinoresinol diglucoside to mammalian lignans by human intestinal microflora, and isolation of enterococcus faecalis strain pdg-1 responsible for the transformation of (1)-pinoresinol to (1)-lariciresinol[J]. Chem Pharm Bull, 2003, 51(5): 508-515.
Rapid Analysis of Antioxidant Constituents from Taχillus delavayi, a Yi Ethnomedicinal Material
PIAO Xiang-lan1, DENG Zhang-qin1,CHEN Hu-biao2,WANG Jin1
(1. Institute of Chinese Minority Traditional Medicine, Minzu University of China, Beijing 100081, China;2. School of Chinese Medicine, Hong Kong Baptist University, Hongkong, China)
Objectives: To rapidly separate and identify antioxidant constituents from the whole plant of Taχillus delavayi, a Yi ethnomedicinal material, and assess their antioxidant activity. Methods: The antioxidant activity of the methanol extract of the medicinal material and its different solvent fractions obtained by repeated extractions sequentially with dichloromethane, n-butanol and water was assessed by DPPH free radical scavenging assay. The dichloromethane-soluble fraction was further separated by silica gel column chromatography, and a high antioxidant component named as TDD8 was obtained and analyzed by bioassay-linked HPLC and1H-NMR. Results: An individual compound named as TDD8-2 was separated from TDD8 by semipreparative HPLC and identified by1H-NMR as pinoresinol. Conclusion: The bioassay-linked HPLC method allows the rapid separation and identification of antioxidant components from medicinal materials.
Taχillus delavayi;DPPH radical scavenging activity;bioassay-linked HPLC method;pinoresinol
R282.71
A
1002-6630(2012)01-0016-04
2011-02-14
国家自然科学基金项目(30973960;81011140347);国家民委科研项目(09ZY17);国家大学生创新性实验计划项目(NMOE)(200911003)
朴香兰(1965—),女,副教授,博士,研究方向为天然药物化学。E-mail:xlpiao@163.com
