海带中岩藻多糖的分离纯化与结构分析
2012-04-01张文清左萍萍张玉龙
张文清,左萍萍,徐 辰,杨 蕾,张玉龙,夏 玮
(华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237)
海带中岩藻多糖的分离纯化与结构分析
张文清,左萍萍,徐 辰,杨 蕾,张玉龙,夏 玮*
(华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237)
通过DEAE-纤维素和凝胶过滤色谱反复柱层析,采用苯酚-硫酸法和高效凝胶过滤色谱法(HPGFC)检测,从提取的海带岩藻多糖中得到了均一多糖TC-1,并结合多种分析手段:包括糖组成分析、甲基化分析、红外光谱(IR)分析等对其化学结构进行测定。结果表明:TC-1重均相对分子质量(Mw)为3.7×105,主要由岩藻糖构成,此外还伴有少量的木糖、甘露糖、葡萄糖和半乳糖组成的结构复杂的硫酸酯多糖。其中岩藻糖糖基以1,4-、1,3-连接方式存在;木糖以1,3-连接方式存在;甘露糖以1,3-、1,6-连接方式存在;葡萄糖以1,3,4-、1,2,4,6-连接方式存在;半乳糖以1,6-、1,3,6-、1,3,4,6-连接方式存在。
海带;岩藻多糖;分离纯化;结构分析
海带具有很高的食用、药用价值。研究表明,海带所含的岩藻多糖具有明显的生理活性,如抗肿瘤、促进造血功能等[1-2]。随着人们对岩藻多糖的深入研究,得知其并非单一结构的化合物,其组成十分复杂,称为含岩藻糖的硫酸多糖(fucose-containing sulfated polysaccharides)。由于岩藻多糖的含量和结构受多种因素影响[3],目前国内外的报道对其结构组成没有统一的定义,大多是对其进行初步纯化[4],得到岩藻多糖的混合物。国外部分学者对岩藻多糖的结构进行了研究[4-6],但海带的深度开发却涉及较少。本研究利用我国资源丰富的海带,综合各种分离手段,得到均一多糖组分,并鉴定了它的一级结构,旨在为今后岩藻多糖的开发利用提供技术资料和结构信息。
1 材料与方法
1.1 材料与试剂
海带产自山东威海。
DEAE-纤维素 美国Whatman公司;Sephacryl S-300、S-200凝胶层析介质 美国Pharmacia公司;标准葡聚糖 美国Fluka公司;透析袋(截留相对分子质量1000) 上海绿鸟科技公司;纤维素板 上海市药品检验所;单糖对照品 美国Sigma公司;无水二甲亚砜、无水硫酸钠、碘甲烷 国药集团化学试剂有限公司;三氯甲烷 上海化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
TL-5.0台式离心机 上海市离心机械研究所;BT-100恒流泵 上海市沪西分析仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;SBS-100数控计滴自动部分收集器 上海市青浦沪西仪器厂;玻璃层析柱 上海市亚荣生化仪器厂;R-201型旋转蒸发仪 上海申科机械研究所;FD1冷冻干燥机 北京博医康仪器有限公司;vario EL Ⅲ型元素分析仪 德国Sartorius Gmbh公司;Agilent1100高效液相色谱仪、Agilent 6890 5975气质联用仪(色谱柱为HP-5型毛细管柱) 美国安捷伦有限公司;Nicolet Magna-IR550红外光谱仪 美国Nicolet公司。
1.3 海带中岩藻多糖的提取[7-8]
取洁净干燥的海带50g,粉碎后用无水乙醇浸泡,脱脂后的固体残渣用水提取(料液比1:10(m/V),60℃提取2h),提取3次,合并提取液,离心,浓缩上清液至小体积,加入无水乙醇,至所含乙醇的体积分数为3 0%,过滤,上清液再加无水乙醇至其体积分数为60%,离心收集沉淀,真空干燥得岩藻多糖粗品。
将岩藻多糖配成5g/100mL的水溶液,用CaCl2对其进行初步纯化。溶液中加入4mol/L CaCl2,离心后取上清液,加乙醇至其体积分数为65%,用乙醇和丙酮浸洗沉淀,40℃干燥得到岩藻多糖。
1.4 岩藻多糖的分离纯化[9]
称取2g岩藻多糖溶于20mL去离子水,经DEAE-纤维素柱(1.5cm×50cm)初步分离。依次用去离子水和0.6、1.0、2.0mol/L NaCl溶液洗脱,洗脱流速为2mL/min,采用苯酚-硫酸法检测多糖含量,以洗脱体积为横坐标,吸光度为纵坐标,绘制洗脱曲线。将各部分洗脱液分别减压浓缩至适当体积,对蒸馏水透析,透析袋内液冷冻干燥得F-A、F-B、F-C、F-D。用Sephaeryl S-300凝胶层析柱(1.6cm×80cm)进一步分离F-C,同时用苯酚-硫酸法和高效凝胶过滤色谱法(HPGFC)进行检测,最终得到均一多糖组分TC-1。
1.5 多糖纯度及其相对分子质量分布测定
采用高效液相凝胶过滤色谱法(HPGFC)。样品及系列标准多糖(不同相对分子质量的葡聚糖:Mw分别为11600、66700、123600、196300、500000)分别流经Agilent1100高效液相色谱系统中TSKG 5000PWXL色谱柱,流动相为0.1mol/L NaNO3溶液,流速为0.5mL/min,示差折光检测器检测。由标准多糖的相对分子质量对数与保留时间做标准曲线,根据标准曲线及Agilent GPC软件计算样品相对分子质量及分布,样品纯度由峰型判断。
1.6 单糖组成分析[10]
取多糖样品2~3mg置于5mL安瓿瓶中,加2mol/L三氟乙酸(TFA)2mL,封管,120℃水解2h。旋蒸除尽溶液中的TFA,之后加入少量蒸馏水,取5μL进行薄层分析。用乙酸乙酯、吡啶、水、乙酸(体积比为5:5:3:1)的混合液展开剂展开后,苯胺-邻苯二甲酸显色,所得结果与标准单糖对照。水解产物另一部分,室温下加入NaBH4,反应2h(间隙振荡),生成糖醇乙酰酯衍生物,进行GC-MS分析。以标准单糖的糖醇全乙酰化衍生物(制备方法同多糖样品,但勿需TFA水解)作对照。分析条件:Agilent 6890 5975 GC-MS;色谱柱型号:HP-5色谱柱(30m×0.25mm,0.25μm);分流比20:1;进样量0.2μL;采取程序升温:初始温度/停顿时间为150℃/2min;程序升温终止温度/停顿时间为220℃/10min;升温速率5℃/min。
1.7 甲基化分析
根据Needs等[11]法对多糖样品进行甲基化,IR检测产物无羟基特征吸收峰,表明其甲基化完全。将完全甲基化的多糖样品溶于90%甲酸水溶液,密塞,100℃水浴解聚6h,除尽甲酸后,加入2mol/L TFA,120℃密封水解2h后除去过量TFA。固体残渣经NaBH4还原、乙酰化制得部分甲基化的阿尔迪醇乙酸酯衍生物,进行GC-MS分析。分析条件:Agilent 6890 5975 GC-MS;色谱柱型号:HP-5色谱柱(30m×0.25mm,0.25μm);分流比3:1;进样量1μL(氯仿为溶剂);采取程序升温:初始温度/停顿时间为120℃/2min;程序升温终止温度/停顿时间250℃/10min;升温速率5℃/min。
1.8 红外光谱(IR)分析及元素分析
取1~2mg样品,KBr研磨压片后进行IR分析,甲基化后的样品采用衰减全反射ATR附件测定IR吸收。采用IR吸收法、vario EL Ⅲ型元素分析仪检测样品是否含有硫酸根及硫酸根的含量。
2 结果与分析
2.1 TC-1的分离纯化
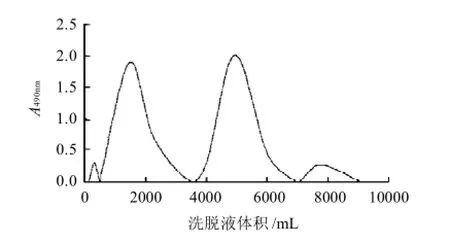
图1 岩藻多糖的DEAE-纤维素柱色谱分离Fig.1 Elution pattern of crude polysaccharides extracted from kelp on DEAE-cellulose column
如图1所示,各部分洗脱液分别减压浓缩至适当体积,用蒸馏水透析,透析袋内液冷冻干燥所得产物,分别命名为F-A、F-B、F-C、F-D,4个组分多糖总量分别为35、610、690、18mg。
多糖的纯度不能以通常小分子化合物的纯度标准来衡量,因为多糖是一种生物高分子化合物,其存在微观不均一性。多糖的纯度代表是某一多糖的相似链长的平均分布。目前通常采用高效液相凝胶过滤色谱法(HPGFC)对多糖进行纯度检测。一般来说,在凝胶柱填料的排阻极限内,HPGFC谱中呈现窄的单一对称峰的多糖组分可被认为是均一多糖。检测结果表明,F-A、F-B、F-C、F-D都不纯,均需要进一步分离纯化才能得到均一多糖。本实验仅对F-C部分作进一步分离纯化,色谱图见图2。
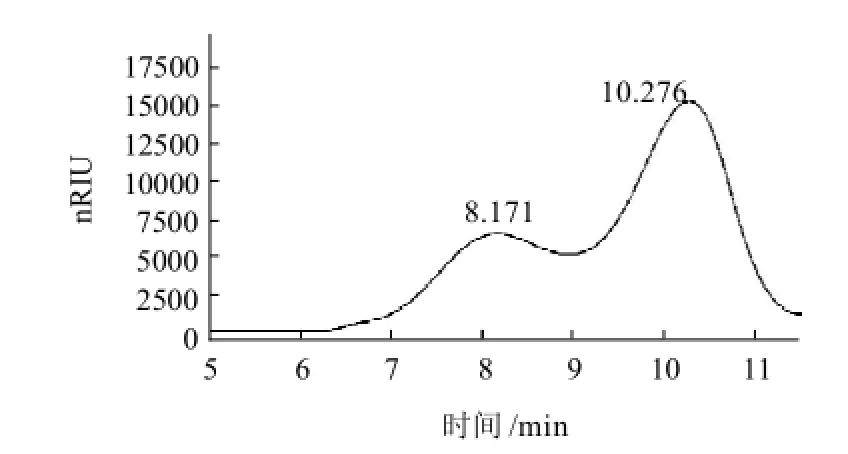
图2 F-C的凝胶过滤色谱图Fig.2 Gel filtration chromatogram of F-C
根据GPC软件计算可知F-C部分可能含有两种多糖组分,根据其相对分子质量分布,选择Sephacryl S-300作为凝胶层析介质(1.6cm×80cm)进行纯化。采用苯酚-硫酸法和HPGFC同时进行检测,得到均一多糖TC-1,其色谱图见图3。以已知相对分子质量的标准葡聚糖制作校正曲线,根据多糖样品的保留时间,由GPC软件计算出TC-1的重均相对分子质量Mw为3.7×105,数均相对分子质量Mn为3.0×105。

图3 TC-1的凝胶过滤色谱图Fig.3 Gel filtration chromatogram of TC-1
2.2 TC-1的红外光谱分析
由图4可知,3421cm-1处强吸收峰为O-H伸缩振动峰;2926cm-1为C-H的伸缩振动吸收峰;1645cm-1处为糖环的伸缩振动峰;1258cm-1附近处是由硫酸基S=O伸缩振动引起的,证明了TC-1是含有硫酸基取代的多糖;1084cm-1处为C-O的伸缩振动峰;848cm-1为C-O-S(直立键)的伸缩振动峰,硫酸基连接在糖环的C4位上;此外在1720cm-1附近未检测到吸收峰,说明不含有糖醛酸;在810cm-1及870cm-1处无吸收,说明可能不含甘露糖[12]。

图4 TC-1的红外光谱图Fig.4 IR spectrum of TC-1
2.3 TC-1单糖组成分析
TC-1以2mol/L TFA 120℃水解后的产物进行纤维素薄层层析(TLC),以标准单糖为对照,苯胺-邻苯二甲酸喷雾显色后显示有岩藻糖(棕色斑点)﹑木糖(红色斑点)、甘露糖(红色斑点)、半乳糖(棕色斑点)和葡萄糖(棕色斑点)的存在,另外,在Rf值等同于标准半乳糖醛酸的位置处未发现红棕色斑点,说明TC-1不含有半乳糖醛酸成分,与上述的红外结果一致。
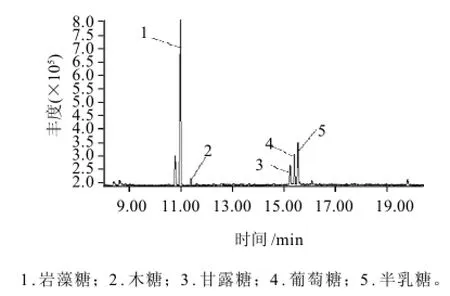
图5 TC-1的总离子流图Fig.5 GC-MS total ion current chromatogram of TC-1
为证实TLC的结果,另取TC-1用2mol/L TFA120℃水解2 h,经硼氢化钠还原,乙酸酐乙酰化后,衍生物进行GC-MS分析,如图5所示,通过与标准单糖相应衍生物的保留时间(图6)比较,得知TC-1主要含有岩藻糖,伴有少量的木糖、甘露糖、葡萄糖和半乳糖,其物质的量比为17.3:1.0:2.6:3.8:5.1。通过IR测定,1240cm-1吸收峰是S=O伸缩振动特征吸收峰,830cm-1是C-O-S振动的特征频率[13],元素分析法测得的硫酸基含量为22.4%,印证了岩藻多糖是含有相当数量的岩藻糖(fucose)和硫酸基的多糖[14]。

图6 标准单糖衍生物的总离子流图Fig.6 GC-MS total ion current chromatogram of mixed standard monosaccharides
2.4 TC-1的甲基化分析
TC-1完全甲基化产物经90%甲酸解聚、TFA水解、硼氢化钠还原及乙酰化后制得部分甲基化的阿尔迪醇乙酸酯衍生物后进行GC-MS分析,结果见表1。

表1 TC-1甲基化分析结果Table1 Methylation analysis of reduced TC-1
由表1可知,岩藻糖残基存在1,4-、1,3-两种连接方式,主要以1,3连接方式为主;木糖残基以1,2-连接方式存在;甘露糖有1,3-、1,6-两种连接方式;葡萄糖存在1,3,4-、1,2,4、6-两种连接方式;半乳糖有1,6-、1,3,6-、1,3,4,6- 3种连接方式。
综合以上的分析结果,TC-1为重均相对分子质量为3.7×105,硫酸基含量为22.4%,由岩藻糖、木糖、甘露糖、葡萄糖、半乳糖组成的复杂硫酸酯多糖。其中岩藻糖糖基以1,4-、1,3-的连接方式存在;木糖以1,3-连接方式存在;甘露糖以1,3-、1,6-连接方式存在;葡萄糖以1,3,4-、1,2,4,6-连接方式存在;半乳糖以1,6-、1,3,6-、1,3,4,6-连接方式存在。
3 讨 论
关于海带中岩藻多糖的组成[15]国内外已有报道。程忠玲[13]报道海带中提取的褐藻糖胶为一种水溶性杂聚糖,其主要原始成分是L-岩藻糖-4-硫酸酯,以及少量的半乳糖、甘露糖、木糖、葡萄糖、阿拉伯糖、糖醛酸、蛋白质和钾、钠、钙、镁等金属离子。L-岩藻糖-4-硫酸酯的结构特征是1,2-连接的聚α-L-吡喃岩藻糖。主链由岩藻糖组成,在岩藻糖上含有大量的硫酸基。李林等[16]研究发现海带中的褐藻糖胶是由鼠李糖(Rha)、岩藻糖(Fvc)、木糖(Xyl)、甘露糖(Man)、半乳糖(Gal)、葡萄糖(Glu)、葡萄糖醛酸、硫酸根及蛋白质构成的复合物,其中单糖的物质的量比为Rha:Fuc: Xyl: Man: Gal: Glu=0.41:1.72:3.75:0.96:1:2.17。褐藻糖胶的葡萄糖醛酸、硫酸根及蛋白质的含量分别为6.2%、8.7%和4.1%。与这些报道相比,本实验从海带中获得的TC-1的单糖组成与它们有所不同,为其在生物活性多样性方面[17]的研究应用提供了基础。
[1]谭周进, 谢达平. 多糖的研究进展[J]. 食品科技, 2003(3): 10-12.
[2]CHANG Huxue, LEI Chen, ZHAO Jieli, et al. Antioxidative activities of low molecular fucoidans from kelp Laminaria japonica[J]. Developments in Food Science, 2004, 42: 139-145.
[3]李波, 许时婴. 羊栖菜中褐藻糖胶的提取纯化研究[J]. 食品工业, 2004 (2): 40-42.
[4]BILAN M I, GRACHEV A A, USTUZHANINA N E, et al. Structure of a fucoidan from the brown seaweed Fucus evanescens[J]. Carbohydrate Research, 2002, 337(8): 719-730.
[5]BILAN M I, CRACHEV A A, SHASHKOW A S, et al. A highly regular fraction of a fucoidan from the brown seaweed Fucus distichus L.[J]. Carbohydrate Research, 2004, 339: 511-517.
[6]CHEVOLOT L, MULLOY B, RATISKOL J, et al. A disaccharide repeat unit is the major structure in fucoidans from two species of brown algae[J]. Carbohydrate Research, 2001, 330: 529-535.
[7]岳真, 曲爱琴, 李守玲, 等. 海带硫酸多糖的分离纯化及性质研究[J].安徽农业科学, 2010, 38(16): 8440-8441; 8448.
[8]周裔彬, 汪东风, 杜先锋, 等. 酸化法提取海带多糖及其纯化的研究[J]. 南京农业大学学报, 2006, 29(3): 103-107.
[9]吕庆, 夏玮, 张文清, 等. 桑叶多糖的分离纯化与分析[J]. 食品与发酵工业, 2007, 33(7): 167-170.
[10]张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 2003: 40-41.
[11]NEEDS P W, SELVENDRAN R R. Avoiding oxidative degradation during sodium hydroxide methyl iodide-mediated carbohydrate methylation in dimethyl sulfoxide[J]. Carbohydrate Research, 1993, 245: 1-10.
[12]方积年. 多糖体的结构分析[J]. 国外医学: 药学分册, 1981, 4(6): 222-228.
[13]程忠玲. 海带中褐藻糖胶研究进展[J]. 食品研究与开发, 2010, 31(4): 181-184.
[14]CHIZHOV A O, DELL A, MORRIS H R, et al. A study of fucoidan from the brown seaweed Chorda filum[J]. Carbohydrate Research, 1999, 320: 108-119.
[15] RIOUX L E, TURGEON S L, BEAULIEU M. Structural characterization of laminaran and galactofucan extracted from the brown seaweed Saccharina longicruris[J]. Phytochemistry, 2010, 71(13): 1586-1595.
[16]李林, 罗琼, 张生华. 海带中褐藻糖胶的组成分析[J]. 中国食品学报, 2001, 1(1): 46-49.
[17]王文亮, 王守经, 宋康, 等. 海带的功能及其开发利用研究[J]. 中国食物与营养, 2008(8): 26-27.
Isolation, Purification and Structural Analysis of Fucoidan from Kelp
ZHANG Wen-qing,ZUO Ping-ping,XU Chen,YANG Lei,ZHANG Yu-long,XIA Wei*
(Shanghai Key Laboratory of Functional Materials Chemistry, School of Chemistry and Molecular Engineering, East China University of Science and Technology, Shanghai 200237, China)
A homogeneous polysaccharide named as TC-1 was obtained from kelp by DEAE-cellulose and gel filtration chromatography. Its chemical structure was characterized by means of monosaccharide composition analysis, methylation analysis and IR spectroscopic analysis. TC-1 was a complex sulfated polysaccharide with a weight-average molecular weight of 3.7 × 105. TC-1 mainly consisted of fucose and small amounts of xylose, mannose, glucose and galactose were also found. The chain of TC-1 included 1,4-linked or 1,3-linked fucose, 1,3-linked xylose, 1,3-linked or 1,6-linked mannose, 1,3,4-linked or 1,2, 4,6-linked glucose, and 1,6- linked,1,3,6- linked, or 1,3,4,6- linked galactose.
kelp;fucoidan;isolation and purification;structural analysis
O636.1
A
1002-6630(2012)01-0068-04
2011-01-14
张文清(1969—),女,教授,博士,主要从事天然产物及功能材料的研究。E-mail:zhwqing@ecust.edu.cn
*通信作者:夏玮(1976—),女,副教授,博士,主要从事天然产物的研究与开发。E-mail:xiawei1999@ecust.edu.cn
