牛初乳中富脯氨酸多肽的纯化与鉴定
2012-04-01李德龙高艳玲张少辉
余 芳,李德龙,张 波,高艳玲,张少辉,2,*
( 1.上海交通大学农业与生物学院,上海 200240;2.上海交通大学陆伯勋食品安全中心,上海 200240)
牛初乳中富脯氨酸多肽的纯化与鉴定
余 芳1,李德龙1,张 波1,高艳玲1,张少辉1,2,*
( 1.上海交通大学农业与生物学院,上海 200240;2.上海交通大学陆伯勋食品安全中心,上海 200240)
以牛初乳为原料,提取分离具有生物活性的富脯氨酸多肽(proline-rich polypeptides,PRP),并从氨基酸组成、分子质量大小和反相色谱方面对其进行测定和分析。结果表明:分离所得多肽脯氨酸含量高达20%;SDS-PAGE显示主成分分子质量分布范围在5~25kD;反相色谱主要谱峰在乙腈体积分数37%~45%处洗脱,在这一体积分数范围内可得到纯度高达96.7%的富脯氨酸多肽。
富脯氨酸多肽;分子质量;氨基酸组成;反相色谱
哺乳动物产后2~3d内所分泌的乳汁统称为初乳[1]。牛初乳作为一种新型功能食品的开发来源,不仅含有丰富的营养物质,而且也富集了一些具有生物活性的免疫因子和生长因子,如免疫球蛋白、乳铁蛋白、溶菌酶、类胰岛素生长因子等。经科学实验证明这类物质具有免疫调节、改善胃肠道、促进生长发育等一系列生理活性功能。因而牛初乳作为动物和人类的重要营养物质,具有抵抗疾病的功能,可作为新一代功能性食品资源库在保健食品行业中广泛应用[2-3]。
富脯氨酸多肽(proline-rich polypeptides,PRP)是近年来新发现的一种来源于牛初乳的多肽类活性成分。PRP的发现源于1974年,波兰科学家Janusz等[4]在采用凝胶过滤法纯化羊初乳IgG2时,伴随IgG2同时存在着另一种成分,一种不能同时被抗免疫球蛋白的抗血清所沉淀的物质PRP。之后的研究表明PRP具有特殊的结构及特性:富含大量的脯氨酸和疏水性氨基酸;在4℃条件下可溶于水,室温下发生可逆性沉淀;它可以调节人体的免疫反应,增强皮肤脉管的渗透性[5],是一种免疫活性物质。近年来又发现这种成分对阿尔茨海默病(Alzheimer disease,AD)具有很好的预防及治疗作用[6-7],因而将这种活性成分从牛初乳中分离出来,并对其某些物理化学性质作客观的鉴定评价,对今后生物活性功能的研究和牛初乳功能性食品的应用都具有重要意义。
在欧美等发达国家,随着人口老龄化的增加,AD的发病率有逐年增加的趋势。由此,英美国家对于初乳来源的PRP功能的研究亦开始渐热。他们研究的内容主要针对PRP糜蛋白酶水解物某些片段的生物活性功能,尤其是在抗氧化、抗衰老、抗神经退行性病变的功效,而对于天然状态PRP的纯化鉴定相对较少。在国内更是未见PRP的相关报道。因此本研究借助有机溶剂提取、盐析、透析等一系列蛋白质纯化的方法从初乳中分离出PRP,并通过分子质量大小、氨基酸组成和反向色谱分析进行化学鉴定,以期更全面地了解这种活性物质。
1 材料与方法
1.1 材料与试剂
牛初乳为乳牛产后第1天的初乳,由蒙牛丹阳现代牧场馈赠。
SDS、溴酚蓝、丙烯酰胺、甲叉丙烯酰胺 国药集团化学试剂公司;Tris、甘氨酸 美国Sigma公司;乙腈 美国Fisher公司;所用试剂均为分析纯。
1.2 仪器与设备
A..KTA Purifier 10层析系统、Source 5RPC ST 4.6/150反相柱 美国GE Healthcare公司;GL-22M型高速冷冻离心机 上海卢湘仪离心机仪器有限公司;L-8900型全自动氨基酸分析仪 日本Hitachi公司;Mini-PROTEAN Tetra System 美国Bio-Rad公司;0.22μm 超滤膜 美国Millipore公司;DYY-6C型电泳仪 北京市六一型仪器厂;透析袋MD34 英国Whatman公司;BS124s型电子分析天平 赛多利斯科学仪器(北京)有限公司;CM-230型摩尔超净水机 上海摩勒科学仪器有限公司。
1.3 方法
1.3.1 PRP的提取
按两步纯化(乙醇提取,硫酸铵沉淀)法提取PRP[8-9]:室温条件下解冻牛初乳,8000×g离心20min脱脂,在低温条件下加入体积分数60%乙醇抽提,边加入边搅拌,酪蛋白等杂蛋白不断析出,12000×g离心,取上层有机相旋转蒸发去除乙醇,蒸发温度设为30℃,待体积恢复至原脱脂乳体积之后,离心去除不溶性沉淀。取PRP水相,以50%饱和硫酸铵盐析,沉淀PRP以少量超纯水溶解,隔夜透析,透析液冻干后保存于-20℃备用。以上所有步骤未特别标明的均在4℃条件下操作。
1.3.2 PRP分子质量的检测
根据表1制备分离胶及浓缩胶。样品与2×样品缓冲液以1:1体积混合稀释后,沸水中加热5min,室温条件下冷却,然后上样进行电泳实验。待指示剂距凝胶下沿0.2~0.5cm处停止电泳,染色30min后开始脱色。计算电泳迁移率(Rf)。
测定小分子多肽的电泳迁移率(Rf),制作标准曲线并计算被测样品的分子质量:以Marker条带的迁移率为横坐标,以其对应的分子质量对数为纵坐标作图,经线性回归计算,制作标准曲线。
1.3.3 PRP氨基酸组成分析
酸水解法水解上述纯化后的PRP[10]:称取2mg放入玻璃管中,加入2mL 6mol/L HCl,充氮气5min,封管。将玻璃管放在110℃恒温干燥箱内水解24h。水解结束后冷却至室温,定容至10mL,过滤,取1mL滤液置真空干燥器中55℃左右抽真空干燥,加入纯水 1mL溶解。加入0.1mmol/L NaOH,调节pH值至1.7~2.2,0.22μm滤膜过滤,转入样品瓶待测。用全自动氨基酸分析仪进行氨基酸组成的分析。
1.3.4 PRP的反相色谱分析
1.3.4.1 色谱工作条件
流动相A液:2% 乙腈水溶液(含0.02%三氟乙酸);流动相B液:75%乙腈;流速1mL/min;进样量1mL;紫外检测波长228nm。流动相 A、B 液需超声脱气后使用。
1.3.4.2 反相色谱分析
称取适量的PRP冻干粉,以少量0.01%二甲基亚砜(DMSO)助溶,加入A液调节质量浓度,使质量浓度在0.5~1mg/mL左右,0.22μm滤膜过滤后上样。经Source 5RPC ST 4.6/150反相层析柱进行线性梯度洗脱。

表1 SDS-PAGE电泳胶配方Table1 Recipe for SDS-PAGE gel
2 结果与分析
2.1 PRP的分子质量
蛋白质分子质量测定常规的方法包括SDS-PAGE和凝胶色谱技术[11]。采用聚丙烯酰胺凝胶电泳法(SDS-PAGE),在查看蛋白混合物样品的复杂程度以及纯化效果的同时,可以预估PRP的分子质量。

图1 PRP混合肽的SDS-PAGE电泳图Fig.1 SDS-PAGE pattern of PRP
SDS-PAGE能够较好地显示标准蛋白条带(图1)。当蛋白质的分子质量在15~200kD时,电泳迁移率与分子质量的对数值呈直线关系,符合下列方程:
1gMr=K-bRf
式中:Mr为蛋白质的分子质量;K为常数;b为斜率;Rf为相对迁移率。在条件一定时,b和K均为常数。
根据电泳结果,对分子质量对数(y)和分离胶中的迁移率(χ)进行线性回归分析,回归方程为y=-1.3276χ+2.0909,相关系数R2=0.9741,具有良好的线性关系。
PRP混合肽经SDS-PAGE电泳,根据分子质量的差异,不同的多肽成分被分开。PRP多肽片段的分子质量分布在5~25kD范围内,且不同多肽之间丰度存在差异,较为清晰的有4个条带。根据标准曲线计算,前2个条带中对应的分子质量分别为24.52、19.47kD;分子质量较小的多肽也有两条且较为接近,分布在5~14.4kD之间,约为10kD。
2.2 PRP的氨基酸组成
本研究将透析之后的PRP分成两部分:一部分为可溶性的PRP,另一部分在透析过程中析出,以沉淀形式存在的物质。为了研究沉淀物质是否属于变性的PRP,本研究对这两部分都进行了氨基酸组成的分析。
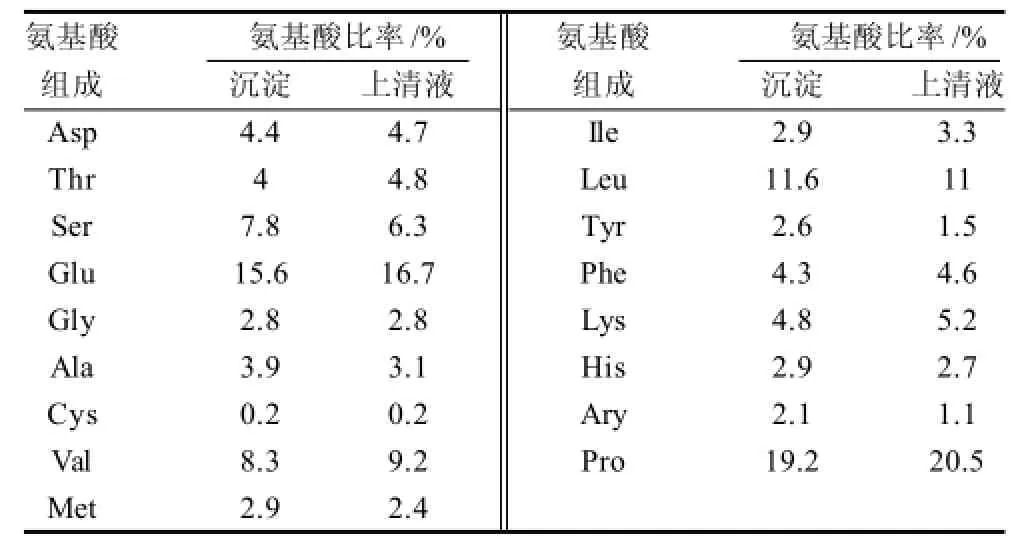
表2 PRP的氨基酸分析表Table2 Amino acid composition of PRP
由表2可知,沉淀与上清液部分谷氨酸、缬氨酸、亮氨酸、脯氨酸的量均明显高于其他氨基酸,其中脯氨酸所占的比率分别为19.2%、20.5%。单纯从氨基酸组成来看,上清液中谷氨酸、缬氨酸、脯氨酸均较沉淀有增加,视为PRP混合肽的特征氨基酸,说明沉淀中包含变性的PRR混合肽。另外,氨基酸分析结果显示PRP中脯氨酸所占的比例约20%,疏水性氨基酸40%,酸性氨基酸21%。由于脯氨酸是一种环状的亚氨基酸,是组成蛋白质的常见20种氨基酸中唯一的亚氨基酸,在肽链中有特殊的作用,易于形成顺式的肽键,不利于α螺旋的形成。有相关文献报道,由于脯氨酸的引入导致多肽和蛋白高级结构的变化,相应地对应着一定的生物学功能[12]。因此,PRP这种氨基酸组成提示PRP结构与生物活性之间可能存在关系。
2.3 PRP的纯化与反相色谱
采用反相色谱(RPC)方法,使用C18反相柱和梯度体积分数乙腈溶液对PRP进行了纯化。

图2 不同检测波长下的PRP吸收峰Fig.2 Absorption spectra of PRP under different detection wavelengths
反相色谱分析结果显示,在不同检测波长下,PRP在228nm处信号较强,且基线漂移不显著,选择228nm作为检测波长(图2)。228nm检测波长下,图谱显示提纯的PRP各不同多肽之间疏水性的差异不明显,50%~60% B液时PRP混合多肽可以洗脱下来,换算后即为37%~45%乙腈(图3)。相关研究认为,这一体积分数洗脱出来的PRP多肽是Colostrinin的主成分,决定了产品的主要活性功能[13]。Unicorn软件积分得到的洗脱峰的总面积为200.70,35~40min内的目标峰面积为194.12,纯度高达96.7%。

图3 PRP反相色谱图Fig.3 RP-HPLC profile of PRP
RPC与其他色谱方法相比具有分辨率和回收率高、重复性好、操作简便等优势。本研究结果表明采用RPC方法,使用合适的反相柱和洗脱液能够对PRP类低分子质量蛋白进行有效的分离纯化。相关文献也表明与较大分子质量蛋白质的分离相比,RPC更适用于分子质量小、空间折叠相对简单的多肽。因为蛋白质的立体构型及构象复杂,与流动相、固定相及样品中的其他成分之间往往存在多种复杂的相互作用,使蛋白变性失活。但作为一种分析手段,却能够给出蛋白质的结构特征及疏水性等信息[14]。
3 结 论
本研究借助有机溶剂提取、盐析、透析等一系列蛋白质纯化的方法,从牛初乳中分离并纯化了PRP混合性多肽,以分子质量大小,氨基酸组成和反相色谱差异为指标鉴定了PRP混合多肽的物理化学特性。PRP不是单一肽,而是一种混合肽,组成较为复杂,SDS-PAGE显示的分子质量分布在5~25kD左右,丰度较高的多肽有4条,分子质量较大的为24.52、19.47kD。PRP的氨基酸组成较为特殊,脯氨酸、谷氨酸、缬氨酸、亮氨酸的含量较高,其中脯氨酸约20%,疏水性氨基酸40%,酸性氨基酸21%。反相图谱显示PRP不同多肽之间结构差异不明显,采用C18反相柱和体积分数为37%~45%的乙腈洗脱可得到纯度96.7%的PRP产物。
初乳功能性食品的开发研究具有广阔的应用前景。PRP作为初乳来源的功能性成分,没有物种特异性,对包括人在内的所有哺乳动物都能起作用,可以广泛应用在保健食品行业。目前,还不能达到逐个分离PRP单一多肽的要求,关于结构特点的描述尚停留在混合物层面上。单一多肽的分离鉴定、相应生物学功能的研究以及作用机制是未来研究的方向之一。
[1]李凤林. 乳及发酵乳制品工艺学[M]. 北京: 中国轻工业出版社, 2007.
[2]PURUP S, VESTERGAARD M, PEDERSEN L O, et al. Biological activity of bovine milk on proliferation of human intestinal cells[J]. Journal of Dairy Research, 2007, 74(1): 58-65.
[3]于立芹, 庞广昌. 牛初乳中生物活性成分的研究进展[J]. 食品科学, 2007, 28(9): 604-609.
[4]JANUSZ M, LISOWSKI J, FRANF. Isolation and characterization of a proline-rich polypeptide from ovine colostrum[J]. FEBS Letters, 1974, 49(2): 276-279.
[5]WIECZOREK Z, ZIMECKI M, JANUSZ M, et al. Proline-rich polypeptide from ovine colostrum: its effect on skin permeability and on the immune response[J]. Immunology, 1979, 36(4): 875-881.
[6]SZANISZLO P, GERMAN P, HAJAS G, et al. New insights into clinical trial for colostrininTMins disease[J]. The Journal of Nutrition, Health, Aging, 2009, 13(3): 235-241.
[7]STEWART M G. ColostrininTM: a naturally occurring compound derived from mammalian colostrum with efficacy in treatment of neurodegenerative diseases, including Alzheimer[J]. Expert Opin Pharmacother, 2008, 9(14): 2553-2559.
[8]KRUZEL M L, POLANOWSKI A, WILUSZ T. The alcohol-induced conformational changes in casein micelles: a new challenge for the purification of colostrinin[J]. Protein Journal, 2004, 23(2): 127-133.
[9]GEORGIADES J A, POLANOWSKI A, WILUSZ T, et al. Purification of peptides from colostrum: US, WO/2009/0234099A1[P]. 2009-09-17.
[10]中华人民共和国卫生部中国国家标准化管理委员会. GB/T 5009.124—2003 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2004.
[11]孔毅, 吴梧桐, 吴如金. 蛋白质分子量测定方法比较研究[J]. 仪器分析, 2003(2): 44-47.
[12]PEREZ-ARELLANO I, CARMONA-LVAREZ F, GALLEGO J, et al. Molecular mechanisms modulating glutamate kinase activity. Identification of the proline feedback inhibitor binding site[J]. Journal of Molecular Biology, 2010, 404(5): 890-901.
[13]ZIMECKI M. A proline-rich polypeptide from ovine colostrum: colostrinin with immunomodulatory activity[J]. Experimental Medicine and Biology, 2008, 606(2): 241-250.
[14]朱晓囡, 苏志国. 反相液相色谱在蛋白质及多肽分离分析中的应用[J]. 分析化学, 2004, 24(2): 248-254.
Purification and Identification of Proline-rich Polypeptides from Bovine Colostrum
YU Fang1,LI De-long1,ZHANG Bo1,GAO Yan-ling1,ZHANG Shao-hui1,2,*
( 1. School of Agriculture and Biology, Shanghai JiaoTong University, Shanghai 200240, China;2. Luh Bor. S. Research Center for Food Safety, Shanghai JiaoTong University, Shanghai 200240, China)
Bovine colostrum was extracted to obtain bioactive proline-rich polypeptides (PRP). The molecular weight and amino acid composition of PRP were analyzed by means of SDS-PAGE and an automated amino acid analyzer, respectively. Reversedphase high performance liquid chromatography (RP-HPLC) was employed to purify PRP. The results showed that the proline content in PRP was as high as 20%. The molecular weights of principal components were in the range of 5-25 kD as determined by SDS-PAGE. RP-HPLC showed that major spectral peaks were eluted by 37%-45% acetonitrile. As a result, PRP with a purity of 96.7% was obtained.
proline-rich polypeptide;molecular weight;amino acid composition;reversed-phase chromatography
TS252.1
A
1002-6630(2012)01-0077-04
2011-01-23
余芳(1986—),女,硕士研究生,研究方向为乳品科学。E-mail:yuflili@sjtu.edu.cn
*通信作者:张少辉(1965—),男,研究员,博士,研究方向为乳品科学。E-mail:shaohuizhang@sjtu.edu.cn
