木糖-甘氨酸美拉德反应体系光谱特性和抗氧化性能的研究
2012-04-01于彭伟刘登勇周光宏
于彭伟,刘登勇,周光宏
(南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
木糖-甘氨酸美拉德反应体系光谱特性和抗氧化性能的研究
于彭伟,刘登勇,周光宏*
(南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
采用木糖和甘氨酸进行模式美拉德反应,考察反应进程中产物pH值、吸光度及颜色参数的变化,并以1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力、Fe2+螯合能力及油脂过氧化值(POV)为指标,研究美拉德反应产物的抗氧化效果。结果表明:随着反应的进行,产物由无色变为蓝色最后生成褐色;反应pH值和L*值逐渐降低,a*值增大,b*值减小,但后期两者变化不显著。产物具有很好的Fe2+螯合能力,POV值较低,但清除DPPH自由基能力不强。总体而言,产物具有较强的抗氧化能力。
美拉德反应;光谱特性;抗氧化性
美拉德反应(Maillard reaction)又称羰氨反应或非酶褐变反应,是指氨基化合物和羰基化合物之间发生的反应,是食品颜色及风味产生的主要途径之一[1-2]。研究表明美拉德反应产物(主要是含类黑精,还原酮以及含N、S、O的杂环化合物)具有一定的抗氧化性。近年来,关于美拉德反应产物(MRPs)的抗氧化性研究逐渐增加,而且成为当今食品营养学和食品化学领域的热门课题,因为目前食品工业上广泛应用的抗氧化剂如BHA、BHT和TBHQ等是合成抗氧化剂,欧美国家己禁止使用[3]。MRPs是食品加工和储藏过程中自身产生的一类物质,可认为是天然的,有望成为下一代天然无毒的抗氧化剂,被期望用以代替现有食用抗氧化剂,正逐渐引起人们的关注[4-5]。
Hayase等[6]研究发现木糖-甘氨酸美拉德反应体系生成一种蓝色中间产物,并命名为Blue-M1。Murakami等[7]进一步研究了木糖-甘氨酸产物与自由基清除能力之间的关系,证实其产物具有一定的自由基清除能力。因此,研究木糖-甘氨酸美拉德反应产物可以为探索美拉德反应终点及应用新型食品色素和具有抗氧化性的功能性食品添加剂提供实验数据。本研究通过光谱扫描及颜色参数确定反应进程和反应终点,并通过相关指标研究产物的抗氧化性。
1 材料与方法
1.1 材料、试剂与仪器
猪背最长肌购自南京卫岗集贸市场。
L-甘氨酸(生化纯) 美国Amresco公司;菲洛嗪美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl,DPPH) 上海梯希爱化成工业发展有限公司;D-木糖(食品纯) 北京嘉康源科技发展有限公司;碳酸氢钠、氯化亚铁、三氯甲烷、冰乙酸等其他化学试剂均为分析纯。
pH计 瑞士梅特勒-托利多公司;CR-400型色差仪 日本柯尼卡公司;UV-2450型紫外分光光度计 日本岛津公司;SpectraMax M2e型酶标仪 美国分子仪器公司;ZKSY-600智能恒温水浴锅 南京科尔仪器设备有限公司。
1.2 方法
1.2.1 MRPs的制备
分别称取D-木糖、L-甘氨酸和NaHCO3,加入二次蒸馏水配制成木糖1mol/L、甘氨酸0.2mol/L和NaHCO30.1mol/L的美拉德反应体系,用10mol/L NaOH溶液调节pH值至9.0。将此配制的溶液等份分装于10mL离心管中,放入水浴锅(30℃),开始计时,盖上水箱盖子予以避光。每隔24h取样,样品取出后立即在冰浴中冷却5min,再放入4℃冷库保存,作为样品液待测。
1.2.2 对产物的光谱扫描
用UV-2450型紫外分光光度计对MRPs于波长400~700nm范围进行光谱扫描,为保证读数在适合范围内,将反应物稀释一定倍数。
用SpectraMax M2e型酶标仪对MRPs在所需波长(预实验测定最佳激发波长为3 47 nm,最佳发射波长为460nm处测定吸光度。为保证读数在适合范围内,将反应物稀释一定倍数。
1.2.3 色差的测定
打开色差仪,校正调试后,将测试头放在待测样品上。准确吸取MPRs 2.5mL,放在待测样品槽中,测定其L*、a*、b*值。其中,L*值代表亮度;a*值代表红度,正值越大样品颜色越偏红,负值越大样品颜色越偏绿;b*值代表黄度,正值越大样品颜色越偏黄,负值越大样品颜色越偏蓝。
1.2.4 铁离子螯合能力的测定
按文献[8]稍加修改,通过评价在562nm波长处铁离子-菲洛嗪混合物的吸光度来研究MRPs的铁离子螯合能力。取稀释4倍的MRPs 5mL,加入0.1mL 2mmol/L的氯化亚铁溶液和0.2mL 5mmol/L的菲洛嗪溶液,混合均匀。同时取质量浓度为0.4g/100mL茶多酚做同样处理,混合液室温静置10min,于562nm波长处测定吸光度。较高的铁离子螯合能力导致在562nm波长处较低的吸光度。用式(1)计算铁离子螯合能力。
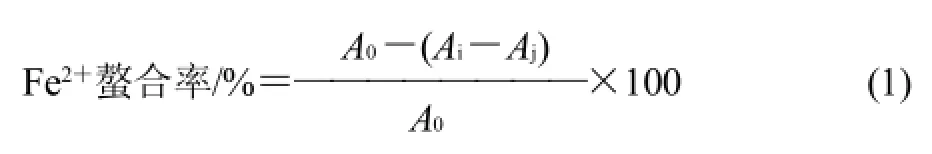
式中:A0为未加MRPs溶液所测得的吸光度;Ai为加MRPs后溶液所测得的吸光度;Aj为MRPs的吸光度。
1.2.5 过氧化值(POV)的测定
参照GB/T 5009.37—2003《食用植物油卫生标准的分析方法》[9]测定POV值。油脂氧化过程中产生过氧化物,与KI作用,生成游离碘,以Na2S2O3溶液滴定,计算含量。称取0.2g左右的MRPs,加入8g大豆油,置于20mL烧杯中,同时取0.4%茶多酚做同样处理并加入一滴吐温-60助溶,用薄膜密封瓶口放常温(5~10℃) 50d,用式(2)计算POV值。

式中: X为试样的过氧化值(meq/kg);V1为试样消耗硫代硫酸钠标准滴定溶液体积/mL;V2为试剂空白消耗硫代硫酸钠标准滴定溶液体积/mL;c为硫代硫酸钠标准滴定溶液的浓度/(mol/L);m为试样质量/g。
1.2.6 DPPH自由基清除能力的测定
对文献[10]方法做适当修改。取稀释5倍的MRPs 2mL及0.1mmol/L的DPPH乙醇溶液2mL加入同一具塞试管中摇匀,同时取0.4g/100mL茶多酚做同样处理,于室温密闭静置30min,未加样品液为空白,无MRPs处理为对照,于517nm波长处测定吸光度。用式(3)计算DPPH自由基清除率,清除率越大抗氧化能力越强。

式中:A0为未加MRPs 时DPPH 溶液的吸光度;Ai为加MRPs后DPPH溶液的吸光度;Aj为MRPs的吸光度。
1.3 数据处理
用Microsoft Excel统计处理,用SAS 8.2进行线性分析和邓肯多重比较(Duncan’s multiple-range test)。每个处理重复3次。
2 结果与分析
2.1 美拉德反应进程的变化
2.1.1 反应体系pH值的变化

图1 L-甘氨酸与D-木糖反应的美拉德产物pH值Fig.1 pH values of MRPs of L-glycine and D-xylose
在反应初始的24h内,pH值有明显的下降,反应速率较快,而反应至192h,pH值为7.97,因此前24h的pH值下降水平占总下降水平的46.6%,较其他时间点有显著下降(P<0.05)。反应体系pH值的下降主要是由于羰基在加热过程中不断地与碱基基团-氨基进行缩合,使得游离的氨基被封闭,致使体系的pH值不断下降,在体系反应接近终点时,没有足够的羰基与氨基进行缩合,导致p H值趋于平稳。
2.1.2 MRPs的光谱扫描
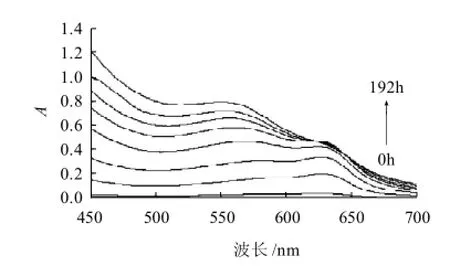
图2 L-甘氨酸与D-木糖反应的美拉德产物的可见吸收光谱Fig.2 Visible absorption spectra of MRPs of L-glycine and D-xylose
由图2可知,MRPs在570nm和627nm波长处有两个吸收峰。加热24h后,在627nm波长处出现吸收峰,溶液呈现蓝绿色,该物质是类黑精的前体物,与Murakami等[7]的研究一致。随反应的进行,在96h于570nm波长处出现另一吸收峰,Shirahashi等[11]最新研究表明该吸收峰处的物质和蓝色物质一样是MRPs的前体物质,该物质的生成表明反应体系已进入高级阶段,此后570nm波长处吸收峰逐渐增大,且吸收峰发生蓝移,可能是物质结构发生变化,不断生成新物质导致吸收光谱的吸收峰向短波方向的移动。在120h时,蓝色产物(627nm波长处吸收峰)峰值达到最大,此后逐渐减小,表明产物聚合消除速率大于生成速率,说明在120h蓝色产物即作为前体物参与最终反应阶段。
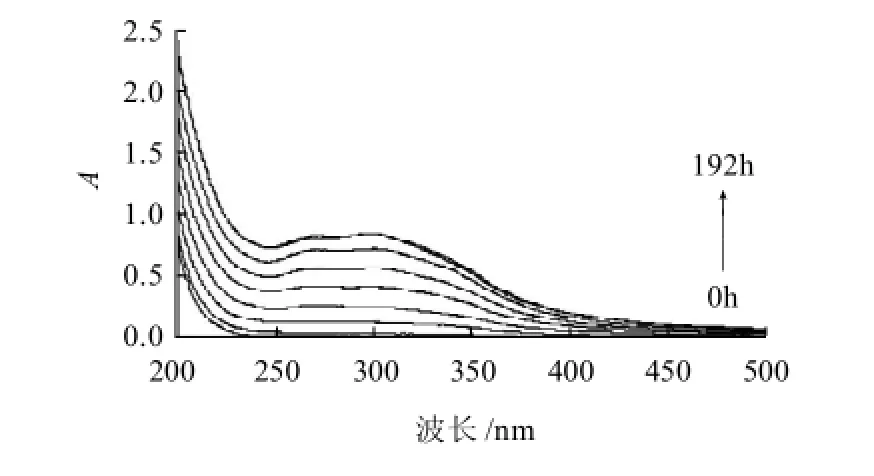
图3 L-甘氨酸与D-木糖反应的美拉德产物的紫外吸收光谱Fig.3 UV absorption spectra of MRPs of L-glycine and D-xylose
由图3可知,反应进行到72h美拉德反应产物在272nm和298nm波长处产生吸收峰,这两处的吸收峰主要是美拉德反应中高级阶段的无色小分子中间体[12]。随着反应的进行两吸收峰逐渐增大,在168h达到最大值,之后趋于平稳。表明高级阶段中小分子参与最终反应阶段,经过环化、降解、缩合等,形成褐色产物[13]。
2.1.3 MRPs的荧光强度(FI)变化
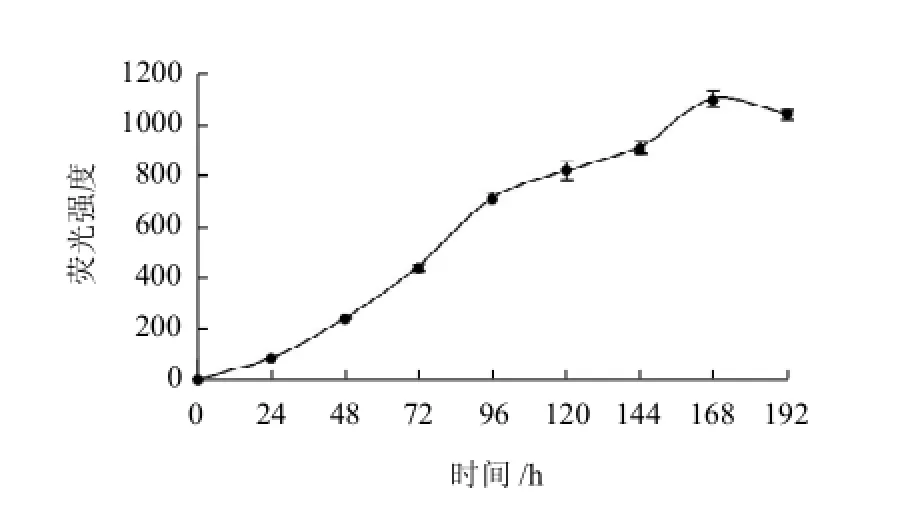
图4 L-甘氨酸与D-木糖反应的美拉德产物的荧光强度Fig.4 Fluorescence intensity of MRPs of of L-glycine and D-xylose
首先对MRPs进行适当稀释,确定最佳激发与发射波长分别为347nm和460nm,以测定各时间点反应产物的荧光强度。由图4可知,FI随时间延长线性增加,线性相关系数(R2)达到0.9606(P<0.0001)。FI在168h出现最大值,然后降低。FI表征了高级阶段荧光小分子的产生状态,反应在前168h持续增加,然后降低,高级阶段小分子物质相互聚合成褐色类黑精,导致聚合消除速率大于生成速率,表明美拉德反应进入终极阶段。这与Benjakul等[14]研究认为荧光化合物是棕色物质的前体,荧光强度达最大之后随着加热时间的延长,荧光化合物逐渐分解为棕色物质而呈现下降趋势相一致。
2.1.4 MRPs的色泽变化
模式美拉德反应比较复杂,产物较多,色泽变化明显。本实验模式体系颜色首先由无色变为浅蓝色,颜色继续加深变为深蓝色,最终生成褐色产物。图5描述了色差(L*、a*、b*值)随时间的变化趋势。

图5 L-甘氨酸与D-木糖反应的美拉德产物的色差值Fig.5 Color parameters of MRPs of L-glycine and D-xylose
由图5可知,在初始48h内,b*值和L*值随时间延长线性下降(P<0.0001),之后下降缓慢,趋于平稳。而在初始48h内,a*值显著下降后上升,在48h达最大,之后缓慢降低。初始24h色差值的变化表明反应体系速率较快,溶液先由无色变为浅蓝色,随着反应进行,溶液又由浅蓝色变为深蓝色,最终生成褐色产物。
2.1.5 美拉德反应终点的确定

表1 MRPs光谱特性与色差值参数相关系数Table1 Correlation coefficients between spectroscopic characteristics and color parameters of MRPs
由表1可知,A627nm和b*值、L*值相关系数分别为-0.89846和-0.90558,均为显著负相关(P<0.01),表明随蓝色产物的生成,美拉德反应产物颜色变蓝且颜色逐渐加深。FI和A627nm呈极显著正相关(P<0.01),蓝色产物和具荧光的小分子物质随反应的进行几乎呈线性增加,但荧光小分子物质在168h达最大量后开始减小,而蓝色物质在120h达最大量后减少,说明蓝色物质较荧光分子物质先进入最终反应阶段。由以上可以判断反应在进行到120h时,以蓝色产物为主的前体物进入最终反应阶段,所以判定反应到120h为反应进入终级阶段。
2.2 MRPs抗氧化性的研究
MRPs的抗氧化性主要从DPPH自由基清除、金属离子螯合力和抗油脂氧化三方面着手进行分析,同时取0.4g/100mL茶多酚作对比,以判断MRPs的抗氧化能力。
2.2.1 MRPs的Fe2+螯合能力

图6 L-甘氨酸与D-木糖反应的美拉德产物Fe2+螯合能力Fig.6 Ferrous ion-chelating activity of MRPs of L-glycine and D-xylose
实验发现不加热体系产物(0h产物)的Fe2+的螯合率已高达69.6%,可能是由于甘氨酸本身具有金属离子螯合能力的缘故。由图6可知,在24h内产物Fe2+螯合能力显著增强(P<0.05),达到最大值为94.3%,随后Fe2+螯合能力有所降低,在120h产物Fe2+螯合能力最弱,为77.4%。120h后产物Fe2+螯合能力增强,维持在90%左右,可能是由于反应前期具有Fe2+螯合能力的产物分解,螯合能力降低,120h之后,随着最终产物-类黑晶的生成,Fe2+螯合能力又重新增强,并保持稳定。0.4g/100mL茶多酚对Fe2+螯合率仅为10.4%,产物Fe2+螯合能力明显优于0.4g/100mL茶多酚。
2.2.2 MRPs的POV值

图7 L-甘氨酸与D-木糖反应的美拉德产物的POV值Fig.7 POV of MRPs of L-glycine and D-xylose
由图7可知,CK组(空白组)POV值最高(16.37meq/kg),和其他各组差异极显著(P<0.05),表明油脂氧化严重。处理组中0h的POV值最高(9.06meq/kg),但显著低于CK组,可能是由于室温条件下,美拉德反应又开始进行,生成抗氧化性物质,或者是由于甘氨酸具有一定的抗氧化性,从而抑制油脂的氧化。0h组POV值显著高于其他各MRPs处理组(P<0.05),其他各组POV值均低于0.4g/100mL茶多酚处理组,说明MRPs抗油脂氧化能力优于0.4g/100mL茶多酚。其中192h处理组最低(5.60meq/kg),表明192h处理组的抗油脂氧化能力最强。
2.2.3 MRPs对DPPH自由基的清除能力
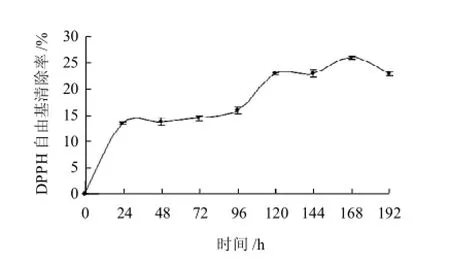
图8 L-甘氨酸与D-木糖反应的美拉德产物对DPPH自由基清除能力Fig.8 DPPH free radical scavenging activity of MRPs of L-glycine and D-xylose
由图8可知,反应体系产物对DPPH自由基的清除能力较差,最高清除率仅为25.8%,出现在168h,而0.4g/100mL茶多酚对DPPH自由基清除率达到91.6%,可见体系产物对DPPH自由基清除能力要比茶多酚差一些。实验结果与Cammerer等[15]认为美拉德反应在碱性环境中产物清除自由基能力强正好相反,产物对DPPH自由基清除率较低可能是由于MRPs没有产生足够的H原子或自由基中间体与DPPH形成稳定的分子结构。在初始24h内,产物DPPH自由基清除率随反应时间延长呈线性增加。在168h达到最大值后下降,可能是抗氧化性物质分解或生成其他物质,导致对DPPH自由基清除能力下降。

表2 DPPH自由基清除能力和FI、色差值参数相关系数Table2 Correlation coefficients among fluorescence intensity, color parameters and DPPH free radical scavenging activity of MRPs
由表2可知,DPPH自由基清除能力和FI、L*值、b*值存在显著相关性。DPPH自由基清除能力和FI相关系数达到0.89070,为显著正相关(P<0.01)。此结论与Morales等[16]研究在美拉德反应中,其产物与荧光物质有着很好的线性关系的结论一致。DPPH自由基清除能力与L*值、b*值也具有显著负相关(P<0.01),表明随反应颜色的加深,自由基清除能力加强,因此在一定程度上可以用美拉德反应颜色的变化表征自由基的清除能力。
3 结 论
本实验通过甘氨酸-木糖反应研究体系产物光谱特性和色差参数确定反应终点,为食品行业中确定美拉德反应进程提供一定的理论依据,反应产物具有很好的Fe2+螯合能力和抗油脂氧化能力,但对DPPH自由基清除能力较弱,这还需要进一步的研究。该体系产物具有较好的抗氧化功能,又因为反应产生的特征亮色色素,使得产物被用作食品色素及具有抗氧化能力的功能性食品添加剂成为可能。下一步工作的重点将主要就美拉德反应可能产生的有害物质进行分析和检验,为应用于食品行业提供一定的安全理论依据。
[1]WALLER G R, FEATHER M S. The Maillard reaction in foods and nutrition[M]. Washington D C, USA: ACS, 1983.
[2]FUJIMAKI M, NAMIKI M, KATO H. Amino-carbonyl reactions in food and biological systems[C]//Proceedings of the 3rd International Symposium on the Maillared Reaction. Amsterdam: Elsevier, 1986: 363-371.
[3]WANG Huiying, SUN Tao. Progress in research of antioxidative activity of Maillard reaction products[J]. Food Science and Technology, 2007, 8: 12-15.
[4]OSADA Y, SHIBAMOTO T. Antioxidative activity of volatile extracts from Maillard model systems[J]. Food Chemistry, 2006, 98(3): 522-528.
[5]EISSA H A, FADEL H H M, IBRAHIM G E, et al. Thiol containing compounds as controlling agents of enzymatic browning in some apple products[J]. Food Research International, 2006, 39(8): 855-863.
[6]HAYASE F, TAKAHASHI Y, TOMINAGA S, et al. Identification of blue pigment formed in a D-xylose-glycine reaction system[J]. Bioscience, Biotechnology, and Biochemistry, 1999, 63(8): 1512-1514.
[7]MURAKAMI M, SHIGEEDA A, DANJO K, et al. Radical-scavenging activity and brightly colored pigments in the early stage of the Maillard reaction[J]. Journal of Food Science, 2002, 67(1): 93-96.
[8]CHAN E W C, LIM Y Y, CHEW Y L. Antioxidant activity of Camellia sinensis leaves and tea from a lowland plantation in Malaysia[J]. Food Chemistry, 2007, 102(4): 1214-1222.
[9]中华人民共和国卫生部. GB/T 5009.37—2003 食用植物油卫生标准的分析方法[S]. 北京: 中国标准出版社, 2004.
[10]JING H, KITTS D D. Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems[J]. Archives of Biochemistry and Biophysics, 2004, 429(2): 154-163.
[11]SHIRAHASHI Y, WATANABE H, HAYASE F. Identification of red pigments formed in a D-xylose-glycine reaction system[J]. Biosci Biotechnol Biochem, 2009, 73(10): 2287-2292.
[12]AJANDOUZ E H, TCHIAKPE L S, ORE F D, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Journal of Food Science, 2001, 66: 926-931.
[13]SARA I F S, WIM M F, MARTINUS A J S, et al. A review of Maillard reaction in food and implications to kinetic modeling[J]. Food Science and Technology, 2000, 11(9): 364-373.
[14]BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products form a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93: 189-196.
[16]MORALES F J, JIMENEZ-PEREZ S. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry, 2001, 72(1): 119-125.
Spectroscopic Characteristics and Antioxidant Properties of Xyl-Gly Maillard Reaction System
YU Peng-wei,LIU Deng-yong,ZHOU Guang-hong*
(Key Laboratory of Meat Processing and Quality Control, Ministry of Education, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Maillard reaction products (MRPs) were prepared using xylose and glycine by model Maillard reaction. The pH value, absorbance and color parameters of the MRPs were determined. Meanwhile, the antioxidant effect was evaluated in terms of DPPH free radical scavenging activity, ferrous ion-chelating activity and lipid peroxidation inhibitory activity. The results showed that the colorless reaction system became blue and finally showed brown color as the reaction proceeded. Moreover, the pH and L* value gradually decreased. The a* value increased, while the b* value revealed an opposite change. However, the two color parameters changed little during the later part of the reaction. The MRPs exhibited good ferrous ion-chelating activity, and resulted in a lower peroxide value, but possessed weak DPPH free radical scavenging activity. In general, the products had strong antioxidant properties.
Maillard reaction;spectroscopic characteristics;antioxidant properties
TS201.2
A
1002-6630(2012)01-0054-05
2011-01-19
国际科技合作项目(2009DFA31770)
于彭伟(1985—),男,硕士研究生,研究方向为肉品安全与质量控制。E-mail:pengwei1985101@sina.com
*通信作者:周光宏(1960—),男,教授,博士,研究方向为肉品科学与食品安全。E-mail:ghzhou@njau.edu.cn
