NOD2和TRAF2在结直肠癌中的表达
2012-03-27王世夫应香岚陈华斌阮正英
罗 斌,王世夫,应香岚,陈华斌,阮正英,陈 豪
NOD2和TRAF2在结直肠癌中的表达
罗 斌1,王世夫1,应香岚2,陈华斌1,阮正英3,陈 豪3
目的:观察结直肠癌组织中核苷酸结合寡聚化结构域2(NOD2)和肿瘤坏死因子受体相关因子2(TRAF2)蛋白的表达,探讨自然免疫在结直肠癌的形成和转移中可能所起的作用。方法:选取结直肠癌患者31例,取癌组织(肠癌组)及其邻近的正常肠黏膜组织(对照组),免疫组化法检测其NOD2和TRAF2蛋白的表达。结果:肠癌组NOD2和TRAF2的阳性表达率(分别为61%和68%)显著高于对照组(分别为32%和35%),均P<0.05;且肠癌组的阳性表达水平(OD值分别为0.186±0.034和0.232±0.041)也显著高于对照组(OD值分别为0.151±0.023和0.148±0.035),均P<0.01。在20例伴有腹腔淋巴结转移的肠癌组中,TRAF2的阳性表达率(75%)显著高于不伴有腹腔淋巴结转移者(55%),P<0.05;而两组NOD2的阳性表达率分别为70%和45%,P>0.05。结论:NOD2和TRAF2在结直肠癌组织中表达增强,它们参与了结直肠癌的形成,TRAF2可能还与结直肠癌的转移有关,自然免疫在结直肠癌的形成中可能起着重要作用。
结直肠癌;核苷酸结合寡聚化结构域;肿瘤坏死因子受体相关因子;淋巴结转移;免疫组织化学
随着环境污染加重,癌症的发病率和死亡率都在不断上升[1]。因其形成和转移的机制十分复杂,至今尚未完全阐明,其中免疫与肿瘤的相互作用一直是近年来研究的热点之一[2]。核苷酸结合寡聚化结构域(nucleotide binding oligomerization domain containing,NOD)是一种细胞质模式识别受体,在介导识别微生物、自然免疫反应、抗原递呈等过程中起了非常重要的作用[3],参与了自身炎症性疾病的发病过程[4]。但是它与肿瘤形成的关系如何,目前知之甚少。肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factors,TRAFs)是介导TNF/TNFR信号传导通路的重要分子,在自然免疫和获得性免疫中都起重要作用,是细胞凋亡和细胞应激反应的重要调节因子,还与恶性肿瘤的死亡率有关[5],但不同亚型的TRAFs在不同(或相同)的疾病中所起的作用可能不尽相同。本研究通过观察结直肠癌组织NOD2和TRAF2的表达情况,探讨它们在结直肠癌发病中的可能作用机制,为结直肠癌的治疗提供新的理论依据。
1 资料与方法
1.1 研究对象 本组31例来自2008年2月—2010年8月期间住院手术患者,均经手术后病理确诊,术前均未接受放疗或化疗。结肠癌9例,直肠癌22例。27例进行根治手术。病理分型为中分化腺癌19例,低分化6例,黏液腺癌3例,中分化黏膜内癌2例,印戒细胞癌1例,伴有腹腔淋巴结转移20例。男性19例,女性12例;年龄34~85岁,平均(64±16)岁。术毕立即取肿瘤组织及癌旁组织,以距肿瘤5 cm以上的正常肠黏膜组织作为正常对照。
1.2 主要试剂 小鼠抗人NOD2和TRAF2多克隆抗体分别购自美国Millipore公司和Santa Cruz公司,免疫组化试剂盒(S-P)和DAB染色试剂均购自上海研吉生物有限公司。
1.3 免疫组化方法 NOD2和TRAF2的表达 采用二步法测定NOD2和TRAF2的表达[6]。主要步骤:标本经固定、脱水、包埋、切片、抗原修复,灭活内源性过氧化物酶,兔血清封闭,滴加抗体,DAB显色等,PBS代替一抗作阴性对照。NOD2和TRAF2的抗体稀释浓度分别为1∶25和1∶20。
1.4 结果判定 光镜下观察细胞着色情况:蛋白定位于肿瘤细胞胞浆内,阳性细胞胞浆呈棕黄色,结构清晰,着色明显高于背景。每张切片观察5个视野(×200),取其平均值即为每张切片的观察结果。按阳性细胞所占比例及分布情况判定如下:阴性(-):单个细胞染色,阳性细胞数<5%;阳性(+):阳性细胞数>5%。对阳性细胞切片随机选择5个视野,Image-pro Plus 5.1免疫组化图像分析系统对阳性细胞进行灰度扫描,取其平均值代表该片的光密度值(OD值)。
2 结果
2.1 肠癌组织镜下表现 肿瘤细胞呈不规则腺管样、乳头样排列,腺体互相吻合或不完整,细胞增生,核位于基底呈假复层或复层、极性紊乱、异形明显、胞浆较丰富,可见黏液分泌及杯状空泡,肿瘤细胞侵润肠壁。
2.2 NOD2蛋白的表达 阳性细胞的胞浆呈棕黄色表达,NOD2蛋白主要表达在肠癌细胞和正常肠腺上皮细胞的胞浆内。肠癌组有19例NOD2表达阳性,其阳性表达率为61%;对照组有10例NOD2表达阳性,其阳性表达率为32%。肠癌组NOD2显著高于对照组(P<0.05)。20例伴有腹腔淋巴结转移的肠癌组中,有14例NOD2表达阳性,其阳性表达率为70%。11例不伴有腹腔淋巴结转移的肠癌组中,有5例NOD2表达阳性,其阳性表达率为45%。肠癌组中伴有或不伴有腹腔淋巴结转移者相比,NOD2阳性表达率差异无统计学意义(P>0.05)。结直肠癌组织中NOD2蛋白阳性表达的光密度值显著高于对照组(t=2.873,P<0.01,见表1,图1~图2)。
表1两组NOD2蛋白表达水平比较(OD值,±s)

表1两组NOD2蛋白表达水平比较(OD值,±s)
注:与对照组比较,a P<0.01
组别n NOD2对照组肠癌组10 19 0.151±0.023 0.186±0.034a

图1 正常肠组织上皮细胞胞浆中NOD2蛋白表达(SP×200)
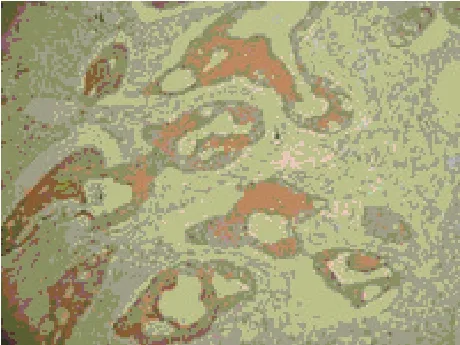
图2 肠癌组织上皮细胞胞浆中NOD2蛋白表达(SP× 200)
2.3 TRAF2蛋白的表达 阳性细胞的胞浆呈棕黄色,TRAF2蛋白主要表达在肠癌细胞和正常肠腺上皮细胞的胞浆内。肠癌组有21例TRAF2表达阳性,其阳性表达率为68%;对照组有11例TRAF2表达阳性,其阳性表达率为35%,肠癌组TRAF2显著高于对照组(P<0.05)。20例伴有腹腔淋巴结转移的肠癌组中,有15例TRAF2表达阳性,其阳性表达率为75%。11例不伴有腹腔淋巴结转移的肠癌组中,有6例TRAF2表达阳性,其阳性表达率为55%。肠癌组伴有腹腔淋巴结转移者TRAF2阳性表达率显著高于不伴有腹腔淋巴结转移者(P<0.05)。肠癌组织中TRAF2蛋白阳性表达的光密度值显著高于对照组(t=5.768,P<0.01,见表2,图3~图4)。
表2 两组患者TRAF2蛋白表达水平的比较(OD值,±s)

表2 两组患者TRAF2蛋白表达水平的比较(OD值,±s)
注:与对照组比较,aP<0.01
组别对照组肠癌组n 11 21 TRAF2 0.148±0.035 0.232±0.041a

图3 正常肠组织上皮细胞胞浆中TRAF2蛋白表达(SP×200)
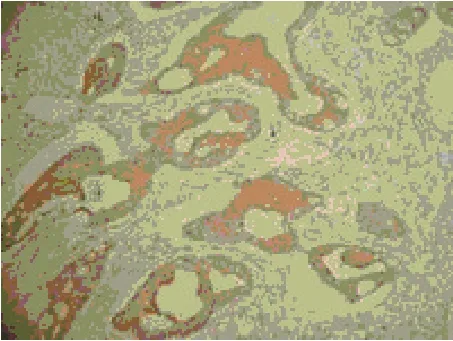
图4 肠癌组织上皮细胞胞浆中TRAF2蛋白表达(SP×200)
3 讨论
NOD是一种介导自然免疫的跨膜信号转导的模式识别受体家族,在介导感染性和非感染性疾病的自然免疫中可能起着非常重要的作用[7]。至今已发现20多个 NOD成员,其中最有代表性的是NOD1和NOD2,它们都能识别细菌肽聚糖的降解产物,作用于共同的下游分子受体作用蛋白2(receptor interacting protein 2,Rip2),然后激活NF-κB[8],从而促进促炎细胞因子的转录引起机体炎症反应[9-10]。目前认为,NOD2不仅在巨噬细胞、树突状细胞的抗原递呈和吞噬中起了作重的作用[11],还参与炎症性肠病和溃疡性结肠炎等炎症过程[12-13]。但NOD2能否参与结直肠癌的形成,则鲜见报道。
本研究发现,肠癌组织中NOD2的阳性表达率显著高于正常肠黏膜组织,其阳性表达的强度也显著高于正常肠黏膜组织,提示NOD2的过度表达可能参与了肠癌的形成过程。推测NOD2呈现阳性表达或表达强度增强,预示该组织发生了癌变。本研究还发现,NOD2的阳性表达率在伴有或不伴有腹腔淋巴结转移者之间差异无统计学意义,提示它可能与癌组织的转移无关。相似的结果也见于魏柏等[14]的研究,他们发现,在慢性浅表性胃炎、慢性萎缩性胃炎、胃溃疡及胃腺癌中,NOD2表达率及表达强度逐渐升高,认为它的表达水平与病变严重程度似乎成“线性关系”,推测NOD2与胃癌的发生和发展存在联系,具有一定“早期事件”的意义,进一步提示NOD2与癌组织的形成有关。
TRAFs家族在机体的生理和病理过程中都起重要作用,介导自然免疫和获得性免疫,不仅是连接TNF受体超家族的信号传导通路,也是IL-1R/TLR超家族信号传导通路的重要成分。TRAF2几乎在所有组织中转录,是表达最广泛的TRAFs家族成员,它能与TNF受体家族中的大多数受体、IL-1受体、IL-17受体、类TOLL受体家族中的一些成员相互作用,还能直接与TNF家族中的一些不含死亡结构域的成员连接,而且能与细胞内蛋白(包括MAP3 K家族的蛋白酶)、NF-κB调控因子、抗凋亡因子等相互作用。它通过转录因子NF-κB和c-Jun诱导基因表达,对多种生理过程十分重要,如细胞生长和死亡、发育、癌基因的表达、免疫、感染等[15]。在不同的癌组织中,它起的作用不尽相同。在肺腺癌和多种肺癌细胞系中TRAF2呈现高表达,而在正常气道上皮细胞系中的表达却较低,它被认为是抗癌药物治疗和辐射致敏的有效靶位[16]。在喉鳞癌中,病理分级越高其阳性表达率也越高[17]。它还与乳腺癌的侵袭、转移有关,高转移乳腺癌细胞系中TRAF2的表达显著高于低转移细胞系[18]。
本研究发现,肠癌组织TRAF2的阳性表达率高于正常肠黏膜组织,其阳性表达的强度也显著高于正常肠黏膜组织,提示TRAF2的过度表达可能与结直肠癌的发生有关。本研究还发现,在伴有腹腔淋巴结转移的病例中,TRAF2的阳性表达率也高,提示它还可能与结直肠癌的转移相关。
本研究结果表明,NOD2和TRAF2在结直肠癌组织中表达增强,它们可能参与了结直肠癌的形成,TRAF2可能还与结直肠癌的转移有关,自然免疫在结直肠癌的形成中可能起了重要的作用。阻断NOD2和TRAF2的信号转导通路可能为结直肠癌的治疗提供新的靶点,其机制有待于进一步研究。
致谢:感谢台州市中心医院病理科范广民医师的技术帮助。
[1]Adebamowo CA,Akarolo-Anthony S.Cancer in Africa:opportuni⁃ties for collaborative research and training[J].Afr JMed Med Sci, 2009,38(2):5-13.
[2]Schreiber RD,Old LJ,Smyth MJ.Cancer immunoediting:integrat⁃ing immunity's roles in cancer suppression and promotion[J].Sci⁃ence,2011,331(6024):1565-1570.
[3]Charrière GM,Ip WE,Dejardin S,et al.Identification of Drosophi⁃la Yin and PEPT2 as evolutionarily conserved phagosome-associ⁃ated muramyl dipeptide transporters[J].J Biol Chem,2010,285 (26):20147-20154.
[4]李成荣.自身炎症性疾病[J].中华儿科杂志,2008,46(11):842-847.
[5]Panoulas VF,Smith JP,Nightingale P,et al.Association of the TRAF1/C5 locus with increased mortality,particularly from malig⁃nancy or sepsis,in patients with rheumatoid arthritis[J].Arthritis Rheum,2009,60(1):39-46.
[6]吴兴荣,骆利康,陈震宏,等.ER、PR、p53、C-erbB-2在乳腺囊性增生病中的表达意义 [J].中国中西医结合外科杂志,2009,15 (1):27-28.
[7]Opitz B,van Laak V,Eitel J,et al.Innate immune recognition in infectious and noninfectious diseases of the lung[J].Am JRespir Crit Care Med,2010,181(12):1294-1309.
[8]Hitotsumatsu O,Ahmad RC,Tavares R,et al.The ubiquitin-edit⁃ing enzyme A20 restricts nucleotide-binding oligomerization do⁃main containing 2-triggered signals[J].Immunity,2008,28(3): 381-390.
[9]胡巢凤,陆大祥.Toll样受体与核苷酸结合寡聚化结构域蛋白在防御反应中的相互作用 [J].生理科学进展,2006,37(3):233-235.
[10]曹清华,王缨,熊思东.NOD:一类新的固有免疫模式识别受体[J].生命的化学,2006,26(2):105-107.
[11]Cooney R,Baker J,Brain O,et al.NOD2 stimulation induces au⁃tophagy in dendritic cells influencing bacterial handling and anti⁃gen presentation[J].Nat Med,2010,16(1):90-97.
[12]Bhat M,Nguyen GC,Pare P,et al.Phenotypic and genotypic char⁃acteristics of inflammatory bowel disease in French Canadians com⁃parison with a large North American repository[J].Am JGastroen⁃terol,2009,104(9):2233-2240.
[13]Lacher M,Schroepf S,Ballauff A,et al.Autophagy 16-like 1 rs2241880 G allele is associated with Crohn's disease in German children[J].Acta Paediatr,2009,98(11):1835-1840.
[14]魏柏,朱尤庆,汤晓燕,等.胃癌及癌前病变组织中幽门螺杆菌感染与NOD2和TLR9蛋白表达的相关性[J].中华普通外科杂志,2008,23(11):866-868.
[15]Chen G,Goeddel DV.TNF-R1 signaling:a beautiful pathway[J]. Science,2002,296(5573):1634-1635.
[16]Zheng M,Morgan-Lappe SE,Yang J,et al.Growth inhibition and radiosensitization of glioblastoma and lung cancer cells by small in⁃terfering RNA silencing of tumor necrosis factor receptor-associat⁃ed factor 2[J].Cancer Res,2008,68(18):7570-7578.
[17]徐海洋,路秀英,马婧,等.肿瘤坏死因子受体及其信号转导蛋白TRAF2在喉癌中的表达[J].吉林大学学报(医学版),2006,32(2):322-325.
[18]王士娜,米小轶,刘楠,等.TRAF2在乳腺癌中的表达及与乳腺癌侵袭性的关系[J].中国医科大学学报,2008,37(5):676-678.
(收稿:2011-08-06 修回:2011-11-26)
(责任编辑 石承先)
Expression of Nucleotide Binding Oligomerization Domain Containing 2 and Tumor Necrosis Factor Re⁃ceptor Associated Factor 2 Protein in Colorectal Cancer
LUO Bin,WANG Shi-fu,YING Xiang-lan,et al. Department of Surgery,Taizhou Hospital of Integrated Traditional Chinese and Western Medicine,Taizhou,Zheji⁃ang(317523),China
Objective To approach the potential roles of innate immunity in the pathogenesis of develop⁃ment and metastasis of colorectal cancer,the expression levels of nucleotide binding oligomerization domain con⁃taining 2(NOD2)and tumor necrosis factor receptor associated factor 2(TRAF2)protein in colorectal cancer. Methods Tissues from thirty-one patients with colorectal cancer(colorectal cancer group)and their adjacent normal colorectal mucous membrane(control group)were obtained.The expression levels of NOD2 and TRAF2 protein in tissues of both groups were detected by immunohistochemical methods. Results The positive ex⁃pression rates of NOD2 and TRAF2 in colorectal cancer group(61%;68%,respectively)were significantly high⁃er than those in control group(32%and 35%,respectively)(allP<0.05).Dramatically,their optical density lev⁃els in colorectal cancer group(0.186±0.034 and 0.232±0.041,respectively)were significantly higher than those in control group either(0.151±0.023 and 0.148±0.035,respectively)(allP<0.01).Furthermore,The positive ex⁃pression rates of TRAF2(75%)in 20 patients with colorectal cancer involved celiac lymph nodes were significant⁃ly higher than those with non-involved(55%)(P<0.05).But there were nosignificance of positive expression rates of NOD2 between them(70%and45%,respectively)(P>0.05).Conclusion Expression levels of NOD2 and TRAF2 protein increase in colorectal cancer,showing a possible pathogenesis in the development of colorec⁃tal cancer.TRAF2 may be associated with colorectal cancer metastasis.Innate immunity may play an important role in the development of colorectal cancer.
Colorectal cancer,Nucleotide binding oligomerization domain containing,Tumor necrosis fac⁃tor receptor associated factor,Lymphatic metastasis,Immunohistochemistry
R735.3+5
A
1007-6948(2012)01-0030-04
10.3969/j.issn.1007-6948.2012.01.009
1.浙江省台州市中西医结合医院外科(台州 317523)
2.浙江省台州市肿瘤医院病理科
3.浙江省台州市中西医结合医院病理科
罗 斌,E-mail:luobinzg@163.com
