呋塞米注射液的制备工艺研究
2011-09-28曲建文刘建明李树波杨会元
曲建文,刘建明,李树波,杨会元,申 琳
(吉林省集安益盛药业股份有限公司,吉林 集安 134200)
呋塞米注射液的制备工艺研究
曲建文,刘建明,李树波,杨会元,申 琳
(吉林省集安益盛药业股份有限公司,吉林 集安 134200)
目的 优化呋塞米注射液的处方与制备工艺。方法 考察呋塞米注射液的性状、pH以及有关物质。结果 获得了优选的呋塞米注射液的处方与制备工艺。结论 筛选得到的呋塞米注射液处方合理,制备工艺可行,质量可控,适用于工业化大生产。
呋塞米注射液;制备;处方
呋塞米又名速尿,为强效利尿剂,用于治疗水肿性疾病、高血压、高钾血症及高钙血症、稀释性低钠血症、抗利尿激素分泌过多症和急性药物毒物中毒等,能预防急性肾功能衰竭。呋塞米注射液收载于2005年版和2010年版《中国药典(二部)》[1],为呋塞米加氢氧化钠与氯化钠制成的灭菌水溶液,2010年版(《中国药典(二部)》)质量标准中增加了有关物质检查,用高效液相色谱法代替了紫外分光光度法测定含量[2]。我公司参照文献 [3]的处方进行了呋塞米注射液小试。处方为呋塞米100 g(按100%投料),10%氢氧化钠150 mL,氯化钠75 g,1 mol/L盐酸适量,甲醛合次硫酸氢钠10 g,注射用水加至10 000 mL。按2010年版《中国药典(二部)》中呋塞米注射液项下有关物质测定方法[2]操作,小试样品在0 d时最大杂质已超过标准要求的1.5%,杂质总和超过了3.0%,且随着贮存时间的增加,有关物质有不断增加的趋势。针对有关物质超标、灭菌条件不符合规定的问题,为了保证产品质量,笔者对呋噻米注射液处方及制备工艺进行了优化,报道如下。
1 仪器与试药
Agilent 1200型高效液相色谱仪;BT 125D型十万分之一天平;G1314 B型紫外检测器。呋塞米(常州亚邦制药有限公司,批号为MN090605);呋塞米对照品(中国药品生物制品检定所,批号为100544-200501);氢氧化钠(成都华邑药用辅料制造有限责任公司);氯化钠(天津海光药业有限公司);甲醛合次硫酸氢钠(北京市旭东化工厂);无水亚硫酸钠(湖南尔康制药有限公司);活性炭(上海活性炭厂)。
2 方法与结果
2.1 处方研究
抗氧剂筛选分为空白对照组、加入甲醛合次硫酸氢钠组、加入无水亚硫酸钠组进行试验。按2010年版《中国药典(二部)》中呋塞米注射液项下有关物质测定方法[2]操作,检测结果见图1及表1。可知,产生的杂质与加入的抗氧剂种类有关,不同抗氧剂产生的杂质不同。两种加入抗氧剂的供试品溶液有关物质均有所增加,不加抗氧剂的供试品溶液中有关物质无变化。因此本处方不应添加抗氧剂。

图1高效液相色谱图
2.2 制备工艺研究
2.2.1 渗透压试验
本品中氯化钠为渗透压调节剂,应考察渗透压摩尔浓度以确定处方中氯化钠的用量。正常人体血液的渗透压摩尔浓度范围为285~310 mOsmol/kg[1]。照 2010 年版《中国药典(二部)》附录ⅨG渗透压摩尔浓度测定法,加入不同量的氯化钠,考察渗透压摩尔浓度。结果每 100 mL 中氯化钠加入量为 0.85,0.80,0.75,0.70,0.65 g时呋塞米溶液渗透压分别为 328,320,305,289,273 mOsm/kg。因此,确定本处方每1 000 mL呋塞米注射液中氯化钠的用量为7.5 g。
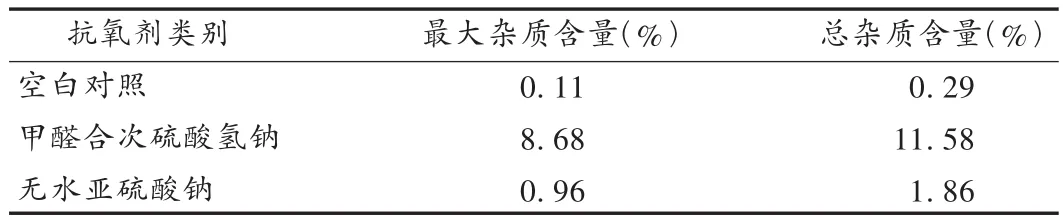
表1 抗氧化试验结果
2.2.2 活性炭用量考察
活性炭在注射制剂的制备中常用于吸附杂质、除去热原、增加药液的澄明度。配制呋塞米注射液,平均分成4份,分别加不同量的活性炭,吸附后脱炭,考察其对主药含量的影响。结果见表2。结果表明,可采用0.05%的活性炭吸附30 min,脱炭。
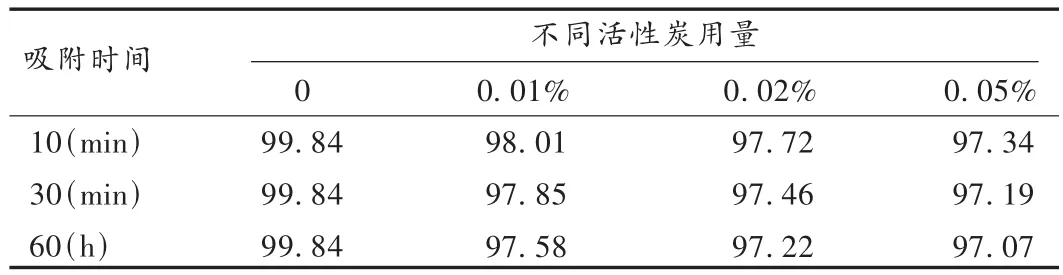
表2 不同量活性炭的吸附效果(%)
2.2.3 灭菌条件选择
灭菌是注射液制备过程中不可缺少的环节,既要保证灭菌效果,又要保证药物质量的稳定性。取呋塞米注射液,选择3种灭菌条件分别进行试验,检测灭菌后该注射剂的pH、主药含量、有关物质。结果见表3。因此,选择灭菌条件为121℃、热压灭菌15 min。
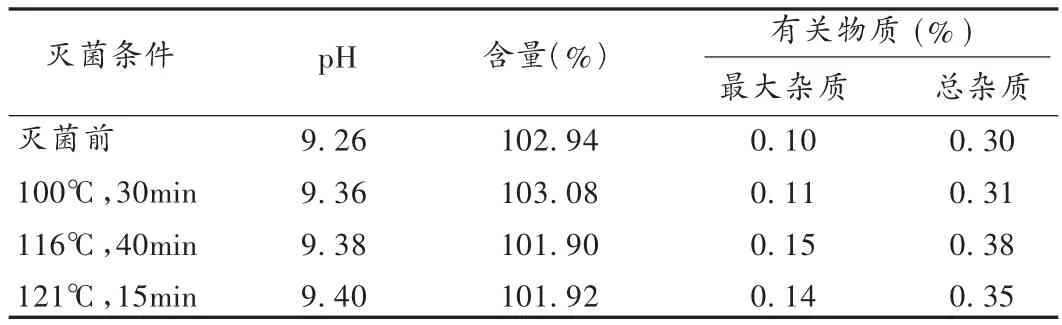
表3 灭菌条件的选择
2.2.4 优化生产工艺确定
取处方量80%的注射用水,加处方量的呋塞米充分搅拌,用10%氢氧化钠溶液调pH为9.0~9.4,检测中间体含量,补水;加入配液量的氯化钠,充分搅拌;加0.05%的针用活性炭,充分搅拌吸附30 min,脱炭。经0.22 μm微孔滤膜精滤至澄明度合格后,通氮气灌入2 mL安瓿中,熔封。121℃热压灭菌15 min,即得。
2.3 影响因素试验
按初步确定的处方配制呋塞米注射液,进行影响因素试验,验证该注射剂的处方合理性。将上述合格注射液置高温(60℃)、强光(4 500 lx±500 lx)条件下,分别于0,5,10 d时取样,考察该注射剂的外观性状、pH、主药含量、有关物质、可见异物。结果见表4。可见,该注射液在光照条件下不稳定,溶液颜色变黄、pH下降、有关物质超标、主药含量下降,严重影响产品质量;在高温条件下稳定,外观、性状、pH、有关物质、含量均无明显变化。

表4 影响因素试验结果
根据影响因素试验结果,本制剂处方合理、生产工艺可行。可采用低硼硅玻璃安瓿为直接接触药品的包装容器。本制剂的保存条件为避光、密闭保存;并且,在制剂生产过程中尽量避光。
3 讨论
通过改变处方附加剂,以性状、pH、含量及有关物质为指标,对处方中的每个因素以及不同生产工艺进行考察,获得了优选的处方和生产工艺。按照优选处方和生产工艺生产的产品质量可靠,达到质量标准要求,工艺稳定,证明通过研究获得的处方和生产工艺适用于工业化大生产。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:244.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:336.
[3]顾学裘.药物制剂注解[M].北京:人民卫生出版社,1983:172-173.
TQ460.6;R983+.1
A
1006-4931(2011)06-0050-02
2010-06-03)
曲建文(1973-),女,中级中药师,本科,研究方向为药物研发,(电子信箱)qjw_73@163.com
