奥美拉唑钠在木糖醇注射液中的稳定性考察
2011-09-28李文兵李智勇
李文兵,李智勇,李 清
(1.广东省第二中医院,广东 广州 510095; 2.广东省中医研究所,广东 广州 510095;3.中山大学附属第三医院,广东 广州 510630)
奥美拉唑钠在木糖醇注射液中的稳定性考察
李文兵1,李智勇2,李 清3
(1.广东省第二中医院,广东 广州 510095; 2.广东省中医研究所,广东 广州 510095;3.中山大学附属第三医院,广东 广州 510630)
目的 考察注射用奥美拉唑钠与木糖醇注射液配伍后的稳定性。方法 用高效液相色谱法考察配伍前后奥美拉唑钠的含量变化,并观察配伍液的外观及pH变化。结果 注射用奥美拉唑钠与木糖醇注射液配伍后4 h内含量、pH及溶液外观均无明显变化。结论 注射用奥美拉唑钠与木糖醇注射液配伍后4 h内稳定。
奥美拉唑钠;高效液相色谱法;木糖醇;配伍;稳定性
奥美拉唑的化学名为5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-戊吡啶基)-甲基]-亚磺酰基}-1H-苯并咪唑。奥美拉唑钠(omeprazole sodium)作为一种选择性抑制胃壁细胞H+-K+-ATP酶质子泵的抗消化性溃疡药物,常用于治疗上消化道出血性疾病[1]。木糖醇注射液能补充热量,改善糖代谢,在体内代谢不依赖胰岛素的参与,直接透过细胞膜参与代谢而不增加血糖浓度,产热量与葡萄糖相仿,可作为糖尿病患者的糖代用品[2]。至于奥美拉唑能否与木糖醇注射液配伍静脉滴注治疗糖尿病患者并发上消化道出血,笔者未查到相关报道,故本试验考察注射用奥美拉唑钠和木糖醇注射液配伍的稳定性,旨在为临床安全用药提供科学依据。
1 仪器与试药
Agilent 1100型高效液相色谱仪,包括DAD检测器、四元梯度泵、G2170AA型数据处理软件系统(美国Agilent公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);BP-211D型电子分析天平(德国Sartorius);Seveneasy-酸度计。奥美拉唑钠对照品(海南灵康制药有限公司,纯度为99.8%);注射用奥美拉唑钠(海南灵康制药有限公司,批号为091003,规格为40 mg/瓶);5%木糖醇注射液(回音必集团东亚制药有限公司,批号为2009122015,规格为250 mL);甲醇(色谱纯,邯郸市林峰精细化工有限公司),其他试剂(分析纯),重蒸馏水。
2 方法与结果
2.1 供试品溶液制备
模拟临床用药浓度(约相当于奥美拉唑钠40 mg),以5%木糖醇注射液为溶剂,用10 mL一次性注射器将适量5%木搪醇注射液推入1瓶注射用奥美拉唑钠中,摇匀,待完全溶解后,将药液全部注入250 mL量瓶中,在不避光条件下,加入5%木糖醇注射液至刻度,摇匀,精密量取2 mL溶液,置20 mL量瓶中,加入5%木糖醇注射液至刻度,摇匀即得。
2.2 含量测定
2.2.1 色谱条件
色谱柱:Kromasil C18柱(250 mm ×4.6 mm,5 μm);流动相:甲醇-pH=7.6的磷酸盐缓冲液(75∶25);流速 1.0 mL/min;检测波长:304 nm;进样量:20 μL。
2.2.2 测定方法
取奥美拉唑对照品适量,精密称定,用5%木糖醇注射液溶解并配制成20 μg/mL的对照品溶液。分别取2.1项下供试品溶液及对照品溶液各20 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算奥美拉唑的含量。色谱见图1。
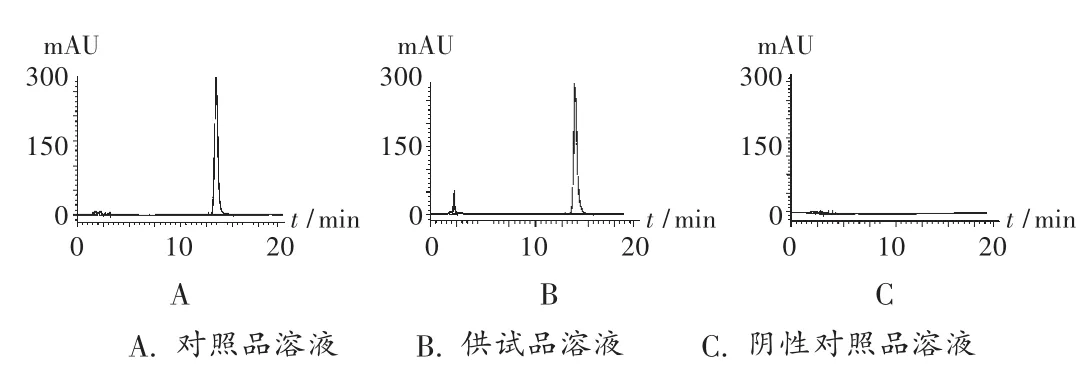
图1 含量测定高效液相色谱图
2.2.3 方法学考察
系统适用性试验:取2.1项下供试品溶液及对照品溶液、阴性对照品溶液(5%木糖醇注射液),依法进样。色谱图见图1,理论板数按奥美拉唑峰计不少于2 000。
破坏试验:取奥美拉唑对照品适量,置试管中,分别进行酸破坏试验(加0.1 mol/L盐酸溶液适量,3 min后用流动相稀释)、碱破坏试验(加0.1 mol/L氢氧化钠适量,1 h后用流动相稀释)、高温破坏试验(加热至药物部分融化变色,用少量甲醇溶解,并用适量流动相稀释)、氧化破坏试验(加适量的30%过氧化氢,室温下1 h后取适量,以流动相稀释)、光破坏试验(紫外灯照射48 h,加少量甲醇使溶解,用适量流动相稀释),取上述溶液过滤,依法进样测定。色谱见图2,可见图中各杂质峰与主峰均能很好分离。

图2 破坏试验高效液相色谱图
线性关系考察:取奥美拉唑对照品,用5%木糖醇注射液溶解,制成200 μg/mL的奥美拉唑对照品溶液。精密量取此溶液0.5,1.0,1.5,2.0,2.5 mL,分别置 10 mL 量瓶中,用 5% 木糖醇注射液稀释至刻度,摇匀。精密量取上述系列溶液各20 μL,进样分析。以峰面积对质量浓度进行线性回归,得回归方程 Y=1.216 32 X+0.315 65,r=0.999 8(n=5)。结果表明奥美拉唑质量浓度在 10 ~50 μg/mL范围内与峰面积线性关系良好。
精密度试验:取质量浓度为20 μg/mL的奥美拉唑对照品溶液,连续进样6次。结果峰面积的 RSD为0.32%(n=6),表明方法精密度良好。
重复性试验:取同一批样品5份,分别依法制备供试品溶液,测定峰面积并计算含量。结果奥美拉唑钠平均含量的 RSD为0.96%(n=5),表明方法重复性良好。
稳定性试验:取质量浓度为20 μg/mL的奥美拉唑对照品溶液,室温下分别于 0,1,2,3,4 h时测定。结果峰面积的 RSD为0.25%(n=5),表明在室温下奥美拉唑对照品溶液在4 h内稳定。
加样回收试验:取已知含量的样品(批号为091003)9份,分别精密加入一定量的奥美拉唑对照品,按2.1项下供试品溶液制备方法制备溶液,依法测定含量,计算回收率。结果见表1。
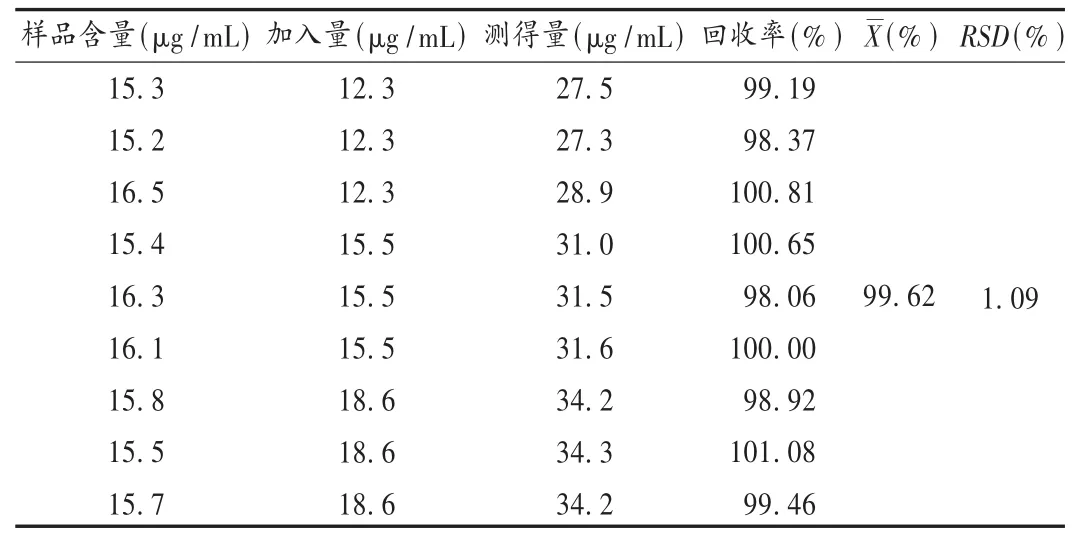
表1 奥美拉唑钠加样回收试验结果(n=9)
2.3 配伍稳定性考察
按 2.1项下方法制备配伍液,于配制后0,1,2,3,4 h 时分别精密量取20 μL,注入高效液相色谱仪,依法测定峰面积,按外标法计算样品含量;同时测定各时间点配伍液的pH,观察配伍液的外观。结果见表2。
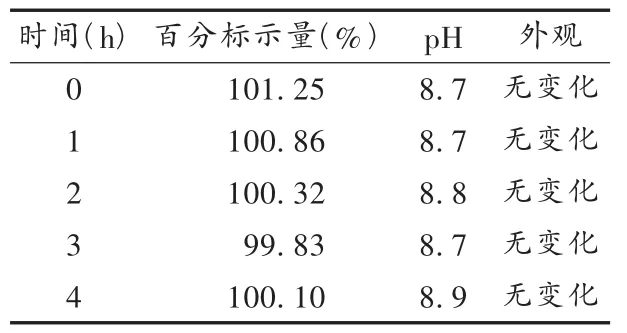
表2 配伍液含量、pH、外观考察结果
3 讨论
木糖醇注射液在200~400 nm波长范围内没有紫外吸收,故在304 nm波长处测定含量时木糖醇没有干扰。笔者对奥美拉唑供试品溶液和对照品溶液所做的检测表明,色谱峰纯度满足检测要求。用甲醇-水作流动相,理论板数太低,故改用甲醇-磷酸盐缓冲液。当甲醇-磷酸盐缓冲液的比例为75∶25时,分离效果理想,结果比较满意。
木糖醇注射液在临床上可广泛用于高血糖、高血酯及酮血症患者,静脉滴注木糖醇不会引起血、尿糖升高[3]。奥美拉唑钠作为新型质子泵抑制剂,与0.9%氯化钠注射液、5%碳酸氢钠注射液等配伍的稳定性国内已有报道[4],但与5%木糖醇注射液配伍的稳定性目前国内外尚无报道。本试验结果表明,注射用奥美拉唑钠与5%木糖醇注射液配伍,4 h内主药含量、pH、配伍液外观基本无变化。可见,对于合并上消化道出血、胃十二指肠溃疡的糖尿病患者,注射用奥美拉唑钠加5%木糖醇注射液不失为一个好的选择。
[1]符智深,陈桂香,陈海英,等.奥美拉唑持续静滴治疗上消化道大出血的疗效观察[J].中国误诊学杂志,2007,7(21):4 973.
[2]陈新谦,金有豫,汤 光.新编药物学[M].第15版.北京:人民卫生出版社,2003:660.
[3]冯根宝,王竹兰.木糖醇治疗非胰岛素依赖型糖尿病121例[J].天津医药,1995,23(8):476-479.
[4]孙佩芳,夏卫华,王建民,等.注射用奥美拉唑与70种针剂配伍结果[J].数理医药学杂志,2001,14(2):137-138.
Study on Compatible Stability of Omeprazole in Xylitol Injection
Li Wenbing1, Li Zhiyong2, Li Qing3
(1.Guangdong Provincial Second Hospital of TCM,Guangzhou,Guangdong,China 510095; 2.Guangdong Research Institute of TCM,Guangzhou,Guangdong,China 510095; 3.Third Affiliated Hospital,Sun Yat-sen University,Guangzhou,Guangdong,China 510630)
Objective To investigate the compatible stability of Omeprazole Sodium for Injection in Xylitol Injection.Methods The variance of omeprazole sodium content in Xylitol Injection was determined by HPLC within 4 h.Meanwhile,the appearance and pH value change of compatible solution were observed.Results The appearance,pH value and content of Omeprazole Sodium for Injection in Xylitol Injection within 4 h were not found obvious variations.Conclusion Omeprazole Sodium for Injection can be used in compatibility with Xylitol Injection for 4 hours.
omeprazole sodium;HPLC;xylitol;compatible;stability
R969.2;R975+.6;R977.7
A
1006-4931(2011)06-0028-03
2010-05-27;
2010-08-21)
