过度训练及补充二联甲苯或谷氨酰胺对大鼠腹膜巨噬细胞活性氧和诱导型一氧化氮合酶的影响
2011-09-28肖卫华陈佩杰董静梅
肖卫华,陈佩杰,王 茹,董静梅
过度训练及补充二联甲苯或谷氨酰胺对大鼠腹膜巨噬细胞活性氧和诱导型一氧化氮合酶的影响
肖卫华1,2,陈佩杰1,王 茹1,董静梅1
巨噬细胞广泛分布于肝脏、肺、腹膜、脂肪组织、血液、骨骼和肌肉等机体多个组织和器官。它是机体抵抗病原微生物入侵的第一道防线,可通过“呼吸爆发”形式,即:在病原体刺激时由NADPH氧化酶介导产生大量活性氧(reactive oxygen species,ROS),杀灭入侵的病原微生物,这是巨噬细胞杀菌的主要机制,在病菌防御中发挥重要作用[15]。ROS过量生成可导致细胞损伤,诱导凋亡,但巨噬细胞内生理水平 ROS有重要功能,它是促进巨噬细胞存活和诱导巨噬细胞分化的重要信号分子[17,26]。最新研究成果表明,巨噬细胞与肥胖、动脉粥样硬化等多种疾病密切相关,巨噬细胞可浸润脂肪组织、动脉粥样硬化斑块等处,提高氧化应激水平,释放炎性因子,导致机体的慢性炎症反应,有氧运动则有助于改善上述疾病症状,运动的主要效应在于降低脂肪组织和动脉粥样硬化斑块处氧化应激水平和炎症水平,从而使症状得以缓解[7,13,27],这一过程可能与NO的抗氧化效应密切相关[3]。
研究表明,抗氧化剂二联甲苯(DPI)可特异性抑制NADPH氧化酶活性从而降低ROS生成[8],营养素谷氨酰胺(Gln)则有利于提高免疫细胞活性[12],但过度训练及补充DPI或 Gln是否影响巨噬细胞 ROS生成,未见相关报道。ROS与NO的关系是一个有争议的问题,有人认为ROS生成增加可减少NO产量[24],也有人认为NO生成增加可降低氧化应激水平[4]。过度训练引起巨噬细胞ROS改变过程中NO是否发挥作用仍不得而知。因此,本研究通过建立过度训练模型,观察 ROS及诱导型一氧化氮合酶(iNOS,催化合成NO的酶)的变化,以了解过度训练对巨噬细胞ROS的影响、补充抗氧化剂和营养素能否改善过度训练效应,以及过度训练发生时巨噬细胞内 ROS与NO的相互关系。
1 材料与方法
1.1 实验动物及分组
8周龄健康雄性wistar大鼠56只,体重180±10 g,购于上海实验动物中心。动物饲养环境温度为22℃±2℃,相对湿度50%~70%,每天光照时间为12 h,自由饮食。将大鼠随机分为安静对照组(C)、过度训练组(E)、过度训练补充DPI组(ED)、过度训练补充谷氨酰胺组(EG)。后3组根据取材时间不同分为2组,运动后36h取材组(E1、ED1、EG1),运动后 7 天取材组 (E2、ED2、EG2)。总计 7组,每组8只。
1.2 过度训练方案及给药方案
动物适应性饲养1周后,E、ED、EG组开始进行递增负荷跑台训练,每周5次,周二、周六休息,共训练11周。过度训练方案参考文献方法[5](表1)。
ED组腹腔注射DPI:第5周开始至第8周每天 1次(0.1 mg/kg),第9周每天1次(0.2 mg/kg),第10周每天2次(0.2 mg/kg),第11周每天 2次(0.3 mg/kg)。
EG组补充 Gln:第 5周至第 8周灌胃(0.8 g/kg/day),以后几周加至饮用水,剂量逐周加大到1.1 g/kg/day。
1.3 腹膜巨噬细胞分离与纯化
常规方法,腹腔灌洗液分离,贴壁培养2 h纯化,重悬细胞后用细胞计数板计数并调细胞浓度至107个/ml备用。
1.4 活性氧的测定
取100μl上述细胞悬液(106个细胞),按活性氧测定试剂盒 (上海杰美基因科技有限公司)说明书,用流式细胞仪(Bechman Coulter Epics XL)检测30 000个以上细胞,测定平均荧光强度。
1.5 RNA抽提与cDNA合成
取上述剩余的细胞悬液,离心去上清收集细胞。使用异硫氢酸胍-氯仿经典法抽提总 RNA。按 Fermentas公司第一链cDNA合成试剂盒说明,在 Eppendorf梯度PCR仪进行反转录,20μl体系,合成的 cDNA储存在 -20℃备用。
作者单位:1.上海体育学院运动科学学院,上海200438;2.湘南学院体育系,湖南郴州423000
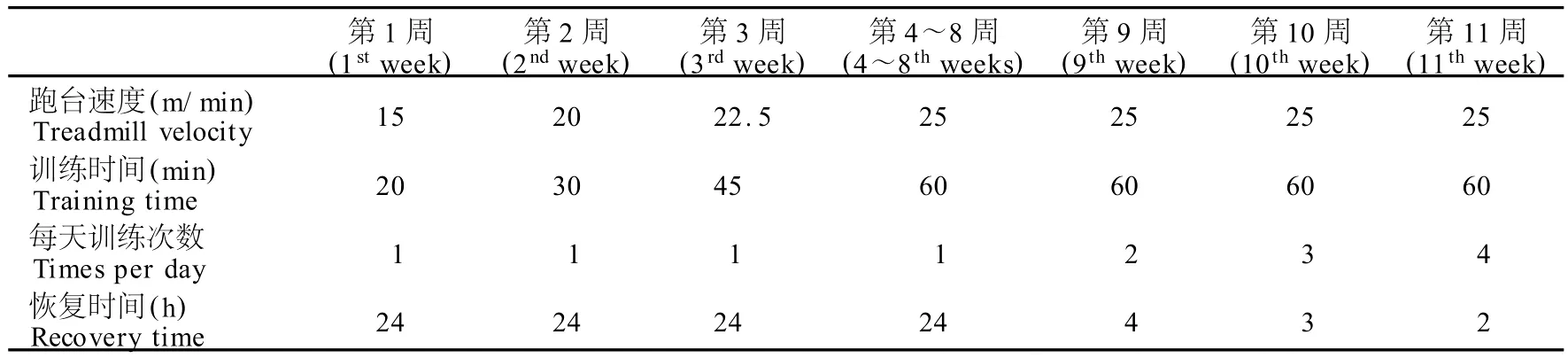
表1 本研究大鼠过度训练方案一览表Table 1 Overtraining Protocol of Rat
1.6 荧光定量PCR
设计目的基因诱导型一氧化氮合酶(iNOS)(AY211532.1)和内参β-actin荧光定量引物(上海生工生物工程技术服务有限公司合成)。iNOS:Forward-ctc act gtg gct gtg gtc acc ta,Reverse-ggg tct tcg ggc ttc agg tta,产物 101 bp。β-actin:Forward-gga gat tac tgc cct ggc tcc ta,Reverse-gac tca tcg tac tcc tgc ttg ctg,产物 150 bp。使用RG3000型定量 PCR仪进行双标曲法相对定量 PCR(SY BR Green试剂盒购自 Fermentas公司)。iNOS基因在1~104 U(units)范围内,检测阈值(CT)与拷贝数对数呈线性关系,两者相关系数 r2>0.99(图1)。熔解曲线分析显示:iNOS呈单一产物峰(图2),PCR产物电泳只见101 bp处单一条带。

图1 本研究iNOS标准曲线图Figure 1. iNOS Standard Curve
1.7 统计方法
实验数据由SPSS 17.0统计软件处理,单因素方差分析和相关分析,结果以平均值±标准差表示,统计学显著性水平定为0.05,非常显著性水平定为0.01。
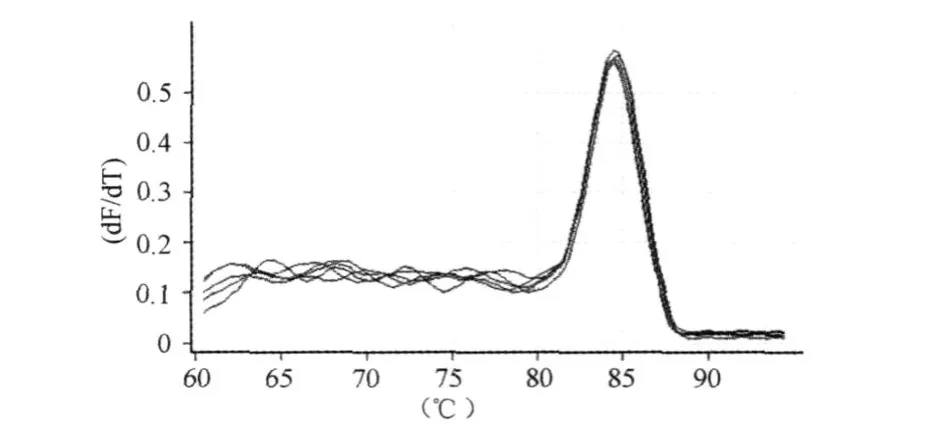
图2 本研究iNOS熔解曲线图Figure 2. iNOS Melt Curve
2 结果
2.1 活性氧生成量
各组ROS生成量见表2。运动后36 h取材组中,E1组ROS生成量显著低于C组(P<0.05);ED1组与 E1组相比ROS生成量显著降低(P<0.05),与C组相比极显著降低(P<0.01);EG1组与 E1组相比没有显著差异(P>0.05),与C组相比极显著降低(P<0.01)。运动后第7天取材组中,E2组、ED2组分别与 E1组、ED1组相比,ROS生成量极显著增加(P<0.01);EG2组与 EG1组相比ROS生成量显著增加(P<0.05);E2组、ED2组、EG2组、C组4组之间比较无显著差异(图3)。

表2 本研究各组活性氧生成量一览表Table 2 The Production of ROS

图3 本研究 ROS生成量示意图Figure 3. The Production of ROS
2.2 诱导型一氧化氮合酶mRNA表达
运动后36 h取材组中,与 C组相比,E1组iNOS mRNA表达增加,但无统计学差异(P>0.05);ED1组相对E1组显著增加(P<0.05),相对C组极显著增加(P<0.01);EG1组与 E1组、C组相比无显著差异。运动后第7天取材组中,E2组、EG2组分别与 E1组、EG1组相比无显著差异,ED2组相对 ED1组显著降低(P<0.05)。E2组、ED2组、EG2组、C组4组之间比较无显著差异。
2.3 ROS与iNOS相互关系
对巨噬细胞内ROS与iNOS mRNA表达量进行相关分析,结果显示,二者呈直线负相关,相关系数 r=-0.45(P=0.004)。
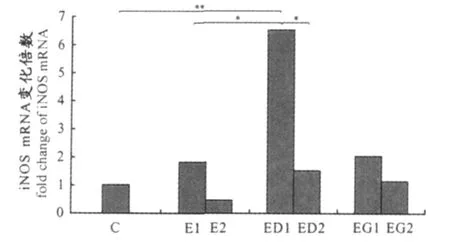
图4 本研究iNOS mRNA表达量示意图Figure 4. The mRNA level of iNOS
以各组ROS和iNOS表达量相对C组的倍比关系作折线图,发现ROS生成量较高时,iNOS mRNA表达处于较低水平(E2组);而随着iNOS mRNA表达水平增加,ROS生成量呈现降低趋势(图5)。
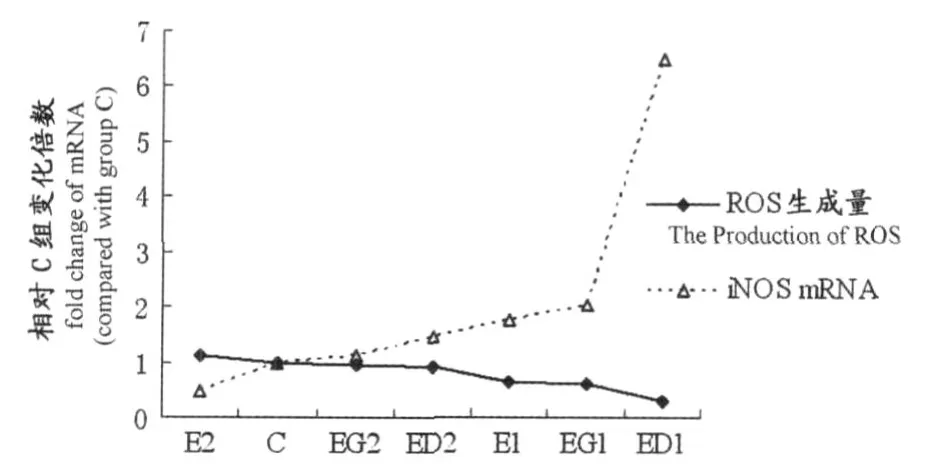
图5 本研究巨噬细胞内 ROS与iNOS mRNA相互关系图Figure 5. Relationship betw een ROS and iNOS of macrophage
3 讨论
一般认为,ROS过量生成可通过间接损伤DNA、类脂和蛋白,或直接通过 ROS介导激活相关信号途径来诱导细胞凋亡[6]。组织或器官中ROS含量异常增加表示机体氧化应激水平提高,是一种负向效应,动脉粥样硬化、肥胖、糖尿病、高血压等常见疾病的发生发展都与ROS有密切的联系[11,21-23]。而生理水平的ROS对巨噬细胞功能的维持是非常重要的,ROS能诱导蛋白激酶B激活,促进巨噬细胞存活,同时ROS也是一种重要的胞内信号介质,在介导巨噬细胞分化过程中发挥关键作用。此外,ROS还能调控巨噬细胞炎性因子分泌,即生理水平 ROS对调控巨噬细胞存活、分化、炎性因子分泌等都有重要作用[17,26]。
从理论上推测,运动应能增加机体氧化应激水平,从而提高ROS生成。但是本研究发现,过度训练使巨噬细胞ROS生成量降低,显著低于生理水平(P<0.05,图3),势必对ROS介导的生理功能造成负面影响,这可能是高频率大强度反复运动应激使机体处于免疫抑制的表现。停训1周后,过度训练组巨噬细胞内ROS水平恢复到安静组水平。
过度训练补充抗氧化剂DPI使ROS生成量进一步降低,显著低于过度训练组(P<0.05),且与安静对照组相比极显著降低(P<0.01,图3),表明过度训练时应用DPI会使ROS生成受抑状况进一步恶化,不利其行使正常生理功能。这与DPI抑制巨噬细胞ROS生成的文献报道是一致的[8]。停训1周后,过度训练补充DPI组巨噬细胞内ROS生成量也恢复至正常水平。
谷氨酰胺是巨噬细胞重要的能量来源,运动时补充谷氨酰胺是否能带来好的效应,仍是一个有争议的问题[18]。本研究发现,过度训练补充谷氨酰胺时 ROS生成量与过度训练组相比,没有显著差异(E1:179.10±29.10;EG1:172.58±49.62),与安静对照相比极显著降低(P<0.01),表明过度训练时补充谷氨酰胺并不能改变因过度训练引起的ROS生成受抑,对巨噬细胞内ROS介导的生理功能无改善作用。停训1周后,过度训练补充谷氨酰胺组巨噬细胞内ROS恢复到安静组水平。但另有研究报道,大鼠以85%˙VO2max强度进行1 h跑台运动对嗜中性粒细胞ROS生成无影响,而运动并补充谷氨酰胺时 ROS生成增多[10]。这可能与运动强度、持续时间及细胞类型不同有关。
诱导型一氧化氮合酶(iNOS)催化产生的NO与 ROS的关系也是个存在许多争论的问题。纵观现有研究发现,ROS与NO彼此消长关系存在于多种模式中,如糖尿病患者NADPH氧化酶激活引起过量 ROS生成,可导致eNOS解构,引起NO生成减少和内皮依赖性血管舒张功能降低[24]。用一氧化氮合酶抑制剂(l-NAME)处理4周模拟ED患者,可使大鼠海绵体中亚硝酸盐/硝酸盐水平(NO含量)降低、介导 ROS生成的 NADPH氧化酶催化亚基gp91phox表达增加近2倍,而运动可逆转 NO水平降低,使gp91phox亚基表达恢复至基础水平[1]。此外,急性运动可通过NADPH氧化酶抑制机制来提高不常活动者内皮祖细胞集落形成单位中NO水平,离体时NADPH氧化酶抑制剂夹竹桃麻素(apocynin)可抑制NADPH氧化酶活性,减少 ROS生成,使内源性 NO生成增多[19]。但也有人不支持 NO与 ROS的这种相互消长关系。Zhao等[28]于2010年发表了一篇文章,他以小鼠 RAW264.7巨噬细胞为研究对象,用脂多糖LPS先活化iNOS,然后用 PMA刺激巨噬细胞 ROS生成,观察到 ROS生成量及 NADPH氧化酶亚基p47phox(介导 ROS生成的关键成分之一)磷酸化要强于不用LPS预激活组,从而得出了诱导iNOS表达可提高PMA刺激时ROS产量这一结论。但该实验设计存在不足,因为用LPS预处理,即可使巨噬细胞 NADPH氧化酶活化,ROS产量大幅增加[8],此时再用 PMA刺激巨噬细胞已无法确定哪种刺激剂在活化巨噬细胞时占主导地位。
在本研究中,腹膜巨噬细胞内iNOS与 ROS也存在这种消长关系。对各组巨噬细胞内 ROS与iNOS mRNA表达量进行相关分析,结果显示,二者呈直线负相关,相关系数 r=-0.45(P=0.004)。以各组 ROS和iNOS表达量相对C组的倍比关系作图(图5),发现 ROS生成量较高时,iNOS mRNA表达处于较低水平(E2组);而随着iNOS mRNA表达水平增加,ROS生成量呈现降低趋势,且这种趋势在ED1组最为明显,ED1组iNOS mRNA表达量是C组的6.3倍,而 ROS生成量显著降低(P<0.01),只有 C组的28.6%。虽然有人报道离体时DPI对某些细胞NOS活性起一定的抑制作用[14],但DPI的这种抑制作用可被NADPH、NADP+和 2’5’-ADP 阻断[2]。此外 ,运动状态下机体生理功能发生深刻变化,释放多种激素以适应运动的需要,因此,运动时补充DPI的效应与离体时不一定完全一致(但抑制ROS生成效应与离体时相似,图3)。本研究结果表明,iNOS表达增强,可促进 NO产生,从而在降低ROS生成中发挥一定作用。有较多证据支持这一推测,如大鼠支气管肺泡灌洗液细胞(主要是巨噬细胞)进行NO暴露(十万分之一NO浓度),在用酵母多糖刺激时,NO暴露过的细胞超氧自由基释放能力显著受损[20];培养的人微血管内皮细胞用NO供体(DETA-NONOate)处理0.5~24 h,DETA-NONOate(10~300μmol/L)可显著抑制内皮细胞中过氧化氢的生成,呈浓度和时间依赖性,且NO抑制过氧化氢生成效应不依赖于降低NADPH氧化酶亚基表达,也不依赖于NADPH氧化酶亚基的解离,而是通过使p47phox亚基S-亚硝基化来实现[25]。除外源性 NO可抑制巨噬细胞 ROS生成外,内源性一氧化氮合酶活性增加也可降低ROS生成:如LPS刺激巨噬细胞时,类胡萝卜素和叶黄素可通过提高iNOS等酶的活性来减少 H2O2积聚[9];运动可诱导糖尿病大鼠二聚体型eNOS增加,使NO生成增多,ROS生成减少,从而减少糖尿病相关的氧化应激,使糖尿病相关并发症减少[4];规律性有氧运动可使老年大鼠血管中eNOS表达和活性增高,减少NADPH氧化酶的表达和活化,从而降低氧化损伤[3]。此外,用一氧化氮合酶抑制剂抑制iNOS活性使NO产生减少,可增加LPS刺激时O-2生成量[16]。虽然iNOS表达受 ROS-NF-κb等信号途径的调控[14],但iNOS催化产生的 NO也可作用于ROS生成,二者相互作用已被大量实验所证明。因此,本实验中过度训练及补充DPI或谷氨酰胺影响巨噬细胞ROS产生过程中,iNOS催化产生的NO可能起一定的调控作用。
4 结论
过度训练使腹膜巨噬细胞ROS生成量显著低于生理水平,引起运动性免疫抑制;补充抗氧化剂DPI可使过度训练时巨噬细胞内ROS生成量进一步降低,补充谷氨酰胺对过度训练引起的巨噬细胞ROS生成量降低没有改善作用;过度训练及补充DPI或谷氨酰胺可影响巨噬细胞内ROS生成,这在一定程度上受iNOS催化产生的NO调控。
[1]CLAUDINO M A,FRANCO-PENTEADO C F,PRIVIERO F B,et al.Upregulation of gp91phox subunit of NAD(P)H oxidase contributes to erectile dysfunction caused by long-term nitric oxide inhibition in rats:reversion by regular physical training[J].Urology,2010,75(4):961-967.
[2]DENNIS J S,OLUFUNMILAYO A F,NYOUN S K,et al.Inhibition of macrophage and endothelial cell nitric oxide synthase by diphenyleneiodonium and its analogs[J].J FASEB,1991,5:98-103.
[3]DOUGLAS R S,ASHLEY E W,GARY L P,et al.Habitual exercise and vascular ageing[J].J Physiol,2009,587:5541-5549.
[4]GRIJALVA J,HICKS S,ZHAO X,et al.Exercise training enhanced myocardial endothelial nitric oxide synthase(eNOS)function in diabetic Goto-Kakizaki(GK)rats.Cardiovasc Diabetol,2008,7:34.
[5]HOHL R,FERRARESSO R L,DE OLIVEIRA R B,et al.Development and Characterization of an Overtraining Animal Model[J].Med Sci Sport Exe.2009,41(5):1155-1163.
[6]KAMATA H,HONDA S,MAEDA S,et al.Reactive oxygen species promote TNFα-induced death and sustained JNK activation by Inhibiting MAP Kinase phosphatases[J].Cell,2005,120(5):649-661.
[7]KAWANISHI N,YANO H,YOKOGAWA Y,et al.Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice[J].Exe Immunol Rev,2010,16:105-118.
[8]KIM H G,YOON D H,LEE W H,et al.Phellinus linteus inhibits inflammatory mediators by suppressing redox-based NF-kappaB and MAPKs activation in lipopolysaccharide-induced RAW 264.7 macrophag e[J].J Ethnopharmacol,2007,114(3):307-315.
[9]KIM J H,NA H J,KIM C K,et al.The non-provitamin A carotenoid,lutein,inhibits NF-kappaB-dependentgene expression through redox-based regulation of the phosphatidylinositol 3-kinase/PTEN/Akt and NF-kappaB-inducing kinase pathways:role of H2O2in NF-kappaB activation[J].Free Radic Biol Med,2008,45(6):885-896.
[10]LAGRANHA C J,DE LIMA T M,SENNA S M,et al.The effect of glutamine supplementation on the function of neutrophils from exercised rats.Cell Biochem Funct,2005,23(2):101-107.
[11]LI Q X,XIONG Z Y,HU B P,et al.Aging-associated insulin resistance predisposes to hypertension and its reversal by exercise:the role of vascular vasorelaxation to insulin[J].Basic Res Cardiol,2009,104(3):269-284.
[12]MARCELO MACEDO ROGERO,JULIO TIRAPEGUI,MARCO AURELIO RAMIREZ VINOLO,et al.Dietary Glutamine Supplementation Increases the Activity of Peritoneal Macrophages and Hemopoiesis in Early-Weaned Mice Inoculated with Mycobacteriumbovis Bacillus Calmette-Guérin[J].J Nutrition,2008,138(7):1343-1348.
[13]MAXIME PELLEGRIN,CAROLE MIGUET-ALFONSI,KARIMA BOUZOURENE,et al.Long-term Exercise Stabilizes Atherosclerotic Plaque in ApoE Knockout Mice[J].Med Sci Sport Exe,2009,41(12):2128-2135.
[14]MENDES A F,CARVAL HO A P,CARAMONA M M,et al.Diphenyleneiodonium inhibits NF-kappaB activation and iNOS expression induced by IL-1beta:involvement of reactive oxygen species[J].Mediators Inflamm,2001,10(4):209-215.
[15]MINAKAMI R,SUMIMOTOA H.Phagocytosis-coupled activation of the superoxide-producing phagocyte oxidase,a member of the NADPH oxidase(Nox)family[J].Int J Hematol,2006,84:193-198.
[16]MUZAFFAR S,J EREMYJ Y,ANGELINI GD,et al.Role of the endothelium and nitric oxide synthases in modulating superoxide formation induced by endotoxin and cytokines in porcine pulmonary arteries[J].Thorax,2003,58:598-604.
[17]NA KYUNGLEE,YOUNG GEUM CHOI,JI YOUN BAIK,et al.A crucial role for reactive oxygen species in RANKL-induced osteoclast differentiation[J].Blood,2005,106(3):852-859.
[18]NATALIE HISCOCK,BENTE KLARLUND PEDERSEN.Exercise-induced immunodepression-plasma glutamine is not the link[J].J Appl Physiol,2002,93:813-822.
[19]NATHAN T J,SARAH W,ESPEN E S,et al.Effects of acute and chronic endurance exercise on intracellular nitric oxide in putative endothelial progenitor cells:role of NAPDH oxidase[J].Am JPhysiolHeart Circ Physiol,2009,297:H1798-H1805.
[20]OL KER C,SIESE A,STUMPF S,et al.Impaired superoxide radical production by bronchoalveolar lavage cells from NO(2)-exposed rats[J].Free Radic Biol Med,2004,37(7):977-987.
[21]SAKURAI T,IZAWA T,KIZAKI T,et al.Exercise training decreases expression of inflammation-related adipokines through reduction of oxidative stress in rat white adipose tissue[J].Biochem Biophys Res Commun,2009,379(2):605-609.
[22]SEBASTIAN SIXT,SEBASTIAN BEER,MATTHIAS BLÜHER,et al.Long-but not short-term multifactorial intervention with focus on exercise training improves coronary endothelial dysfunction in diabetes mellitus type 2 and coronary artery disease[J].Eur Heart J,2010,31(1):112-119.
[23]SHATROV V A,BRUNE B.Induced expression of manganese superoxide dismutase by non-toxic concentrations of oxidized low-density lipoprotein(oxLDL)protects against oxLDL-mediated cytotoxicity[J].Biochem J,2003;374(2):505-511.
[24]SHEN G X.Oxidative stress and diabetic cardiovascular disorders:roles of mitochondria and NADPH oxidase[J].Can J Physiol Pharmacol[J].2010,88(3):241-248.
[25]STAVROS SELEMIDIS,GREGORY J DUSTING,HITESH PESHAVARIYA,et al.Nitric oxide suppresses NADPH oxidase-dependent superoxide production by S-nitrosylation in human endothelial cells[J].Cardiovascular Res,2007,75:349-358.
[26]WANG YIJIE,MANDY MZ,GREGORY KL,et al.The Role of the NADPH Oxidase Complex,p38 MAPK,and Akt in Regulating Human Monocyte/Macrophage Survival[J].Am J Res Cell Molecular Biology,2007,36:68-77.
[27]YASUHARU MATSUMOTO,VOL KER ADAMS,SASKIA JACOB,et al.Regular Exercise Training Prevents Aortic Valve Disease in Low-Density Lipoprotein-Receptor-Deficient Mice[J].Circulation,2010,121:759-767.
[28]ZHAO K,HUANG Z,LU H,et al.Induction of inducible nitric oxide synthase increases the production of reactive oxygen species in RAW264.7 macrophages[J].Biosci Rep,2010,30(4):233-241.
Effects of Overtraining and Supplement with DPI or Glutamine on the Production of ROS and the Expression of iNOS in Pritoneal Macrophages
XIAO Wei-hua1,2,CHEN Pei-jie1,WANG Ru1,DON G Jing-mei1
目的:观察过度训练及补充二联甲苯(DPI)或谷氨酰胺(Gln)对大鼠腹膜巨噬细胞活性氧(ROS)生成能力的影响,探讨诱导型一氧化氮合酶(iNOS)在此过程中发挥的作用。方法:8周龄健康雄性wistar大鼠56只,随机分为安静对照组(C)、过度训练组(E)、过度训练补充DPI组(ED)、过度训练补充 Gln组(EG)。后3组根据取材时间不同各分为2组,运动后36 h取材组(E1、ED1、EG1),运动后 7天取材组(E2、ED2、EG2)。总计 7组,每组 8只,除C组外,其他6组都进行11周递增负荷跑台训练。断头处死大鼠并分离纯化腹膜巨噬细胞,流式细胞术测定ROS生成量,荧光定量PCR技术测定iNOS基因表达。结果:ROS生成:E1组显著低于C组;ED1组显著低于 E1组(P<0.05),与C组相比极显著降低(P<0.01);EG1组与 E1组相比没有显著差异,与C组相比极显著降低(P<0.01)。E2组、ED2组、EG2组分别与 E1组、ED1组、EG1相比均显著增高;E2组、ED2组、EG2组、C组4组之间比较无显著差异。iNOS mRNA表达:ED1组相对 E1组显著增加(P<0.05),相对C组极显著增加(P<0.01);ED2组相对 ED1组显著降低;其他相关组间比较无显著差异。对各组中ROS与iNOS表达量进行相关分析,显示二者呈直线负相关,相关系数 r=-0.45(P=0.004)。以各组 ROS和iNOS表达量相对,C组的倍比关系作图,发现 ROS生成量较高时,iNOS mRNA表达处于较低水平(E2组),随着iNOS mRNA表达水平增加,ROS生成量呈现降低趋势。结论:过度训练使腹膜巨噬细胞ROS生成量显著低于生理水平,引起运动性免疫抑制;补充抗氧化剂DPI可使过度训练时巨噬细胞ROS生成量进一步降低,补充谷氨酰胺对过度训练引起的巨噬细胞ROS生成量降低没有改善作用;过度训练及补充DPI或谷氨酰胺可影响巨噬细胞内ROS生成,这在一定程度上受iNOS催化产生的NO调控。
过度训练;巨噬细胞;活性氧;NADPH氧化酶;诱导型一氧化氮合酶;鼠;动物实验
Objective:To investigate the effect of overtraining and supplement with DPI(diphenylene iodonium)or glutamine on the production of ROS(reactive oxygen species)in pritoneal macrophages and the function of iNOS(inducible nitric oxide synthase)in this process.Method:56 male wistar rats were randomly divided into 7 groups:sedentary group(C,n=8),overtraining group(E),overtraining supplement with DPI group(ED),overtraining supplement with Gln group(EG).E,ED and EG group were respectively divided into two groups which sacrificed at 36h(E1,ED1,EG1,n=8)and 7 days(E2,ED2,EG2,n=8)after the last training.All groups except C were training in standard treadmill with an increasing load for 11 weeks.Peritoneal macrophages were isolated and purified after all rats were sacrificed by decapitation.The production of ROS was detected by FACS,and real time-PCR was used to detect the mRNA expression of iNOS.Result:Overtraining group showed a significant decline in production of ROS when compared with pritoneal macrophage from the sedentary group,and ED1 group significant lower than E1 group(P<0.05)and sedentary group(P<0.01).The production of ROS in EG1 group had no significant difference when compared with overtraining group,however,it significant lower than the sedentary group(P<0.01).E2,ED2 and EG2 group showed a significant increase when compared with E1,ED1 and EG1 group respectively.There were no significant differences in E2,ED2,EG2 and C group.The expression of iNOS in ED1 group significant higher than overtraining group(P<0.05) ,sedentary group(P<0.01)and ED2 group(P<0.05).The iNOS mRNA levels had no significant differencies in E2,ED2,EG2 and C group.The correlation analysis showed that ROS and iNOS were nega-tive correlation and the pearson correlation was-0.45(P=0.004).When the production of ROS was highness,the expression of iNOS was the lowest(E2 group).When the iNOS mRNA levels increase,the production of ROS showed a tendency of decline.Conclusion:Overtraining made the production of ROS in pritoneal macrophage lower than physiological level significantly,which was the performance of exercise-induced immunosuppression.DPI supplement made the production of ROS in overtraining group decline more seriously.And the decline of ROS in overtraining group could not be ameliorated by Gln supplement.Overtraining and supplement with DPI or Gln certainly had an influence on ROS production in pritoneal macrophages,and it was regulated by NO which mediate by iNOS in a certain extent.
overtraining;macrophage;reactive oxygen species;NA D P H oxidase;inducible nitric oxide synthase
G804.7
A
1000-677X(2011)02-0049-06
2010-12-12;
2011-01-10
国家自然科学基金项目(30971422);上海市重点学科建设资助项目(S30802)。
肖卫华(1981-),男,湖南安化人,讲师,在读博士研究生,研究方向为运动免疫学与青少年体质,Tel:(021)51253242,E-mail:xiaoweihua1115@163.com;陈佩杰(1962-),男,浙江舟山人,教授,博士,博士研究生导师,研究方向为运动免疫学与青少年体质,Tel:(021)51253626,E-mail:chengpjk@online.sh.cn。
1.Shanghai University of Sport,Shanghai 200438,China;2.Xiangnan University,Chenzhou 423000,China.
