SIRTUIN1介导的NIH3T3成纤维细胞昼夜节律时钟基因表达抑制的光生物调节作用
2011-09-28吴德峰刘承宜
吴德峰 ,刘承宜 ,朱 玲
SIRTUIN1介导的NIH3T3成纤维细胞昼夜节律时钟基因表达抑制的光生物调节作用
吴德峰 ,刘承宜 ,朱 玲
前言
普遍存在的昼夜节律现象是一种内源性的自主的并能自我维持的近似24 h的周期性生理生化过程和行为活动。昼夜节律和代谢节律存在着直接的相互作用[39,29],从而使机体内能量的储存和利用得以同步,以维持内环境的稳定[33]。哺乳动物的血压变化和体温的波动等许多生理和行为受内源昼夜节律时钟系统所驱动,呈现出日震荡的特点[7]。运动员的生理功能当然也呈现节律性变动的特点。昼夜节律对运动员的运动能力和状态有很大的影响。Bambaeichi等人[9]发现女性肌肉力量的变化和直肠温度的节律性的变化的时相相同。
肿瘤坏死因子(tumor necrosis factor,TNF)能够调节昼夜节律系统中相关时钟基因的表达[31,11]。大量的事实证明,运动和重体力作业能够导致血清中 TNF-alpha等细胞因子的含量增加,但有规律的体育锻炼能够减弱这种应激反应[14]。Chen等人[12]发现骑自行车的运动员或者打太极拳的中年人体内的 TNF-α水平比习惯于久坐的对照组要高。Andersson等人[6]研究了高强度的耐力运动对非专业运动员受试者炎症反应的作用,发现大量长时间的耐力运动使受试者体内的 TNF-alpha显著升高,同时他们也发现有规律的体力活动可能具有某种抗炎作用。Gokhale等人[14]也发现,相同频率的大强度运动后,大多数的运动员和非运动员血清中的 TNF-alpha等细胞因子的含量都出现了升高,但运动员的升高程度较小,也即运动员的这种由于运动导致的细胞因子增多的应激反应要弱。Vaisberg等人[38]发现,即使是从事有规律的竞技运动的运动员,如果他产生了慢性疼痛的症状,其体内的 TNF-alpha等炎症细胞因子含量也会升高。
低强度激光或单色光(low intensity laser irradiation or monochromatic light,LIL)照射能够调节生物节律。Campbell等人[10]发现,膝盖后月国窝 3 h的明光照射可以引起体温和唾液褪黑素的生理节律发生变化,提出视觉系统之外可能存在可见光的光信号转导(Extraocular phototransduction,EPT)。然而,Yamazaki等人[41]没有在叙利亚鼠的视觉外的节律系统发现光受体。Wright等人[40]重复了 Campbell等人[10]的实验,但没有发现类似的结果。为进一步验证 Campbell等人[10]所认为的光照可以改变时钟节律的实验结果,我们这里用 TNF-alpha诱导NIH3 T3细胞时钟基因表达抑制,然后研究LIL对时钟基因表达的调控作用,为上述问题和争论的解决提供理论基础。
1 材料和方法
1.1 材料
小鼠胚胎成纤维细胞NIH3 T3细胞购自中国科学院上海细胞库。Dulbecco’smodified Eagle medium(DMEM)(Hyclone)、青霉素(Sigma)、链霉素 (Sigma)、谷氨酰胺(Sigma)、胎牛血清(杭州四季青)、马血清(Hyclone)、重组鼠 TNF-alpha(Peprotech)、焦碳酸二乙酯(DEPC)(Sigma)、细胞裂解试剂盒(TaKaRa,TaKaRa RNAiso Plus)、氯仿(天津科密欧)、异丙醇(天津科密欧)、无水乙醇(天津科密欧)、反转录试剂盒(TaKaRa,TaKaRa PrimeScriptTM RT reagent Kit)、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒(TaKa-Ra,TaKaRa SYBR?Premix Ex TaqTMII)。
1.2 细胞培养及处理
1.2.1 常规培养
使用含双抗(青霉素100 U/mL;链霉素100μg/mL)和10%胎牛血清的DMEM培养液,置于含5%二氧化碳(CO2)、饱和湿度、37℃的细胞培养箱中培养。细胞传代常规胰酶消化,注意消化时间不宜过长,按1∶3传代,隔天换液。取对数生长期细胞,以2×105个/mL密度接种于35 mm细胞培养皿,细胞生长汇合后1~2天开始实验。
1.2.2 TNF-alpha抑制NIH3 T3细胞时钟基因表达细胞模型的建立
1.2.2.1 马血清休克
根据Balsalobre等人[8]所用方法,于实验时间 t=0 h时刻用含50%马血清的DMEM培养基替换含10%胎牛血清的DMEM培养基;37℃、5%CO2、饱和湿度孵育 2 h,即到达同步 NIH3 T3细胞的时钟基因表达时相的目的,引起细胞主要时钟基因和钟控基因能呈现出至少3个周期的昼夜节律性振荡表达而无明显衰减。
1.2.2.2 TNF-alpha处理
参考Cavadini等人[11]所用实验方法:将马血清休克处理2 h的NIH3 T3细胞置于含有终浓度为10 ng/mL TNF-alpha的无血清DMEM培养基中,常规孵育培养,即可实现 TNF-alpha抑制时钟基因表达的目的,建立起实验所需模型。Cavadin等人[11]也对不同浓度 TNF-alpha的作用结果进行了探讨,我们在这里选择了一个适中的浓度10 ng/mL TNF-alpha用于建立细胞时钟基因表达受抑细胞模型,既能保证NIH3 T3细胞时钟基因表达受到抑制,又不至于 TNF-alpha浓度过高引起细胞凋亡等。
作者单位:华南师范大学,广东广州510006
1.2.3 低强度激光照射处理时钟基因表达抑制的细胞模型
在NIH3 T3细胞受高浓度马血清休克作用2 h后,用含有 TNF-alpha的无血清培养基置换含有高浓度马血清的DMEM培养基。在培养基置换后即刻在暗室中给予皿中培养的细胞以低强度810 nm半导体激光照射处理。照射方式为连续照射,激光输出功率为410 mW,实际照射强度为10 mW/cm2(中央光斑),照射时间为 20 min。照射完毕后细胞仍置于含 TNF-alpha的无血清DMEM培养基,常规条件孵育培养,并于第 6 h、12 h、8 h、24 h、30 h、36 h时间点收取细胞样品 ,用荧光定量逆转录聚合酶链式反应(reverse transcriptase polymerase chain reaction,RT-PCR)检测相关时钟基因[11]和烟酰胺腺嘌呤二核苷酸辅酶(nicotinamide adenine dinucleotide,NAD+)依赖的 Ⅲ型组蛋白去乙酰化酶 1(sirtuin 1,Sirt1)[35]的 mRNA表达,用酶循环法[26]检测 NAD+和其还原形式 NADH的比值 NAD+/NADH。(预实验分析结果表明在10 mW/cm2×10 min光照参数时,LIL照射均可以拮抗 TNF-alpha对 Per2、Dbp基因表达的抑制。)
1.3 实验分组
本实验共分对照组、TNF组、LIL组3组。每组处理方案为,对照组:NIH3 T3细胞常规培养,马血清休克2 h后,用无血清DMEM(高糖)培养至取材,每次独立实验每个取样时间点3个样品;TNF组:NIH3 T3细胞常规培养,马血清休克 2 h后,用含 10 ng/mL TNF-alpha的DMEM(高糖)无血清培养基培养至取材,每次独立实验每个取样时间点3个样品;LIL组:NIH3 T3细胞常规培养,马血清休克 2 h后,用含 10 ng/mL TNF-alpha的DMEM(高糖)无血清培养基培养的同时即刻给予皿中培养的细胞以10 mW/cm2×20 min低强度810 nm半导体激光照射处理,照射完毕后细胞仍置于含 TNF-alpha的无血清DMEM培养基至取材,每次独立实验每个取样时间点3个样品。
1.4 统计学处理
实验数据由SPSS 16.0统计软件处理,计算平均值和标准差(±SD),t检验分析组间差异显著性,统计学显著性水平定为 P<0.05。
2 结果
2.1 LIL对 TNF-alpha诱导的 NIH3 T3细胞时钟基因表达抑制模型中时钟基因 Clock、Bmal1、Dbp和 Per2周期性表达的影响
根据荧光定量RT-PCR的统计结果,TNF组和对照组相比较表明,TNF-alpha分别在第12 h和第18 h抑制了 Clock(P<0.05)(图1)、第 18 h抑制了 Bmall(P<0.05)(图2)和 Dbp(P<0.005)(图3)及第18 h和第30 h抑制了 Per2(P<0.05)(图4)的 mRNA表达。LIL组和 TNF组比较表明,LIL抑制了 TNF-alpha在第18 h对Clock(P<0.05)(图1)和Bmall(P<0.05)Bmal1(图2)及第30 h对 Dbp(P<0.05)(图3)和Per2(P<0.005)(图4)mRNA表达的抑制作用。LIL组和对照组比较表明,时钟基因 Clock(图1)、Bmal1(图2)、Dbp(图3)的 mRNA表达在LIL组和对照组已无显著性差异,时钟基因 Per2(图4)的 mRNA表达在 18 h(P<0.05)低于对照组,在 30 h(P<0.05)高于对照组。
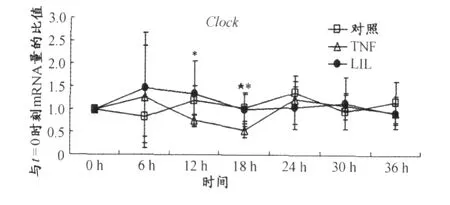
图1 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中时钟基因 Clock周期性表达的影响曲线图Figure 1. The Effect of LIL to Suppressed Expression of CircadianClockG eneClockin Cultured NIH3T3 Fibroblasts Induced by TNF-alpha

图2 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中时钟基因Bmal1周期性表达的影响曲线图Figure 2. The Effect of LIL to Suppressed Expression of CircadianClockG eneBmal1 in Cultured NIH3T3 Fibroblasts Induced by TNF-alpha
2.2 LIL对 TNF-alpha引起的 NIH3 T3细胞时钟基因表达抑制模型中 Sirt1基因的表达及胞内NAD+/NADH的影响
TNF组与对照组相比较表明,TNF-alpha在第18 h和第24 h抑制了 Sirt1(P<0.05)(图5)的 mRNA表达,并且在第 6 h、第 12 h、第 18 h和第 30 h降低了NAD+/NADH(P<0.005)(图6)的比值。LIL组和TNF组比较表明,LIL抑制了 TNF-alpha在第 18 h对Sirt1(P<0.005)(图5)的 mRNA表达的抑制作用,并且抑制了 TNF-alpha在第6 h(P<0.005)、第12 h(P<0.05)和第 18 h(P<0.05)对 NAD+/NADH(图6)比值的降低作用。LIL组和对照组比较表明,Sirt1(图5)的mRNA表达在第18 h(P<0.05)高于对照组,胞内NAD+/NADH(图6)的比值在第6 h(P<0.05)、第12 h(P<0.005)、第18 h(P<0.05)和第30 h(P<0.005)低于对照组。
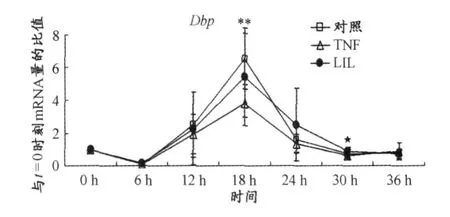
图3 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中时钟基因Dbp周期性表达的影响曲线图Figure 3. The Effect of LIL to Suppressed Expression of CircadianClockgeneDbpin Cultured NIH3T3 Fibroblasts Induced by TNF-alpha

图4 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中时钟基因 Per2周期性表达的影响曲线图Figure 4. The Effect of LIL to Suppressed Expression of CircadianClockgenePer2 in Cultured NIH3T3 Fibroblasts Induced by TNF-alpha
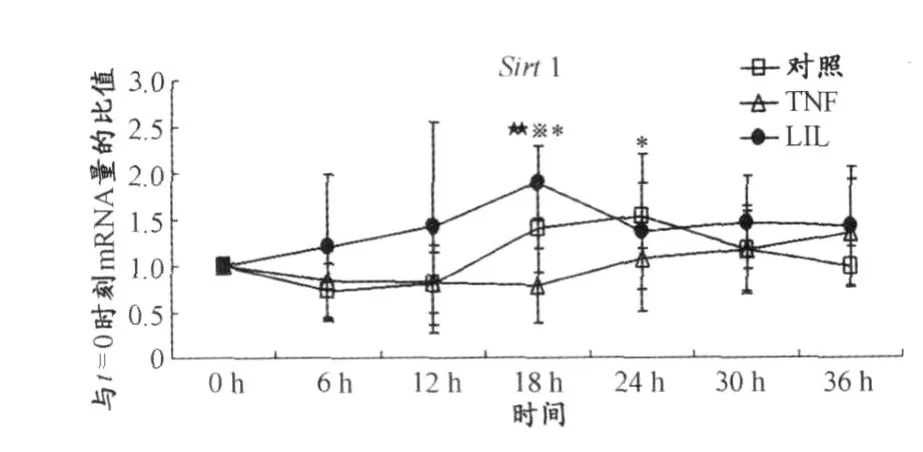
图5 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中Sirt1基因表达的影响曲线图Figure 5. The Effect of LIL to Suppressed Expression ofSirt1 in Cultured NIH3T3 Fibroblasts Induced by TNF-alpha
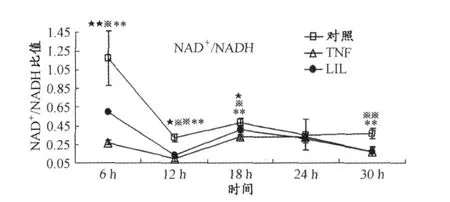
图6 LIL对TNF-alpha诱导的 NIH3T3细胞时钟基因表达抑制模型中胞内NAD+/NADH的影响曲线图Figure 6. The Effect of LIL to Suppressed Expression of NAD+/NADH in Cultured NIH3T3 Fibroblasts Induced by TNF-alpha
3 讨论
3.1 LIL抑制 TNF-alpha诱导的时钟基因表达下调
功能内稳态(function-specific homeostasis,FSH)利用负反馈机制抵制内外干扰,维持功能发挥所需要的内部涨落,实现功能充分稳定的发挥[1]。LIL对处于 FSH的功能无效,但可以调节远离 FSH的功能[1]。在本实验中,TNF-alpha抑制了经过马血清诱导的 NIH3 T3细胞中时钟基因的表达,时钟基因的表达远离了时钟基因表达内稳态(Clock-gene-expression-specific homeostasis,Cg-SH),LIL则促进时钟基因的表达建立CgSH。
Cavadini等人[11]研究了马血清休克处理后的0、4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h 中 10 ng/mL TNF-alpha对NIH3 T3细胞中时钟基因mRNA表达的影响,发现在前12 h TNF-alpha对时钟基因的表达没有影响 ,在 20 h、24 h、28 h中 TNF-alpha则显著抑制了 Dbp、Per2等时钟基因的表达。在我们的实验中LIL在前24 h对 TNF-alpha诱导的时钟基因 Dbp、Per2表达下调没有影响,LIL显著抑制 TNF-alpha诱导的时钟基因 Dbp、Per2表达下调的作用也发生在第30 h。另外,与Cavadini等人[11]有所不同,我们发现,分别在12 h、18 h和 18 h分别抑制了 Clock、Bmal1的表达,而在 18 h这一时刻LIL抑制了 TNF-alpha的作用。因此,可以发现只有在TNF-alpha已经改变了时钟基因表达的情况下,LIL的光生物调节作用才能够对 TNF-alpha的这种作用产生影响;在 TNF-alpha对时钟基因的表达没有影响之前,则此时LIL对时钟基因的表达也没有任何作用。我们分析这种现象产生的原因是,如果TNF对mRNA的表达没有影响,说明相关的功能处于 FSH,LIL当然没有影响;如果TNF抑制mRNA的表达,则说明相关的功能远离 FSH,此时LIL对其具有调节作用。
从CgSH的角度来看,Wright等人[40]和 Campbell等人[10]两个研究小组的结果并不矛盾。在 Wright等人[40]的实验中健康受试者所处的环境全黑(0 lux),时钟基因的表达处于CgSH,生理节律当然不受影响。Campbell等人[10]实验中健康受试者处在有微弱灯光的环境(<50 lux),时钟基因的表达远离CgSH,生理节律受到干扰,正如本研究实验所发现的,LIL可以促进时钟基因的表达恢复CgSH,当然可以调节生理节律。
3.2 LIL抑制 TNF-alpha诱导的时钟基因表达下调与Sirt1有关
近年的研究表明,NAD+依赖的 Sirt1在昼夜节律时钟基因表达的调节中具有重要作用。在构成昼夜节律系统的相关蛋白中,其核心组分 Clock蛋白具有组蛋白乙酰基转移酶活性,通过对组蛋白和非组蛋白的乙酰化导致相关时钟基因染色质形态的改变进而激活其表达,而Sirt1能够平衡 Clock蛋白的乙酰化作用,进而与 Clock一起在时钟基因表达的调控过程中发挥重要作用。Sirt1的去乙酰化酶活性依赖于NAD+,每催化一分子的乙酰化赖氨酸残基的去乙酰化作用需要分解一分子的NAD+产生烟碱(nicotinamide,NAM)和氧代乙酰基 ADP核糖基(O-acetyl-ADP-ribose)。Sauve等人[37]和 Nakahata等人[30]发现,野生小鼠胚胎成纤维细胞(wild-type mouse embryonic fibroblasts,WT MEFs)中胞内 NAD+的震荡时相与 Sirt1去乙酰化活性的时相相同,与组蛋白 H3和Bmal1的乙酰化时相正好相反。
为了进一步探究LIL通过何种途径来影响本实验模型中 TNF-alpha对时钟基因表达的抑制作用,本文同时检测了细胞中 Sirt1的mRNA表达水平及胞内NAD+/NADH的比值变化情况。本文发现,LIL整体提高了胞内 Sirt1的表达及 NAD+/NADH水平。Sirt1的活性依赖于NAD+的水平。因此,LIL既提高了 Sirt1的mRNA表达,又提高了 Sirt1蛋白的活性。
近年来的研究发现,白藜芦醇和槲皮素等多酚类物质可以提高 Sirt1活性[17]。多酚类物质的浓度越高,Sirt1活性提高的程度也越高。白藜芦醇和槲皮素等多酚类物质也能调节 TNF-alpha诱导的细胞中众多基因表达的变化,并且都是通过或者部分通过抑制核因子kappa B(nuclear factor kappa B,NF-kappa B)信号通路实现的。Zhu等人[44]发现,白藜芦醇能够抑制3 T3-L1脂肪细胞中 TNF-alpha诱导的单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)表达的下调,更进一步的研究发现,白藜芦醇抑制了 TNF-alpha处理的3 T3-L1脂肪细胞中 NF-kappaB的转录活性。Yu等人[43]研究发现,白藜芦醇能够抑制人肝癌细胞中 TNF-alpha诱导的基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达,并且这种作用至少部分的与白藜芦醇对 NF-kappa B信号通路的下调有关。Csiszar等人[13]发现,白藜芦醇能够抑制人冠状动脉内皮细胞(human coronary arterial endothelial cells,HCAECs)中 TNF-alpha诱导的NF-kappaB的激活及NF-kappaB依赖的一系列炎症基因的表达。Moon等人[27]发现,白藜芦醇能够抑制人血管内皮细胞中 TNF-alpha诱导的趋化因子 Fractalkine的表达,这种抑制作用部分的是通过抑制NF-kappaB的活性来实现的。Lee等人[20]发现,白藜芦醇能够抑制人血管平滑肌细胞中 TNF-alpha诱导的MMP-9的表达,这种抑制作用部分的是通过转录因子NF-kappaB来实现的。Lotito等人[23]发现,槲皮素等能够抑制 TNF-alpha诱导的人主动脉上皮细胞中内皮黏附分子的表达。Lee等人[21]证实,黄酮类如槲皮素等能够抑制 HEK 293细胞中由 TNF-alpha诱导的IL-8启动子的激活和基因表达,并且抑制了 TNF-alpha处理的 HEK 293细胞中NF-kappaB的激活。Sato等人[36]发现,槲皮素能够抑制人滑膜细胞中 TNF-alpha或 H2O2诱导的白细胞介素-8(interleukin 8,IL-8)和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)的表达,这种抑制作用至少部分的是通过抑制NF-kappa B的激活实现的。另外,白藜芦醇还能直接阻止 NF-kappa B的激活。Heynekamp等人[16]指出,白藜芦醇是一个已知的NF-kappaB的激活的抑制剂。Manna等人[25]证实,白藜芦醇能够以剂量依赖的方式阻止 TNF-alpha诱导的 NF-kappaB的激活。Pfluger等人[32]研究证实,发现与野生小鼠相比,给予18周高脂肪饮食后,基因重组适当超表达 Sirt1(为野生型的 2~4倍)的重组小鼠虽然在实验过程中摄入更多的食物,但其却具有较低的体重和脂肪量,并且,具有低NF-kappaB活性,抑制了肝脏炎症的产生。因此,可以发现,Sirt1在较低剂量或者适当超表达情况下抑制 TNF-alpha自身的表达及 TNF-alpha对其他基因的调节作用,以及能够抑制NF-kappaB的激活。
本实验中,LIL抑制 TNF-alpha诱导的时钟基因表达下调的作用类似于藜芦醇和槲皮素等多酚类物质对TNF-alpha诱导的细胞中众多基因表达变化的调节作用。LIL照射既提高了 Sirt1的 mRNA表达又提高了Sirt1蛋白的活性,进而抑制 TNF-alpha诱导的时钟基因表达的下调。其中可能的分子机制是,Sirt1通过抑制NF-kappaB信号通路后,进一步抑制 TNF-alpha的作用从而起到间接的调节作用。
3.3 LIL影响mRNA表达的作用特点
“分子生物学中心法则”认为,DNA储存的信息决定RNA序列,而RNA序列决定蛋白质结构;而多肽中的特异氨基酸序列则是由mRNA上的核苷酸序列所决定,即由mRNA传递DNA的编码信息;生物的遗传信息储存在DNA的核苷酸序列中代代相传,这些信息的选择性表达则需要通过转录的方式从细胞核的“数据库”中以mRNA的形式提取特异的、准确的信息,并运送至细胞质中进行蛋白质合成;mRNA是遗传信息从基因组到核糖体的直接载体;而由RNA聚合酶介导的 RNA转录的起始也可能是控制基因表达的最重要步骤。由此可见,mRNA表达在整个遗传信息传递的过程中起着相当重要的作用。因此,LIL对mRNA转录水平的调节作用在调控细胞整体的基因表达方面具有十分重要的意义。
LIL影响mRNA表达的通路可能是细胞整体的氧化还原电位[18],也可能是细胞信号转导[45,15]。不同的细胞在生长条件范围内具有不同的氧化还原态,正如 Karu[18]所指出的,细胞氧化还原电位较低的还原态(细胞内p H低)远离内稳态,对LIL的响应潜力较大;细胞最佳的氧化还原态处于内稳态,对LIL没有响应。细胞中许多重要的调节通路是通过氧化还原态来介导的。氧化还原态的改变能够诱导细胞内众多的信号通路的激活,调节核酸合成,蛋白质合成,酶的活化,细胞周期进展等[22]。这些细胞溶质的反应进而诱导细胞转录的改变。许多转录因子能够被细胞氧化还原态的变化所调节,包括氧化还原因子1(redox factor-1,Ref-1)依赖的激活蛋白因子1(activator protein-1,AP-1),NF-kappa B,P53,转录激活因子/cAMP效应元件结合蛋白(activating transcription factor/cAMP-response element-binding protein ,ATF/CREB),低氧诱导因子(hypoxiainducible factor,HIF)-1α,低氧诱导因子样因子(HIF-like factor)。通常氧化还原依赖的转录因子的氧化形式具有较低的DNA结合能力。Ref-1是这些转录因子特异还原的一个重要因子。人们发现低水平的氧化剂能够刺激某些类型的细胞的增殖和分化[42,19,5]。
3.4 本实验结果在体育运动中的可能应用
运动员尤其是优秀运动员经常需要跨区域参加一些大型的体育赛事,会出现时差综合症。当快速跨越多个时区时,体内昼夜节律系统原有的时间程序和新环境中的昼夜循环周期发生冲突[28],导致内源性节律系统发生转变出现短暂的去同步化,直至内源性的节律和外界环境昼夜循环的时相相同[24]。时差综合症最常见的症状是睡眠障碍、注意集中困难、易怒、抑郁、疲乏、方向感丧失、食欲不振、胃肠道功能紊乱、运动能力和状态下降等精神和身体状态的下降[28,24]。Reinberg等人[34]推荐将时间生物学的方法运用到体育研究中来。
本研究为时差综合症的解决提供了新的选择,即LIL照射可用于改善睡眠质量。腘窝照射可以调节生物节律[10]。鼻腔内低强度激光照射治疗(intranasal low intensity laser irradiation,ILIL T)也是一种治疗失眠症的绿色治疗方法[1]。王芳[2]用3 mW的低强度650 nm GaInP/AlGaInP半导体激光鼻腔内照射治疗50例患者,单侧30 min,每天1次,每个疗程10~14天,共1~2疗程。结果显效41例(82%),有效4例(8%),无效5例(10%)。许长春等人[3]用3.5~4.5 mW的低强度氦氖激光鼻腔内照射治疗了38名失眠症患者,每次照射 30 min,每天1次,每个疗程10天,共两个疗程。他们发现 ILIL T可以增加血清褪黑素。许长春等人[4]进一步用3.5~4.5 mW的低强度氦氖激光鼻腔内照射治疗了128名失眠症患者,每次照射30 min,每天一次,共10天。他们发现多导睡眠图获得改善。
4 结论
本研究的实验结果在证实 TNF-alpha具有干扰哺乳动物细胞中时钟基因表达作用的基础上,发现LIL抑制了 TNF-alpha诱导的时钟基因表达的下调。进一步研究发现LIL的光生物调节作用通过提高 Sirt1的mRNA表达和 Sirt1蛋白的活性抑制了 TNF-alpha的作用。本实验为LIL对失眠和时差综合症等生物节律相关疾病的治疗提供了理论依据。
[1]刘承宜,朱平.低强度激光鼻腔内照射疗法[M].北京:人民军医出版社,2009:50-413.
[2]王芳.鼻腔内激光照射治疗失眠的疗效观察与护理[J].社区医学杂志,2006,4(3):58.
[3]许长春,王黎荔,刘军方,等.低能量 He-Ne激光脑定向治疗失眠症[J].前卫医药杂志,2001,18(5):337-338.
[4]许长春,仵震宇,王黎荔,等.低能量 He-Ne激光治疗失眠症对睡眠脑电图的影响[J].实用医药杂志,2002,19(6):407-408.
[5]ALALUF S,MUIR-HOWIE H,HU H L,et al.Atmospheric oxygen accelerates the induction of a post-mitotic phenotype in human dermal fibroblasts:the key protective role of glutathione[J].Differentiation,2000,66(2-3):147-155.
[6]ANDERSSON J,JANSSON J H,HELLSTEN G,et al.Effects of heavy endurance physical exercise on inflammatory markers in non-athletes[J].Atherosclerosis,2010,209(2):601-605.
[7]ASHER G,GATFIELD D,STRATMANN M,et al.Sirt1 regulates circadianClockgene expression throughPer2 deacetylation[J].Cell,2008,134(2):317-328.
[8]BALSALOBRE A,DAMIOLA F,SCHIBLER U,et al.A serum shock induces circadian gene expression in mammalian tissue[J].Cell,1998,93(6):929-937.
[9]BAMBAEICHI E,REILL Y T,CABLE N T,et al.Influence of time of day and partial sleep loss on muscle strength in eumenorrheic females[J].Ergonomics,2005,48(11-14):1499-1511.
[10]CAMPBELL S S,MURPHY P J.Extraocular circadian phototransduction in humans[J].Sci,1998,279(5349):396-399.
[11]CAVADINI G,PETRZIL KA S,KOHLER P,et al.TNF-alpha suppresses the expression ofClockgenes by interfering with E-box-mediated transcription[J].Proc Natl Acad Sci USA,2007,104(31):12843-12848.
[12]CHEN Y Y,CHIANGJ,CHEN YJ,et al.Cycling and Tai Chi Chuan exercises exert greater immunomodulatory effect on surface antigen expression of human hepatitis B virus[J].ChinMed J(Engl),2008,121(21):2172-2179.
[13]CSISZAR A,SMITH K,LABINSKYY N,et al.Resveratrol attenuates TNF-alpha-induced activation of coronary arterial endothelial cells:role of NF-kappaB inhibition[J].Am J Physiol Heart Circ Physiol,2006,291(4):H1694-H1699.
[14]GOKHALE R,CHANDRASHEKARA S,VASANTHAKUMAR K C.Cytokine response to strenuous exercise in athletes and non-athletes-an adaptive response[J].Cytokine,2007,40(2):123-127.
[15]HAMBLIN M R,WAYNANT R W,ANDERS J.Mechanisms for low-light therapy[M].Belligham:Proc SPIE,2006.
[16]HEYNEKAMP J J,WEBER W M,HUNSAKER L A,et al.Substituted trans-stilbenes,including analogues of the natural product resveratrol,inhibit the human tumor necrosis factor alpha-induced activation of transcription factor nuclear factor kappaB[J].J Med Chem,2006,49(24):7182-7189.
[17]HOWITZ K T,BITTERMAN K J,COHEN H Y,et al.Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan[J].Nature,2003,425(6954):191-196.
[18]KARU T.Primary and secondary mechanisms of action of visible to near-IR radiation on cells[J].J Photochem Photobiol B,1999,49(1):1-17.
[19]KIRLIN W G,CAIJ,THOMPSON S A,et al.Glutathione redox potential in response to differentiation and enzyme inducers[J].Free Radic Biol Med,1999,27(11-12):1208-1218.
[20]LEE B,MOON S K.Resveratrol inhibits TNF-alpha-induced proliferation and matrix metalloproteinase expression in human vascular smooth muscle cells[J].J Nut,2005,135(12):2767-2773.
[21]LEE S,KIM Y J,KWON S,et al.Inhibitory effects of flavonoids on TNF-alpha-induced IL-8 gene expression in HEK 293 cells[J].BMB Rep,2009,42(5):265-270.
[22]LIU H,COLAVITTI R,ROVIRA II,et al.Redox-dependent transcriptional regulation[J].Circ Res,2005,97(10):967-974.
[23]LOTITO S B,FREI B.Dietary flavonoids attenuate tumor necrosis factor alpha-induced adhesion molecule expression in human aortic endothelial cells.Structure-function relationships and activity after first pass metabolism[J].J Biol Chem,2006,281(48):37102-37110.
[24]MANFREDINI R,MANFREDINI F,FERSINI C,et al.Circadian rhythms,athletic performance,and jet lag[J].Br J Sports Med,1998,32(2):101-106.
[25]MANNA S K,MUKHOPADHYAY A,AGGARWAL B B.Resveratrol suppresses TNF-induced activation of nuclear transcription factors NF-kappa B,activator protein-1,and apoptosis:potential role of reactive oxygen intermediates and lipid peroxidation[J].J Immunol,2000,164(12):6509-6519.
[26]MENZEL K,AHRENS K,ZENG A,et al.Kinetic,dynamic,and pathway studies of glycerol metabolism by Klebsiella pneumoniae in anaerobic continuous culture:IV.Enzymes and fluxes of pyruvate metabolism[J].Biotechnol Bioeng,1998,60(5):617-626.
[27]MOON S O,KIM W,SUNG M J,et al.Resveratrol suppresses tumor necrosis factor-alpha-induced fractalkine expression in endothelial cells[J].Mol Pharmacol,2006,70(1):112-119.
[28]MURPHY B A,ELLIOTT J A,SESSIONS D R,et al.Rapid phase adjustment of melatonin and core body temperature rhythms following a 6-h advance of the light/dark cycle in the horse[J].J Circadian Rhythms,2007,5:5.
[29]NAKAHATA Y,KALUZOVA M,GRIMALDI B,et al.The NAD+-dependent deacetylaseSirt1 modulatesClock-mediated chromatin remodeling and circadian control[J].Cell,2008,134(2):329-340.
[30]NAKAHATA Y,SAHAR S,ASTARITA G,et al.Circadian control of the NAD+salvage pathway byClock-Sirt1[J].Sci,2009,324(5927):654-657.
[31]PETRZIL KA S,TARABORRELLI C,CAVADINI G,et al.Clockgene modulation by TNF-alpha depends on calcium and p38 MAP kinase signaling[J].J Biol Rhythms,2009,24(4):283-294.
[32]PFLUGER P T,HERRANZ D,VELASCO-MIGUEL S,et al.Sirt1 protects against high-fat diet-induced metabolic damage[J].Proc Natl Acad Sci U S A,2008,105(28):9793-9798.
[33]RAMSEY K M,YOSHINO J,BRACE C S,et al.Circadian Clockfeedback cycle through NAMPT-mediated NAD+biosynthesis[J].Science,2009,324(5927):651-654.
[34]REINBERG A,PROUX S,BARTAL J P,et al.Circadian rhythms in competitive sabre fencers:internal desynchronization and performance[J].Chronobiol Int,1985,2(3):195-201.
[35]RODGERS J T,LERIN C,HAAS W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1alpha and Sirt1[J].Nature,2005,434(7029):113-118.
[36]SATO M,MIYAZAKI T,KAMBE F,et al.Quercetin,a bioflavonoid,inhibits the induction of interleukin 8 and monocyte chemoattractant protein-1 expression by tumor necrosis factoralpha in cultured human synovial cells[J].J Rheumatol,1997,24(9):1680-1684.
[37]SAUVE A A,WOLBERGER C,SCHRAMM V L,et al.The biochemistry of sirtuins[J].Annu Rev Biochem,2006,75:435-465.
[38]VAISBERG M,DE MELLO M T,SEELAENDER M C,et al.Reduced maximal oxygen consumption and overproduction of proinflammatory cytokines in athletes[J].Neuroimmunomodulation,2007,14(6):304-309.
[39]WIJNEN H,YOUNG M W.Interplay of circadianClocks and metabolic rhythms[J].Annu Rev Genet,2006,40:409-448.
[40]WRIGHT KP J R,CZEISLER C A.Absence of circadian phase resetting in response to bright light behind the knees[J].Sci,2002,297(5581):571.
[41]YAMAZAKI S,GOTO M,MENAKER M.No evidence for extraocular photoreceptors in the circadian system of the Syrian hamster[J].J Biol Rhythms,1999,14(3):197-201.
[42]YANG M,NAZHAT N B,JIANG X,et al.Adriamycin stimulates proliferation of human lymphoblastic leukaemic cells via a mechanism of hydrogen peroxide(H2O2)production[J].Br J Haematol,1996,95(2):339-344.
[43]YU H,PAN C,ZHAO S,et al.Resveratrol inhibits tumor necrosis factor-alpha-mediated matrix metalloproteinase-9 expression and invasion of human hepatocellular carcinoma cells[J].Biomed Pharmacother,2008,62(6):366-372.
[44]ZHU J,YONG W,WU X,et al.Anti-inflammatory effect of resveratrol on TNF-alpha-induced MCP-1 expression in adipocytes[J].Biochem Biophys Res Commun,2008,369(2):471-477.
[45]ZHU L,LIU T C Y,WU M,et al.Extraocular cellular phototransduction[J].J Innovation Optical Health Sci,2009,2(1):93-100.
Sirtuin1-mediated Photobiomodulation on TNF-alpha Inhibited Expression of Circadian ClockGenes in Cultured NIH3T3 Fibroblasts
WU De-feng,LIU Cheng-yi,ZHU Ling
背景和目的:昼夜节律是影响运动成绩的一个重要因素。研究发现,介导运动应激的肿瘤坏死因子(tumor necrosis factor,TNF)能够抑制昼夜节律时钟基因的表达。研究了低强度810 nm激光(low intensity 810 nm laser irradiation,LIL)对TNF抑制效应的调节作用。材料和方法:50%马血清休克处理NIH3 T3成纤维细胞2 h,同步化昼夜节律时钟基因的表达后,加入10 ng/mL TNF-alpha抑制它的表达,与此同时给予20 min10 mW/cm2的LIL照射。36 h内,每隔6 h检测细胞中时钟基因 Clock、Bmal1、Per2、Dbp和烟酰胺腺嘌呤二核苷酸辅酶(nicotinamide adenine dinucleotide,NAD+)依赖的组蛋白去乙酰化酶1(sirtuin 1,Sirt1)的mRNA的表达及胞内NAD+和其还原形式NADH的比值NAD+/NADH。结果:TNF-alpha分别在第12 h和第18 h抑制了 Clock(P<0.05)、第18 h抑制了 Bmall(P<0.05)和 Dbp(P<0.005)、第18 h和第30 h抑制了 Per2(P<0.05)及第18 h和第 24 h抑制了 Sirt1(P<0.05)的 mRNA表达,并且在第6 h、第12 h、第 18 h和第30 h降低了NAD+/NADH(P<0.005)的比值。LIL抑制了 TNF-alpha在第18 h对Clock(P<0.05)、Bmall(P<0.05)和 Sirt1(P<0.005)及第30 h对 Dbp(P<0.05)和Per2(P<0.005)的抑制作用,并且抑制了 TNF-alpha在第 6 h(P<0.005)、第12 h(P<0.05)和第18 h(P<0.05)对NAD+/NADH比值的降低作用。结论:LIL对被 TNF-alpha抑制的昼夜节律时钟基因表达的促进作用可能是通过NAD+/Sirt1介导的。
昼夜节律时钟基因;肿瘤坏死因子;光生物调节作用
Background and Objective:Circadian rhythm is one of the important factors on athletic performance.Tumor necrosis factor(TNF),which mediates sport stress,has been shown to inhibit the expression of circadianClockgenes.The modulation of low intensity 810 nm laser irradiation(LIL)on the inhibition was studied in this paper.Study design/materials and method:The expression of the circadianClockgenes in NIH3 T3 fibroblasts was synchronized by 50%horse serum shock for 2h,inhibited with TNF-alpha at 10ng/mL,and then irradiated with LIL at 10 mW/cm2for 20 min.The mRNA expression of the circadianClockgenes and Sirtuin 1(Sirt1),and the ratio of nicotinamide adenine dinucleotide(NAD+)and its reduced form NADH,NAD+/NADH,were assessed every 6h for 36h.Result:TNF-alpha inhibited the mRNA expression ofClock(P<0.05)at 12thand 18thh,Bmall(P<0.05)andDbp(P<0.005)at 18thh,Per2(P<0.05)at 18thand 30thh,andSirt1(P<0.05)at 18thand 24th h,respectively,and decreased NAD+/NADH(P<0.005)at 6th,12th,18thand 30thh,respectively.LIL inhibited the effects of TNF-alpha onClock(P<0.05),Bmall(P<0.05)andSirt1(P<0.005)at 18thh,Dbp(P<0.05)and Per2(P<0.005)at 30thh,and NAD+/NADH at 6th(P<0.005),12th(P<0.05)and 18th(P<0.05),respectively.Conclusion:The promotion of LIL on TNF-alpha inhibited expression of the circadianClockgenes may be mediated by NAD+/Sirt1.
circadianClockgenes;tumor necrosis f actor(TN F);photobiomodultion
G804.2
A
1000-677X(2011)02-0042-07
2010-11-28;
2011-01-10
国家自然科学基金(60878061)。
吴德峰(1985-),男,河南商城人,在读硕士研究生,主要研究方向为细胞生理与信息,Tel:(020)39312173,E-mail:wudefeng@163.com;刘承宜(1963-),男 ,四川大竹人,博士,教授,博士研究生导师,研究方向为内稳态理论及其在体育科学、激光医学和康复医学中的应用,Tel:(020)85213369,E-mail:liutcy@scnu.edu.cn;朱玲(1979-),女,四川宜宾人,讲师,博士,研究方向为运动生物化学理论及其在体育科学、激光医学和康复医学中的应用,Tel:(020)84720359,E-mail:zhul@scnu.edu.cn。
South China Normal University,Guangzhou 510006,China.
