不同强度运动对AMPKα2三种不同基因状态鼠MEF2/G LUT4 DNA结合活性的影响
2011-09-28龚豪杰
龚豪杰 ,谢 谨 ,张 楠 ,姚 璐 ,张 缨
不同强度运动对AMPKα2三种不同基因状态鼠MEF2/G LUT4 DNA结合活性的影响
龚豪杰 ,谢 谨 ,张 楠 ,姚 璐 ,张 缨
肌细胞增强因子2(myocyte enhancer factor 2,MEF2)是一种最早在骨骼肌管核发现的蛋白质,具有DNA结合活性。用电泳迁移法(EMSA)检测到葡萄糖运载体 4(glucose transporter 4,GLUT4)启动子上存在MEF2的结合位点[18,28,33],它可以和相关的转录因子结合共同调节 GLUT4基因的转录。同样利用 EMSA法,Mc-Gee SL等[21]的研究发现,7名受试者用(75±2)%˙VO2,自行车运动60 min后,MEF2/GLUT4 DNA结合活性增加了两倍,并伴随着 GLUT4基因和蛋白表达的增多,推测运动通过提高MEF2/GLUT4 DNA结合活性而提高GLUT4基因和蛋白的表达,但机制尚不清楚。近年来有研究[11]发现,通过AICAR(5’-aminoimidazole-4carboxamide-riboside,AMPK药物激活剂)激活 AMPK(5’-AMP activated protein kinase)可以提高 MEF2/GLUT4 DNA结合活性,而提高骨骼肌 GLUT4基因和蛋白的表达,提示了“AMPK激活-MEF2/GLUT4 DNA结合活性提高-GLUT4基因和蛋白表达增多”这一通路的存在。由于运动同样激活 AMPK[7,32],推测 AMPKα2可能参与调解了运动诱导的MEF2/GLUT4 DNA结合活性及 GLUT4基因和蛋白表达的提高。
然而,值得注意的是,这只是在离体实验中检测到的结果,其不一定能真实地反映体内转录调控蛋白和DNA结合的状况[4],而且,AICAR是介导嘌呤生物合成的物质,并非AMPK的特异激活剂[35],提示了这些结果可能具有一定的局限性。本研究旨在研究不同强度跑台运动对AMPKα2高表达转基因鼠和 AMPKα2基因敲除骨骼肌MEF2/GLUT4 DNA结合活性以及 GLUT4基因表达的影响,以探讨运动提高骨骼肌 MEF2/GLUT4 DNA结合活性及 GLUT4基因表达可能机制。
1 材料和方法
1.1 实验对象及分组
健康2月龄 C57BL/6J野生(Wild-type,WT)小鼠、AMPKα2高表达转基因(over-expression,OE)和AMPKα2基因敲除鼠(Knockout,KO)各30只(不同基因型小鼠AMPKα2蛋白Western检测结果见图1)[2]。体重18±2 g,分笼饲养,野生小鼠3~4只每笼,AMPKα2高表达转基因鼠和AMPKα2基因敲除鼠每笼1只,室内温度20℃~25℃,相对湿度50%~70%,每天光照12 h,国家标准啮齿类动物饲料饲养,自由进食和饮水。
1周的适应性饲养并进行1~2次适应性跑台练习后,野生鼠、AMPKα2高表达转基因鼠和 AMPKα2基因敲除鼠,分别按体重随机分为安静对照(control,C)、低强度跑台运动组(low intensity,L)、高强度跑台运动组(high intensity,H)3 组 ,共 9组 ,每组 10只(表1)。

图1 本研究不同基因状态鼠AMPKα2蛋白表达图谱Figure 1. Representative Immunoblots of AMPKα2 Protein in Various G enetypes
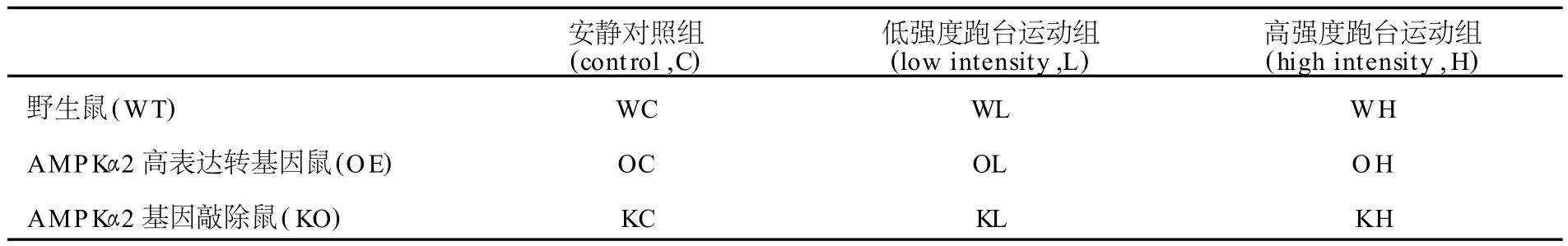
表1 本研究实验分组一览表Table 1 Experiment G roups
1.2 运动方案和取材
运动组运动前禁食12 h,安静对照组取材前禁食12 h。运动组小鼠采用坡度为0°的1 h跑台运动。低强度跑台运动组跑台速度为12 m/min,高强度跑台运动组跑台速度为20 m/min[1]。运动后 3 h乙醚麻醉,取股四头肌[2],冰水中除去可见血液、脂肪和筋膜,锡纸包裹,标记,迅速置于液氮中,随后转入-80℃冰箱保存。
1.3 仪器、试剂与指标测定方法
1.3.1 mRNA表达
骨骼肌 GLUT4 mRNA表达量采用实时荧光定量(Real Time-PCR)两步法。小鼠股四头肌50~100 mg,Trizol试剂(Invitrogen)依据说明书提取总 RNA。通过1%琼脂糖凝胶电泳图谱确定 RNA完整性(图2),并用紫外分光光度仪检测RNA的浓度和纯度后,进行逆转录(RT)部分。杭州朗基科学仪器有限公司生产的 PCR扩增仪,型号 MG96+/Y,RT-PCR试剂盒由 Promega公司合成。具体反应条件是:70℃5 min;42℃1 h;70℃15 min。合成的cDNA于-20℃冰箱储存备用。由于 mRNA的不稳定性,以上步骤在取材后2天内完成。
作者单位:北京体育大学,北京100084

图2 本研究 RNA电泳图Figure 2. Representative G els of RNA
7300荧光定量PCR仪和荧光燃料反应体系(SYBRRGreen PCR Master MIX)均购自美国应用生物系统公司(Applied Biosystems),引物购自上海生工生物工程技术服务有限公司,根据参考文献及基因文库设计,并经BLAST验证PCR产物的惟一性,具体上下游引物序列为:Actina,5’CAC AGC CTG GAT GGC TACGT3’;Actins,5’AGG CAA ACC GTG AAA AGA TG3’;GLUTa,5’CTA CCC AGC CAC GTT GCA TT3’;GLUTs,5’CTT GGC TCC CTT CAG TTT GG3’。反应体系为 20μl,分别为:SYBR Green PCR Master Mix(2×)10μL;PCR Forward Primer(上游引物 ,5μM)1μl;PCR Reverse Primer(下游引物 ,5μM)1μl;cDNA 模板 2μl;ddH2O 6μl。实时荧光量数值由实时定量PCR仪(Step One实时荧光定量 PCR系统,Applied Biosystems)读取,结果数值由仪器自带软件分析(Step One Software v2.0,Applied Biosystems)。目标基因表达结果以比较CT法相对定量。目标基因=2-△△CT[19]。
1.3.2 蛋白表达
AMPK(THr72)磷酸化水平、GLUT4蛋白含量采用免疫印迹(Western Blot)法。总蛋白提取方法为:股四头肌约40 mg置于 400μl蛋白裂解液中(50 mM Tris-Cl p H7.4~8.0,150 mM NaCl,5 mM EDTA,1%Triton-x-100,4μl 100×蛋白酶抑制混合物),4℃下电动匀浆机充分匀浆,4℃14 000 rpm 50 min取上清液至-80℃冰箱保存。蛋白酶抑制剂混合物购于 Pierce公司。核蛋白提取采用pierce核蛋白提取试剂盒,股四头肌约40 mg置于400μl CER1溶液中,4℃下电动匀浆机充分匀浆,静置10 min加入预冷的11μl CER2溶液,振荡器最高速震荡5 s,冰上 10 min,4℃16 000 rpm 10 min,弃上清液,200μl NER溶液溶解沉淀,置于冰上静置10 min并混匀3~4次,4℃18 000 rpm 10 min,上清部分为核蛋白,于-80℃冰箱保存。
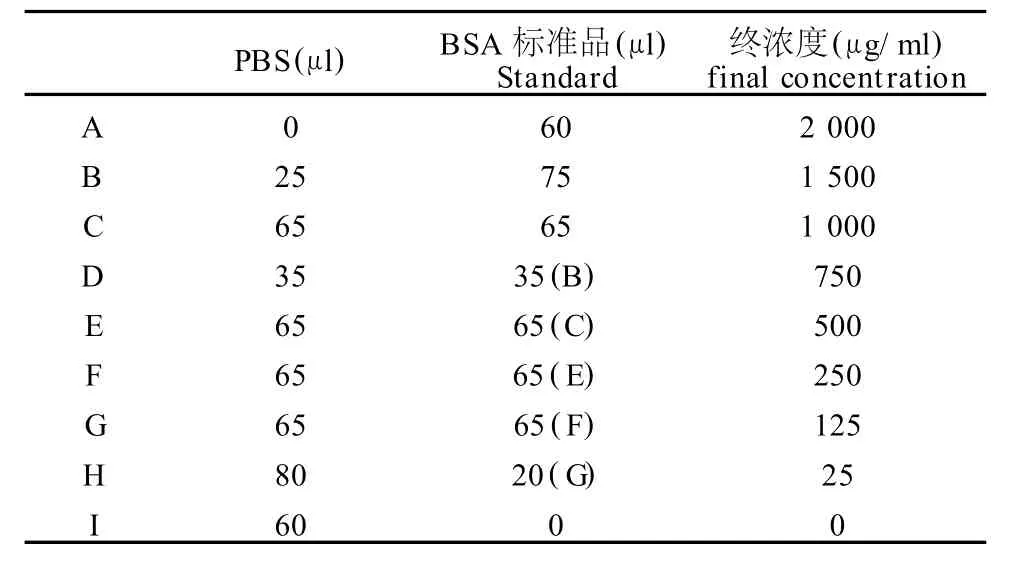
表2 本研究蛋白测定试剂配置一览表Table 2 Preparation of Diluted Albumin(BSA)Standards
蛋白含量测定采用pierce公司的BCA蛋白定量试剂盒。制作标准曲线的不同浓度的牛血清蛋白的反应试剂配制方法见表2,待测样品5倍稀释(5μl待测样品+20 μl PBS),BCA工作液按 50体积BCA试剂 A加1体积BCA试剂B(50∶1)配制。样品孔为200μl BCA工作液+25μl稀释过待测样品,标准孔为200μl BSA工作液+25μl不同梯度的牛血清蛋白反应试剂。各孔OD值由酶标仪读取,并由自带分析软件绘制标准曲线(图3)和浓度分析。
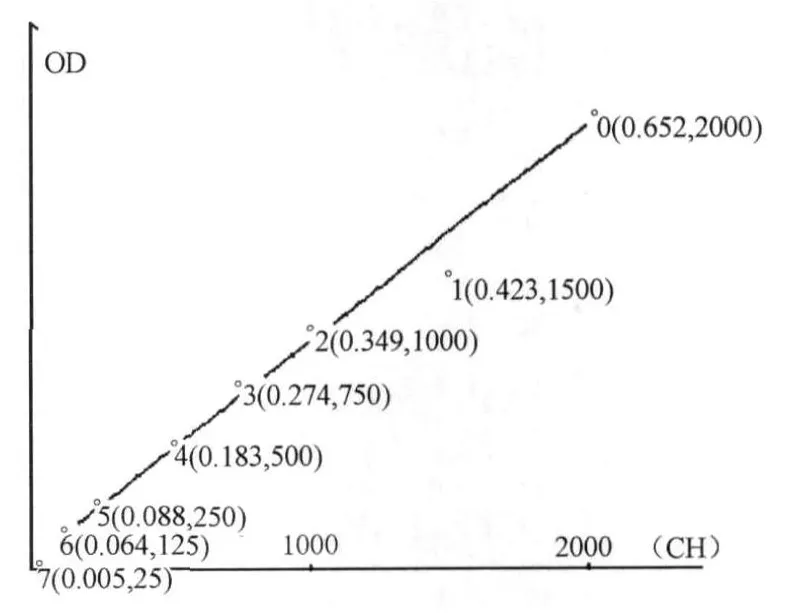
图3 本研究蛋白浓度测定标准曲线图Figure 3. Standard Curve for Determine the Protein Concentration
依据蛋白含量调整蛋白上样量后,10%聚丙烯酰胺凝胶分离,再转至硝酸纤维素膜(47 mm 0.45u)上,5%的牛清白蛋白封闭 30 min,一抗过夜 (P-AMPKα1/2(THr72)rabbit polyclonal IgG、GLUT4 rabbit polyclonal IgG:Santa Cruz Biotechnology);二抗 (Anti-rabbit IgG,HRP-linked Antibody:Cell Signaling Technology)和内参(β-actin rabbit polyclonal IgG,Santa Cruz Biotechnology)1 h,曝光前加入发光液(ECL Western Blotting Substrate,Pierce)反应1 min,暗室曝光至 X光片(Kodak)。生物电泳图像分析软件(FR-980 Smart View,复日科技)拍照,Image J软件读取条带积分灰度值,结果用目的蛋白积分灰度值与内参积分灰度值的比值表示。
1.3.3 MEF2/GLUT4 DNA结合活性
转录因子MEF2与 GLUT4 DNA结合活性采用染色质免疫沉淀法(Chromatin Immunoprecipitation,CHIP)。股四头肌约40mg,液氮研磨后1%甲醛室温交联目的蛋白和相应的基因组,1.25M甘氨酸终止交联反应,预冷PBS洗 3次 ,预冷 cell lysis buffer[10 mM HEPES-KOH(p H 7.9),10 mM KCl,1 mM EDTA(p H 8.0),protease inhibitors.]冰上孵育 10 min,4℃5 000 rpm 5 min,弃上清液,沉淀用预冷 nuclei lysis buffer[50 mM Tris-HCl(p H 8.0),10 mM EDTA,1%SDS,protease inhibitors]溶解,冰上静置 10 min,超声处理(power 30%,10×10s),以剪切基因组DNA,剪切效果通过DNA琼脂糖电泳检测(图4)。4℃14 000 rpm 10 min取上清液(约200 μl)分装3管,分别为 IP样品80μl,Igg阴性对照样品80 μl,input样品 40μl。

图4 本研究DNA剪切效果图Fig 4 Representative G els of Sonication Products
通过蛋白含量(方法同上)调整 IP量并由 IP buffer(20 mM Tris-HCl p H 7.2,100 mM NaCl,10%glycerol,0.1%NP-40,1 mM EDTA.protease inhibitors)补足至1.5 ml,每管加入 MEF2A抗体1μg(Rabbit polyclonal to MEF2A:Santa Cruz Biotechnology),4℃缓慢摆动混匀过夜。同样有1管加入无关的抗体(IgG)作为阴性对照。60μl Protein A/G PLUS-Agarose(Santa Cruz Biotechnology),4℃缓慢混匀90 min,沉淀一抗识别的蛋白或相应的复合物,4℃2 500 rpm 1 min弃上清液,沉淀用 IP buffer洗涤 3次,IP washing buffer(20 mM Tris-HCl p H 7.2,100 mM NaCl,0.2%NP-40,1 mM EDTA)洗涤(室温摇床孵育3~5 min,14 000 rpm 3 min,弃上清液)4次后 ,150μl elution buffer(50 mM NaHCO3,1%SDS)洗脱3~5 min,4℃14 000 rpm 3 min,取上清液(含抗体/蛋白/DNA复合物),重复1次,合并上清液(共300μl)。300μl上清加入12μl 5M NaCl,65℃加热4 h,去除蛋白和基因组DNA之间的交联。作为Input的10μl样品,加入1μl 5M NaCl,65℃加热4 h,同样用于去除蛋白和基因组DNA之间的交联。2.5倍体积无水乙醇,-20℃沉淀过夜。
4℃14 000 rpm 10 min,弃上清液,1 ml 70%乙醇洗涤沉淀,4℃14 000 rpm 10 min,弃上清,风干(5~10 min)。100μl TE buffer(10 mM Tris,8.1,1 mM EDTA)重悬DNA沉淀,加入 11μl 10×Proteinase K buffer(50 mM Tris-Cl p H 7.5,10 mM EDTA,0.3%SDS),1μl 19 mg/ml蛋白酶 K,55℃孵育 60 min。加入 290μl TE混匀后,等体积 Tris平衡苯酚,4℃12 000 rpm 5 min,取上清液,等体积氯仿,4℃12 000 rpm 5 min,取上清液,并加入 40μl 3M NaAc,5μg tRNA,5μg glycogen,2.5倍体积无水乙醇,-20℃沉淀过夜。4℃12 000~14 000 rpm 20 min,弃上清液,1 ml 70%乙醇洗涤沉淀,4℃14 000 rpm 5 min,弃上清液 ,风干 (15~20 min)。100μl TE buffer重悬DNA沉淀,用于 PCR检测。
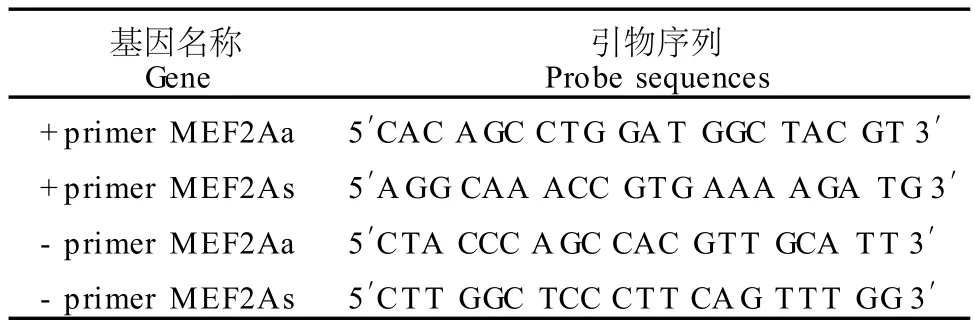
表3 本研究引物序列一览表Table 1 G ene Primer Sequences for PCR
根据文献设计引物以扩增包含(+primer MEF2A)和未包含(-primer MEF2A)转录因子 MEF2A与GLUT4启动子结位点(CTAAAATAG)的片段,具体序列见表3。PCR分别扩增 IP样品,IgG对照样品及input样品包含(扩增效果见图5)和未包含(扩增效果见图6)目标转录因子MEF2A与 GLUT4启动子结位点的基因片段,并 2%琼脂糖凝胶分别检测扩增效果。实时定量PCR测定样品DNA含量,步骤同上。目标基因表达结果以比较CT法相对定量。
图5 本研究PCR扩增效果图(+primer MEF2A)Figure 5. Representative gels of PCR products(+primer MEF2A)
1.4 数据统计

图6 本研究PCR扩增效果图(-primer MEF2A)Fig 6 Representative gels of PCR products(-primer MEF2A)
图7 本研究P-AMPK蛋白表达图谱Figure 7. Representative Immunoblots of P-AMPK in Various G roups
2 实验结果
2.1 AMPKα(THR172)磷酸化水平
由图8看出,无论是野生鼠,AMPKα2高表达转基因鼠,还是AMPKα2基因敲除鼠,1 h不同强度跑台运动后,骨骼肌AMPKα(THr172)磷酸化水平与常氧对照组相比均显著升高,野生鼠和 AMPKα2基因敲除鼠高强度跑台运动组 AMPKα(THR172)磷酸化水平与低强度跑台运动组无显著差异,而 AMPKα2高表达转基因鼠高强度跑台运动组骨骼肌AMPKα(THr172)磷酸化水平显著高于低强度跑台运动组。AMPKα2高表达转基因鼠安静对照组骨骼肌AMPKα(THr172)磷酸化水平与野生鼠安静对照组相比均无显著差异,而低强度跑台运动组和高强度跑台运动组均显著高于野生鼠。AMPKα2基因敲除鼠与野生鼠相比,无论是安静对照组,低强度跑台运动组,还是高强度跑台运动组,AMPKα(THr172)磷酸化水平均显著低于野生鼠。
2.2 MEF2/GLUT4 DNA结合活性
由图9看出,无论是野生鼠,AMPKα2高表达转基因鼠,还是AMPKα2基因敲除鼠,1 h不同强度跑台运动后,MEF2/GLUT4 DNA结合活性与安静对照组相比均显著升高,野生鼠和 AMPKα2基因敲除鼠高强度跑台运动组骨骼肌MEF2/GLUT4 DNA结合活性与低强度跑台运动组无显著差异,AMPKα2高表达转基因鼠高强度跑台运动组骨骼肌MEF2/GLUT4 DNA结合活性显著高于低强度跑台运动组。AMPKα2高表达转基因鼠与野生鼠相比,安静对照组无显著差异,而无论是低强度跑台运动组,还是高强度跑台运动组骨骼肌 GLUT4基因表达量均显著高于野生鼠。AMPKα2基因敲除鼠与野生鼠相比,安静对照组无显著差异,而无论是低强度跑台运动组,还是高强度跑台运动组骨骼肌 GLUT4基因表达量均显著低于野生鼠。
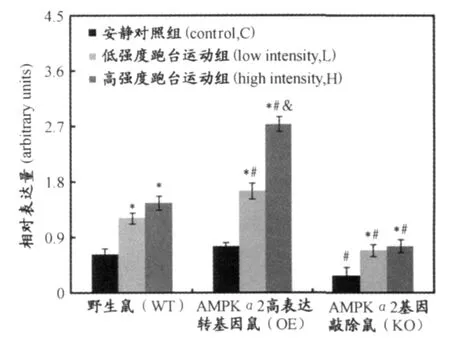
图8 本研究各组小鼠AMPKα(THR172)磷酸化水平图Fig 8 AMPKα-Thr172 Phosphorylation(P)Activity in Various G roups

图9 本研究各组小鼠骨骼肌细胞核内MEF2/GTUT4 DNA结合活性图Fig 9 Amount of MEF2A that w as Bound to the G lut4 Promoter in Various G roups
2.3 GLUT4基因表达
由图10看出,无论是野生鼠,AMPKα2高表达转基因鼠,还是AMPKα2基因敲除鼠,1 h不同强度跑台运动后,骨骼肌 GLUT4基因表达量与安静对照组相比均显著升高,野生鼠和AMPKα2基因敲除鼠高强度跑台运动组骨骼肌 GLUT4基因表达量与低强度跑台运动组无显著差异,AMPKα2高表达转基因鼠高强度跑台运动组骨骼肌GLUT4基因表达量显著高于低强度跑台运动组。AMPKα2高表达转基因鼠与野生鼠相比,安静对照组无显著差异,而无论是低强度跑台运动组,还是高强度跑台运动组,骨骼肌 GLUT4基因表达量均显著高于野生鼠。AMPKα2基因敲除鼠与野生鼠相比,无论是安静对照组,低强度跑台运动组,还是高强度跑台运动组,均无显著差异。
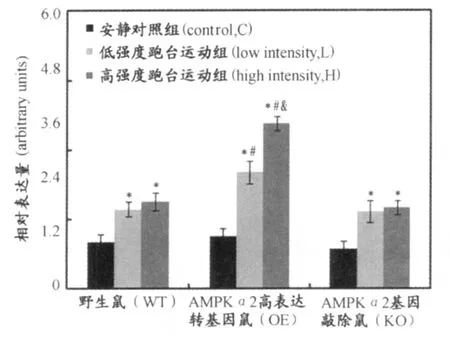
图10 本研究各组小鼠 G LUT4基因相对表达量图Figure 10. G LUT4 mRNA content in various groups
3 分析讨论
3.1 不同强度跑台运动对野生鼠骨骼肌MEF2/GLUT4 DNA结合活性及 GLUT4基因表达的影响
早在1994年,Liu ML等利用 GLUT4萤火素酶报告基因转染肌细胞,发现转染位于 GLUT4启动子区域,长度为103对(-522/-420)碱基片段,荧光素酶活性增加6倍,说明其片段对于 GLUT4的表达有着重要作用。通过进一步对此片段分析,发现-466/-457碱基(GCTAAAAATAG)和 MEF2 DNA结合位点相似,而突变这一位点的3个碱基(GCTAAGGCTAG),伴随着荧光素酶活性的消失[18]。这一发现在转基因鼠模型中得到了支持,Thai MV等的研究发现突变 GLUT4 DNA上MEF2结合位点(GCTGGGCCCAG),伴随着 GLUT4 mRNA表达的降低。通过电泳迁移法(EMSA),他们的研究进一步发现,链脲霉素诱导的糖尿病大鼠,由于骨骼肌 MEF2/GLUT4 DNA结合活性降低,GLUT4 mRNA含量下降。而用胰岛素刺激链脲霉素诱导的糖尿病大鼠骨骼肌细胞后,发现 MEF2/GLUT4 DNA结合活性恢复,而 GLUT4 mRNA含量恢复[33],提示了 MEF2/GLUT4 DNA结合活性的变化是影响 GLUT4基因转录的重要环节。
运动能够提高 GLUT4基因和蛋白的表达[1,9,16],那么运动对MEF2-GLUT4 DNA结合活性产生什么样的影响呢?同样利用 EMSA法,McGee SL等[21]的研究发现,7名受试者用(75±2)%˙VO2,自行车运动60 min后,MEF2/GLUT4 DNA结合活性增加了2倍,并伴随着GLUT4蛋白表达的增多,提示了运动可能通过提高MEF2/GLUT4 DNA结合活性而提高 GLUT4基因和蛋白表达。
值得注意的是,EMSA实验方法获得的结果是体外的目标蛋白和预期基因组DNA片段的结合结果,其不一定能真实地反映体内转录调控蛋白和DNA结合的状况。EMSA实验中,转录因子的DNA结合位点(顺式作用元件)可以和转录因子(反式作用因子)自由结合,而在体情况下,DNA是和组蛋白依靠静电力结合在一起,DNA和组蛋白的结合限制了转录因子和DNA结合位点的结合。事实上,在体情况下,转录因子和DNA结合位点的结合通常发生在辅因子修饰组蛋白(磷酸化,甲基化,乙酰化)染色质结构改变并暴露DNA结合位点之后[4]。本研究通过染色质免疫沉淀ChIP法(CHIP检测可以获得在体的目标蛋白和预期基因组DNA片段的结合结果)发现,野生鼠1 h不同强度跑台运动后 GLUT4基因表达量显著增加的同时伴随着MEF2/GLUT4 DNA结合活性的显著增加,为运动通过提高 MEF2 DNA结合活性而提高GLUT4表达提供了进一步的证据。
3.2 不同强度跑台运动对AMPK高表达转基因鼠骨骼肌MEF2/GLUT4 DNA结合活性及 GLUT4基因表达的影响
AMPK属于丝氨酸/苏氨酸蛋白激酶,能感知细胞能量代谢状态的改变,并通过影响细胞物质代谢的多个环节维持细胞能量供求平衡。它是一个异源三聚体蛋白,由α、β和γ3个亚单位组成,每个亚基都有不同的亚型,分别为α1、α2、β1、β2、γ1、γ2 和γ3。α亚单位是激酶的主要催化部位,负责将ATP的磷酸传递至目标蛋白,α亚单位中的数个位点(苏氨酸172、苏氨酸258、丝氨酸485等)均可被磷酸化。其中苏氨酸172位点是AMPK上游激酶(AMPKK)磷酸化的重要位点,它是 AMPK活性的关键[5],而β和γ亚单位则是该酶的调节成分。
作为细胞能量代谢变化的感受器,近年来离体实验发现,采用 AMPK的药理激活剂 AICAR激活 AMPK可以提高骨骼肌 GLUT4基因和蛋白[12,14,27,36]的表达,且AMPKα2基因敲除或AMPK亚基失火均能阻断 AICAR孵育诱导的 GLUT4含量增加[10,15]。Holmes BF等[11]的最新研究结果显示,通过 AICAR激活 AMPK可以提高MEF2/GLUT4 DNA结合活性,而提高骨骼肌 GLUT4基因和蛋白的表达。由于AMPK能够被运动中ATP/AMP比值变化所激活[7,32],提示了AMPK可能参与调节了运动诱导的MEF2/GLUT4 DNA结合活性和 GLUT4表达的增加。同样值得注意的是,这只是在离体实验中检测到的结果,其不一定能真实地反映体内转录调控蛋白和DNA结合的状况[4],而且,AICAR是介导嘌呤生物合成的物质,并非AMPK的特异激活剂[35],提示了这些结果可能具有一定的局限性。
本实验中,野生鼠1 h不同强度跑台运动后,骨骼肌AMPKα(THr172)磷酸化水平与安静对照组相比均显著升高,AMPKα2高表达转基因鼠与野生鼠相比,虽然安静对照组无显著差异,而无论是低强度跑台运动组还是高强度跑台运动组,骨骼肌 AMPKα(THr172)磷酸化水平均显著高于野生鼠,证明了本实验所设计的2种不同强度的运动方式,均成功激活了 AMPK,同时也说明了,在本实验设计的2种不同运动强度下,AMPKα2基因的高表达影响了AMPKα(THr172)磷酸化水平。而采用此2种不同强度运动方式,实验发现,AMPKα2高表达转基因鼠1 h不同强度跑台运动后,其骨骼肌细胞核内 MEF2/GLUT4 DNA结合活性及 GLUT4基因表达量,均比野生鼠增加更为显著,提示了 AMPKα2参与调节了运动诱导的MEF2/GLUT4 DNA结合活性及 GLUT4基因表达量的升高。而本实验中 AMPKα2高表达转基因鼠高强度跑台运动组 AMPKα(THr172)磷酸化水平,细胞核内MEF2/GLUT4 DNA结合活性及 GLUT4基因表达量均显著高于低强度跑台运动组,可能为此推测提供了进一步证据。
3.3 不同强度跑台运动对 AMPKα2基因敲除鼠骨骼肌MEF2/G LUT4 DNA结合活性及 GLUT4基因表达的影响
本实验中,虽然 AMPKα2基因敲除鼠1 h不同强度跑台运动后,骨骼肌 AMPKα(THr172)磷酸化水平与安静对照组相比均显著升高,但无论是安静对照组,低强度跑台运动组,还是高强度跑台运动组,AMPKα2基因敲除鼠,AMPKα(THr172)磷酸化水平均显著低于野生鼠,说明了在本实验设计的2种不同运动强度下,AMPKα2基因的敲除影响了 AMPKα(THr172)磷酸化水平。同样,采用此2种不同强度运动方式,实验发现,AMPKα2基因敲除鼠运动组骨骼肌细胞核内MEF2/GLUT4 DNA结合活性,显著低于野生鼠,进一步证明 AMPKα2参与调节了运动诱导的MEF2/GLUT4 DNA结合活性的增加。
另外实验发现,虽然 1 h不同强度跑台运动后AMPKα2基因敲除小鼠 MEF2/GTUT4 DNA结合活性均显著低于野生鼠,但与安静对照组相比,仍显著增加。近年来研究发现,组蛋白翻译后修饰可以通过改变真核细胞染色质基本结构单位核小体的结构影响基因转录[6,8]。调节组蛋白乙酰化程度的是一对供能相互拮抗的共抑制性和共激活性结合蛋白:组蛋白去乙酰化酶(histone deacetylases,HDACs)和组蛋白乙酰化酶(histone acetyl transferases,HATs)[23],其中 HDACs与转录因子结合,通过组蛋白 N端赖氨酰的去乙酰化,使组蛋白带正电荷,被吸引到带负电荷的DNA中,产生一种紧密的染色质结构,抑制转录因子所靶向的目标基因的转录[3]。相反,HATs和转录因子结合,使赖氨酰乙酸化移走它们的正电荷,从而导致开放的染色质结构,加速转录因子所靶向的目标基因的转录[34]。研究者发现,利用细胞钙离子调节子 Caffeine孵育骨骼肌细胞能提高钙离子的浓度、激活钙/钙调素依赖性蛋白激酶(calcium-calmodulin depen-dent protein kinase,CAMK),分离 HDACs与转录因子MEF2(分离结果是失去 HDACs对组蛋白N端赖氨酰的去乙酰化作用)并出核[2,20],提高MEF2 DNA结合活性[25,30],而这些变化在含有丹曲林(抑制细胞质钙离子浓度的增加)或 KN93(一种 CAMK活性的抑制剂)培养基中骨骼肌细胞中受到抑制[25,30,31],而运动同样引起细胞钙离子浓度增加并能够激活CAMK[29,30],推测CAMK也可能参与调节了运动诱导的 MEF2/GTUT4 DNA结合活性提高,但具体机制还有待进一步研究。
值得注意的是,虽然 1 h不同强度跑台运动后AMPKα2基因敲除小鼠 AMPKα活性均显著低于野生鼠,1 h不同强度跑台运动后 AMPKα2基因敲除小鼠MEF2/GTUT4 DNA结合活性显著低于野生鼠,但AMPKα2基因的缺失并不影响运动诱导的 GLUT4基因含量变化。Burton等的研究也发现,虽然AMPKα2基因敲除能阻断 AICAR孵育诱导的 GLUT4 mRNA含量增加,但野生型小鼠和 AMPKα2亚基失活小鼠(AMPKDN)经过6 h跑台运动(一次 3 h,间隔 1 h)后骨骼肌GLUT4 mRNA含量无显著性差异[13]。这些可能提示了,虽然AMPKα2对 MEF2/GTUT4 DNA结合活性有调节作用,但其并不是运动诱导 GLUT4基因和蛋白含量变化的唯一通路,运动还可以募集其他的信号通路调节GLUT4基因和蛋白含量变化。
有研究者发现,利用 Caffeine孵育激活骨骼肌细胞CAMK,上调 GLUT4基因和蛋白的表达,且这些变化在含有丹曲林或 KN93培养基中骨骼肌细胞中受到抑制[26],且用 AICAR和 Caffeine共同孵育骨骼肌细胞GLUT4 mRNA表达水平与使用单一的AICAR或 Caffeine孵育时的水平无显著性差异[17],提示 AMPK和CAMK介导的信号通路在调节骨骼肌 GLUT4表达过程中可能相互联系[24],由于运动能够激活 CAMK[29,30],推测 CAMK也可能参与调节了运动诱导 GLUT4表达的提高。但最新的研究结果显示,CAMK调节 GLUT4基因表达,同样是通过提高 MEF2/GLUT4结合活性[25,30,31]。虽然本实验并没有测小鼠骨骼肌CAMK的活性,而本实验中1 h不同强度运动后 AMPKα2基因敲除鼠 MEF2/GLUT4结合活性显著低于野生鼠,可能提示了本实验中1 h不同强度运动后 AMPKα2基因敲除鼠 GLUT4基因表达的增加并不是由CAMK调节,具体机制有待进一步研究。
4 结论
1.野生鼠1 h不同强度跑台运动后 GLUT4基因表达量显著增加的同时,伴随着 MEF2/GLUT4 DNA结合活性的显著增加,为运动通过提高MEF2 DNA结合活性而提高 GLUT4表达提供了进一步的证据。
2.AMPKα2高表达鼠 1 h不同强度跑台运动后,AMPKα(THr172)磷酸化水平显著高于野生鼠,MEF2/GLUT4 DNA结合活性,GLUT4基因和蛋白表达量均显著高于野生鼠,提示了“运动-AMPK激活-核内 MEF2表达增多-MEF2/GLUT4 DNA结合活性增加-GLUT4基因表达增多”这样一条通路的存在。
3.AMPKα2基因敲除小鼠和野生鼠相比,虽然 1 h不同强度跑台运动后 AMPKα(THr172)磷酸化水平及MEF2/GLUT4 DNA结合活性均显著低于野生鼠,但AMPKα2基因的缺失,并没有影响运动诱导的 GLUT4基因含量变化,提示了在 AMPKα2基因缺失情况下,运动还可以募集其他的信号通路 GLUT4基因和蛋白含量的调节作用。
[1]龚豪杰,陈大鹏,张楠,等.不同强度运动对AMPKα2基因敲除小鼠骨骼肌葡萄糖转运体4表达的影响[J].中国运动医学杂志,2010,29(4):467-471.
[2]龚豪杰,张楠,姚璐,等.低氧、低氧训练对AMPKα2三种不同基因状态鼠骨骼肌 GLUT4表达及肌糖原含量的影响[J].体育科学,2010,30(5):41-48.
[3]BACKS J,OLSON E N.Control of cardiac growth by histone acetylation/deacetylation[J].Circ Res,2006,98:15-24.
[4]BEATO M,EISFELD K.Transcription factor access to chromatin[J].Nucleic Acids Res,1997,25:3559-3563.
[5]BOUDEAU J,BAAS A F,DEAK M,et al.MO25α/βinteract with STRADα/βenhancing their ability to bind,activate and localize L KB1 in the cytoplasm[J].EMBO J,2003,22:5102-5114.
[6]BROWNELL J E,ALLIS C D.Special HATs for special occasions:linking histone acetylation to chromatin assembly and gene activation[J].Curr Opin Genet Dev,1996,6:176-184.
[7]CHEN Z P,STEPHENS T H,MURTHY S,et al.Effect of Exercise Intensity on Skeletal Muscle AMPK Signaling in Humans[J].Diabetes,2003,52:2205-2212.
[8]GRUNSTEIN M.Histone acetylation in chromatin structure and transcription[J].Nature,1997,389:349-352.
[9]GULVE E A,SPINA R J.Effect of 7-10 days of cycle ergometer exercise on skeletal muscle GLUT4 protein content[J].J Appl Physiol,1995,79:1562-1566.
[10]HOLMES B F,LANG DB,BIMBAUM MJ,et al.AMP kinase is not required for the GLUT4 response to exercise and denervation in skeletal muscle[J].Am J Physiol Endocrinol Metab,2004,287:E739-E743.
[11]HOLMES B F,SPARLINGD P,OLSON A L,et al.Regulation of muscle GLUT4 enhancer factor and myocyte enhancer factor 2 by AMP-activated protein kinase[J].Am J Physiol Endocrinol Metab,2005,289:E1071-E1076.
[12]HOLMES B F,KURTH-KRACZEK E F,WINDER W W.Chronic activation of 5’-AMP-activated protein kinase increases GLUT-4,hexokinase,and glycogen in muscle[J].J Appl Physiol,1999,87:1990-1995.
[13]HOLMES B F,LANGD B,BIMBAUM M J,et al.AMP kinase is not required for the GLUT4 response to exercise and denervation in skeletal muscle[J].Am J Physiol Endocrinol Metab,2004,287:E739-E743.
[14]J ESSEN N,POLD R,BUHL E S,et al.Effects of AICAR and exercise on insulin-stimulated glucose uptake,insulin signaling and GLUT4 content in rat skeletal muscles[J].J Appl Physiol,2002,94:1373-1379.
[15]JORGENSEN S B,TREEBAK J T,VIOLLETB,et al.Role of AMPK{alpha}2 inbasal,training-,andAICAR-induced GLUT4,hexokinaseⅡ,and mitochondrial protein expression in mouse muscle[J].Am J Physiol Endocrinol Metab,2007,292:E331-E339.
[16]KRANIOU Y,CAMERON-SMITH D,MISSO M,et al.Effects of exercise on glut4 and glycogenin gene expression in human skeletal muscle[J].J Appl Physiol,2000,88(2):794-796.
[17]LI L G,CHEN H Q.Coordinate regulation of contraction signal-induced GLUT4 transcription by CAMK and AMPK pathways in cultured skeletal muscle cells[J].Progress in biochemistry and biophysics,2009,36(4):471-479.
[18]LIU M L,OLSON A L,EDGINGTON N P.Myocyte enhancer factor-2(Mef2)binding-site is essential for C2C12 myotubespeci?c expression of the rat Glut4 muscle-adipose facilitative glucose-transporter gene[J].J Biol Chem,1994,269:28514-28521.
[19]LIVAK KJ,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ddCT method[J].Methods,2001,25:402-408.
[20]LU J,MCKINSEY T A,NICOL R L,et al.Signal-dependent activation of the MEF2 transcription factor by dissociation from histone deacetylases[J].Proc Natl Acad Sci USA,2000,97:4070-4075.
[21]MCGEE S L,SPARLING D,OLSON A L,et al.Exercise increases MEF2-and GEF DNA-binding activities in human skeletal muscle[J].FASEB,2006,20(2):348-349.
[22]MCKINSEY T A,ZHANG C L,LU J,et al.Signal-dependent nuclear export of a histone deacetylase regulates muscle differentiation[J].Nature,2000,408:106-111.
[23]MCKINSEY T A,ZHANG C L,OLSON E N.Control of muscle development by dueling HATs and HDACs[J].Curr Opin Genet Dev,2001,11(5):497-504.
[24]MUGIA M,J ENSEN T E,CUSINATO M,et al.Multiple signaling pathways redundantly control glucose transporterGLUT4 gene transcription in skeletal muscle[J].J Physiol,2009,587:4319-4327.
[25]MU KWEVHO E,KOHN T A,LANG D,et al.Caffeine induces hyperacetylation of histones at the MEF2 site on the Glut4 promoter and increases MEF2A binding to the site via a CaMK-dependent mechanism[J].Am JPhysiolEndocrinol Metab,2008,294:E582-E588.
[26]OJU KA E O,JONES T E,NOL TE L A,et al.Regulation of glut4 biogenesis in muscle:evidence for involvement of AMPK and Ca2+[J].Am J Physiol Endocrinol Metab,2002,282(5):E1008-E1013.
[27]OJU KA E O,NOL TE L A,HOLLOSZYJ O.Increased expression of GLUT-4 and hexokinase in rat epitrochlearis muscles exposed to AICAR in vitro[J].J Appl Physiol,2000,88:1072-1075.
[28]OLSON A L,PESSIN J E.Transcriptional regulation of the human Glut4 genepromoter in diabetic transgenic mice[J].J Biol Chem,1995,270:23491-23495.
[29]ROSE A G,HARGREAVES M.Exercise increases Ca2+-calmodulin-dependent protein kinase II activity in human skeletal muscle[J].J Physiol,2003,553:303-309.
[30]SMITH J A,COLLINS M,GROBLER L A,et al.Exercise and CaMK activation both increase the binding of MEF2A to the Glut4 promoter in skeletal muscle in vivo[J].Am J Physiol Endocrinol Metab,2007,292:E413-E420.
[31]SMITH J A,KOHN T A,CHETTY A K,et al.CaMK activation during exercise is required for histone hyperacetylation and MEF2A binding at the MEF2 site on the Glut4 gene[J].Am J Physiol Endocrinol Metab,2008,295:E698-E704.
[32]STEPHENS T J,CHEN Z P,CANNY B J,et al.Progressive increase in human skeletal muscle AMPK alpha2 activity and ACC phosphorylation during exercise[J].Am J Physiol Endocrinol Metab,2002,282(3):E688-E941.
[33]THAI M V,GURUSWAMY S,CAO K T,et al.Myocyte enhancer factor 2(MEF2)-binding site is required for GLUT4 gene expression in transgenic mice.Regulation of MEF2 DNA binding activity in insulin-deficient diabetes[J].J Biol Chem,1998,273:14285-14292.
[34]WU H,OLSON E N.Activation of the MEF2 transcription factor in skeletal muscles from myotonic mice[J].J Clin Invest,2002,109:1327-1333.
[35]YOUNG M E,RADDA G K,LEIGHTON B.Activation of glycogen phosphorylase and glycogenolysis in rat skeletal muscle by AICAR-an activator of AMP-activated protein kinase[J].FEBS Lett,1996,382:43-47.
[36]ZHENG D,MACLEAN P S,POHNERT S C,et al.Regulation of muscle GLUT-4 transcription by AMP-activated protein kinase[J].J Appl Physiol,2001,91:1073-1083.
Effects of Exercise with Different Intensity on the Content of MEF2A Bounding to the G LUT4 Promoter in Skeletal Muscle of AMPKα2-WT/KO/OE Mice
GONG Hao-jie,XIE Jin,ZHANG Nan,YAO Lu,ZHANG Ying
目的:研究不同强度跑台运动对 AMPKα2三种不同基因状态鼠 MEF2/GLUT4 DNA结合活性及 GLUT4基因表达的影响,以探讨运动提高骨骼肌MEF2/GLUT4 DNA结合活性及 GLUT4基因表达可能机制。方法:野生小鼠和AMPKα2高表达转基因小鼠,AMPKα2基因敲除小鼠各30只,分别随机分为安静对照组、低强度(12m/min)跑台运动组和高强度(20/min)跑台运动组。运动时间均为1 h。运动后3 h取材。Western blot法测定AMPK(THr72)磷酸化水平。CHIP法测定 MEF2/GLUT4 DNA结合活性。Real-Time PCR法测定 GLUT4 mRNA含量。结果:1)野生鼠1 h不同强度跑台运动后,GLUT4基因表达量显著增加的同时,伴随着骨骼肌核内MEF2/GLUT4 DNA结合活性的显著增加;2)AMPKα2高表达转基因鼠1 h不同强度跑台运动后,其骨骼肌细胞核内MEF2/GLUT4 DNA结合活性及 GLUT4基因表达量,均比野生鼠增加更为显著;3)AMPKα2敲除鼠1 h不同强度跑台运动后,骨骼肌核内 MEF2/GLUT4 DNA结合活性显著低于野生鼠,但 GLUT4基因表达量与野生鼠相比没有显著差异。结论:1)运动通过提高MEF2/GLUT4 DNA结合活性而提高 GLUT4表达;2)AMPKα2参与调解了运动诱导的MEF2/GLUT4 DNA结合活性及 GLUT4基因表达量的升高;3)虽然 AMPKα2参与调节了运动诱导的MEF2/GLUT4 DNA结合活性的提高,但机体还可以募集其他的信号通路代偿AMPKα2对 GLUT4表达的调节作用。
AMPKα2高表达转基因小鼠;AMPKα2基因敲除小鼠;MEF2;GLUT4;动物实验
Purpose:The role of AMPK in regulating the exercise induced MEF2A binding to the GLUT4 promoter,andGLUT4 mRNA expression was investigated.Methods:Wild-type(WT;n=30),AMPKα2 over-expression(OE;n=30),and AMPKα2 knockout(KO;n=30)C57/BL mice were randomly divided into three groups:control group,low-intensity(12m/min)group and high-intensity(20m/min)group.Mice were killed after 3h of treadmill running completed by 60 min of continuous running on the experimental day.1)AMPKα-Thr172 phosphorylation by western blot.2)Total and nuclear MEF2A by western bolt.3)Bound MEF2A at the GLUT4 MEF2 cis-e,m lement by CHIP.4)GLUT4 expression by Real Time-PCR and Western blot.Results:Over-expression of AMPKα2,which was associated with higher AMPKα-P in exercise muscles,heightens the exercise-induced increase in MEF2A binding to the GLUT4 promoter and GLUT4 mRNA expression.Exercise-induced increases of GLUT4 mRNA expression,were normal inα2-KO muscles despite the reduced AMPK signaling and GLUT4 promoter-bound MEF2A.Conclusion:1)Exercise increases Glut4 expression by increase the binding of MEF2A to the Glut4 promoter.2)Exercise increases the binding of MEF2A to their binding sites on the Glut4 gene by an AMPK-dependent mechanism.3)AMPK activity during exercise is not indispensable for expression of GLUT4.
A M P Kα2over-ex pression mouse;A M P Kα2knockout mouse;M EF2;GLU T4
G804.7
A
1000-677X(2011)02-0055-09
2010-10-31;
2011-01-10
北京市自然科学基金(5102024);国家自然科学基金(30971412)资助。
龚豪杰(1986-),男,河南漯河人,在读硕士研究生,主要研究方向为运动和骨骼肌代谢,E-mail:haojie1013101310@163.com;张缨 (1961-),女 ,北京人 ,教授,博士,主要研究方向为运动和骨骼肌代谢;E-mail:zhyi9256@126.com。
Beijing Sport University,Beijing 100084,China.
