间歇运动对自发性高血压大鼠的心功能及心肌IMD受体系统的影响
2011-09-28刘向辉郝选明
刘向辉,郝选明
间歇运动对自发性高血压大鼠的心功能及心肌IMD受体系统的影响
刘向辉1,郝选明2
1 前言
由于以前多数研究认为,间歇运动对高血压患者可能存在不安全、不可行,甚至不能耐受的情况而在实践中很少应用,但最近的流行病学研究、实验研究、临床研究都证实,间歇运动尤其是高强度间歇运动会产生比中低强度的持续运动更有效的强心作用[8]。Helgerud J等[9]研究发现,间歇运动可显著提高冠心病患者最大耗氧量与最大每搏输出量,其效果好于力量练习。Ericsson M等[10]研究发现,间歇运动能增强心功能。间歇运动是心血管疾病安全有效的运动干预方式,已得到大量研究资料的证实[11]。但间歇运动降血压效应的生理机制还不清楚,有关如何设置高血压患者的适当运动负荷的指导方针还没有确定。垂体中叶素(intermedin,IMD)是2004年发现的降钙素基因相关肽(CGRP)超家族的新成员,具有舒张血管、降低血压和增强心肌收缩力的作用,并可保护缺血心肌,在高血压的发生发展及防治中具有重要的意义及临床应用前景。吴红梅等[1]报道了IMD及其受体系统对高血压的病理生理起到重要的调控作用。因此,本研究观察了间歇运动对自发性高血压大鼠的血压及心血管组织 IMD及其受体系统的影响,试图探讨 IMD对间歇运动的适应性变化及其在自发性高血压大鼠的运动降血压效应中的作用,为高血压患者选择更合理的运动方式进行康复训练提供参考。
2 材料与方法
2.1 材料
2.1.1 实验动物与分组
选用 11周龄雄性 Spontaneously Hypertensive Rat(SHR)大鼠(250~300 g)20只,随机分为 2组,间歇运动组(IE组)、对照组(CR组),每组10只。均由中南大学实验动物部提供。上述动物均为检验合格动物,常规条件下饲养,自由进食和饮水,室内温度为22℃~24℃,湿度为40%~60%,定期紫外灯消毒。运动组在最后1次运动的24 h后处死,处死前禁食12 h,但自由饮水。
训练造模:采用游泳训练方式。游泳条件:塑钢游泳池,150×60×70 cm,水深为大鼠身体长度的2倍,水温保持在33℃~36℃之间。正式训练前,大鼠进行3天适应性游泳训练,每天1次,时间依次分别15 min、20 min、30 min,随后开始正式的游泳训练,连续训练10周,每周6次。间歇运动组(IE组):负自身体重5%的重物游泳,每游6 min休息4 min,每天连续进行10组,每日1次;对照组(CR组)不进行任何训练,常规饲养。
2.1.2 主要试剂
IMD放射免疫药盒购自美国 Phoenix Pharmaceuticals,Inc公司。羊抗大 鼠 CRLR、β-actin,兔抗大鼠RAMP1、RAMP2和 RAMP3抗体均购于 Santa Cruz Biotechnology,Inc。Trizol、ECL发光液购于普利莱基因技术有限公司。dNTP购自 Clontech公司,M-MLV逆转录酶、Taq酶、oligo(dT)15 Primer为 Promega公司产品。PCR引物由奥科生物技术有限公司合成,其中 IMD引物由赛百盛公司合成(表1)。余为市售分析纯产品。
2.2 方法
2.2.1 血压和心功能的测定[2]
调试好生物机能试验系统(成都泰盟科技有限公司,BL-420E)。IE组间歇运动10周后与CR组雄性SHR各10只,以1%戊巴比妥钠(40 mg/100 g)腹腔麻醉,固定于手术台上,剪毛消毒然后于颈部正中做一个0.7~1 cm切口,分离出右侧颈总动脉;将动脉导管(PE50专用管)向心脏方向插入1.5cm(导管内至换能器圆帽内充满0.3%肝素),结扎固定导管;通过BL-420 E生物医学记录系统测量描记动脉血压30 min后将导管插入心室,记录心室内压30 min(记录心室内压同时观察心室内压上升速率);具体指标包括:收缩压、舒张压、左心室收缩压(LVSP)、左心室舒张压(LVDP)、左心室压力上升和下降最大速率(+LVdP/dtmax,-LVdP/dtmax)、心率(HR)。
2.2.2 心肌总 RNA的提取和 IMD、CRLR及 RAMPs mRNA水平的测定
取心尖组织约10 mg,用 Trizol一步法提取总 RNA。MMLV逆转录酶及Oligo(dT)15 primer逆转录成单链cDNA。测定 IMD mRNA含量的 PCR总反应体积10μl:cDNA 1μl,5 pmol/L的 IMD-S及 IMD-A引物 0.5μl,2.5 mmol/LdNTP 0.5μl,含 15 mmol/L MgCl2的 10 ×PCR缓冲液1μl,Taq DNA聚合酶0.5IU。反应条件:94℃变性4 min,然后以 94℃30 s,60℃45 s,72℃35 s;延伸72℃10 min,热循环33次。PCR产物以1.2%琼脂糖电泳分离和溴乙锭(ethidiumbromide,EB)染色后,用凝胶成像及分析扫描仪测得297 bp条带。IMD mRNA/βactin mRNA的比值即为 IMD mRNA的相对含量。重复3次独立试验。CRLR和 RAMP1、RAMP2、RAMP3 mRNA含量的测定与 IMD mRNA的测定相似,PCR反应条件见表1[12]。
2.2.3 Western blot测定心肌 IMD及其受体 CRLR、RAMP1-3的蛋白含量
取适量心肌加入组织裂解液(20 mmol/L 7.4 Tris HCl,1mmol/L EDTA)制备匀浆液,用Bradford法提取总蛋白100μg进行 SDS-PAGE电泳分离,电转移至硝酸纤维素膜,用含5%脱脂奶粉的 TBST(20 mmol/L Tris/HCl,p H7.5,0.05%Tween 20,0.6%NaCl)室温下封闭1 h,分别与羊抗 CRLR抗体(1∶400)、羊抗β-actin抗体(1∶1000)、兔抗大鼠 RAMPs抗体(RAMP1为1∶500,RAMP2为1∶400,RAMP3为1∶400)4℃孵育过夜后,加入二抗后于室温孵育1 h。将膜加入 ECL后,曝光、显影。结果用专业软件NIH Image分析灰度值定量[3]。
2.2.4 血浆IMD的放射免疫测定
取腹主动脉血 2 ml,注入 10%EDTA二钠 30μl和抑肽酶 40μl(0.6 TIU/ml)的试管中混匀,离心(3 500 rpm,10 min,4℃)后分离血浆备用或-70℃待测。测定时,冻存样本复溶,各取样品100μl按 IMD放射免疫试剂盒说明书操作测定。IMD放射免疫的 IC50为34.80 pg/管,敏感区为2~256 pg/管,IMD多克隆抗体与大鼠IMD交叉反应性为100%,与大鼠ADM、CGRP等均无交叉反应[12]。
2.3 统计学处理
采用 GraphPad Prism 4.0软件中One-way ANOVA进行单因素多组间资料分析,结果以±SD表示,2组数据间差异用 Student’s t-test检验,两变量间线性关系用Correlation。以 P<0.05为统计学显著性差异,P<0.01表明差异具有高度显著性。
作者单位:1.邵阳学院体育系,湖南邵阳422000;2.华南师范大学体育科学学院,广东广州510006

表1 IMD、CRLR、RAMP1、RAMP2、RAMP3和β-actin引物序列及反应条件一览表Table 1 Primers and Reaction Conditions of IMD、CRLR、RAMP1、RAMP2、RAMP3 andβ-actin
3 结果
3.1 两组SHR血压和心功能指标的比较
IE组的收缩压、舒张压与对照组比较,分别要低13.7%、12.06%(P<0.05);IE 组 的 HW/BW、-dp/dt、LVSP、LVDP与对照组相比,也都分别下降了 27.6%、21.4%、14.4%和 14.2%(P<0.05)(表2)。
表2 两组SHR血压和心功能指标的比较一览表Table 2 Comparson of Blood Pressure and Cardiac Function of Two G roups SHR (n=10,±SD)
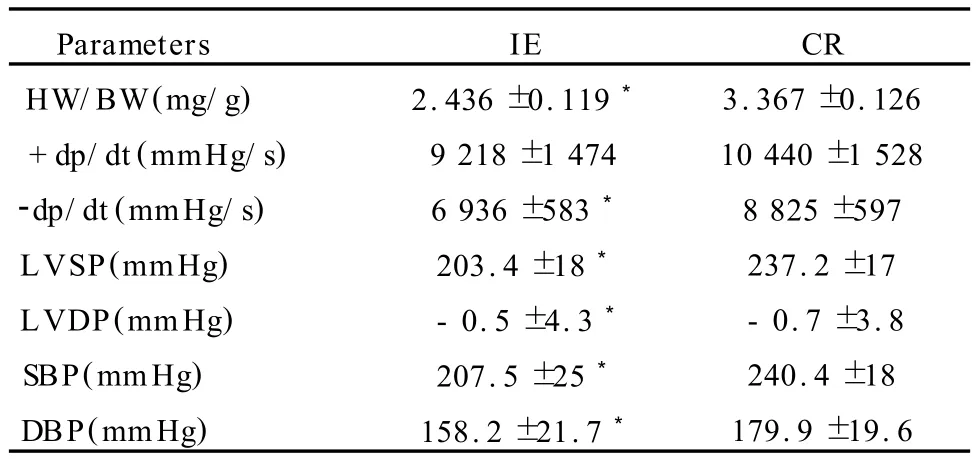
表2 两组SHR血压和心功能指标的比较一览表Table 2 Comparson of Blood Pressure and Cardiac Function of Two G roups SHR (n=10,±SD)
注:HW:心重;BW:体重;*与对照组相比 P<0.05。下同。
Parameters IE CR HW/BW(mg/g) 2.436±0.119* 3.367±0.126+dp/dt(mmHg/s) 9 218±1 474 10 440±1 528-dp/dt(mmHg/s) 6 936±583* 8 825±597 LVSP(mmHg) 203.4±18* 237.2±17 LVDP(mmHg) -0.5±4.3* -0.7±3.8 SBP(mmHg) 207.5±25* 240.4±18 DBP(mmHg) 158.2±21.7* 179.9±19.6
3.2 运动组SHR血浆中 IMD的含量升高
运动组和对照组 SHR血浆中 IMD的含量分别为(323.6±33.56)、(271.2±25.19)ng/L,差异有统计学意义(P<0.05)。
3.3 运动组 SHR心肌中 IMD、CRLR、RAMP1-3的mRNA水平上调
如图1所示,运动组 SHR心肌中 IMD、CRLR、RAMP1-3的 mRNA的水平比对照组均显著提高(均 P<0.05);且在心肌组织中,IMD与其受体系统 CRLR、RAMP1、RAMP2、RAMP3 mRNA均存在明显相关性:r=0.8109,0.8579,0.8983,0.7852(均 P<0.05)。

图1 运动组与对照组SHR心肌 IMD、CRLR、RAMP1-3 mRNA相对含量图(n=6)Figure 1 Relative content of myocardial IMD,CRLR,RAMP1-3 mRNA of two groups
3.4 运动组 SHR心肌中 IMD、CRLR、RAMP1-3的蛋白表达增加
如图2所示,运动组 SHR心肌中 IMD、CRLR、RAMP1、RAMP3的蛋白表达比对照组均显著提高(均 P<0.05);而 RAMP2蛋白表达增加更显著(P<0.01)。
3.5 两组SHR血浆中IMD的含量和各种指标之间的相关性
由表3可见,运动组SHR血浆IMD含量与收缩压、心重/体重及其受体蛋白水平之间均呈显著正相关(P<0.05);但对照组SHR血浆IMD含量与收缩压呈显著的负相关(P<0.05),与心重/体重及其受体蛋白水平之间同样都呈正相关(P<0.05)(表3)。

表3 两组SHR血浆IMD含量与血压及其受体蛋白水平之间的相关性一览表(相关系数r)T able 3 Correlation of Plasma IMD and Blood and Receptor Protein of Two G roups SHR(r)
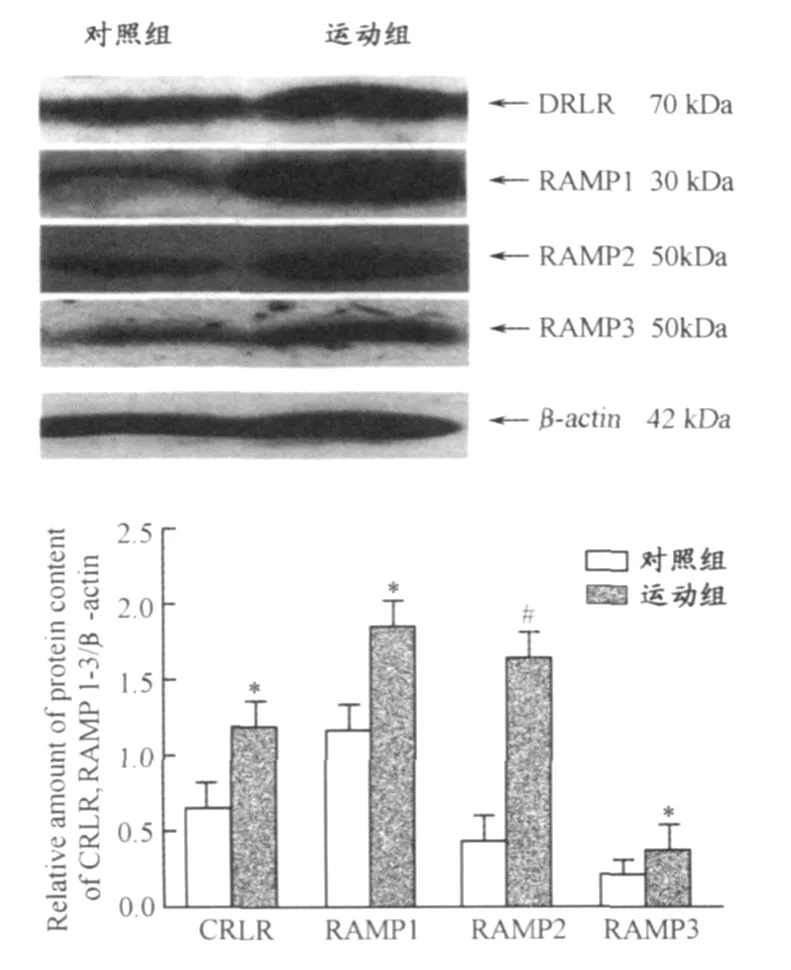
图2 运动组与对照组SHR心肌IMD、CR LR、RAMP1-3蛋白表达图(n=4)Figure 2 Protein expression of myocardial IMD,CR LR,RAMP1-3 of two groups
4 讨论
4.1 间歇运动是高血压运动干预的有效方式
间歇运动是高血压病安全有效的运动干预方式,已得到了大量研究资料的证实[11],但有关如何设置适当的运动负荷的特殊的指导方针还没有确定,Ziemann E等研究了运动与休息比率为1∶2的间歇运动对机体有氧能力与无氧能力的影响,结果发现这种训练方案可以迅速恢复并能有效提高机体的最大运动能力(Functional Capacity)。Hansen D等[13]的分析表明,改变运动模式可以获得更大的临床效果,发现间歇运动对心脏病人的最大耗氧能力的影响更加显著。Ericsson M等[9]研究发现,预先进行间歇运动的大鼠可明显减缓因肌质网Ca2+-ATP酶基因敲除所致的心脏功能下降,认为间歇运动增强心功能的机制可能是通过肌质网Ca2+-ATP酶活性的改变来实现的。间歇运动是一种有效率的方式,即使在较低的负荷量时也可以产生与传统的持续耐力运动一样的骨骼肌代谢方面的适应性变化,2周内6次高强度间歇训练或者总计大约相当于15 min的非常激烈的运动(约600 KJ)就能够增强骨骼肌的氧化能力和耐力水平,并在有氧练习的基础上改变骨骼肌的代谢控制能力[14]。Little J P等[15]研究结果证实了低负荷高强度间歇运动的练习模式是提高骨骼肌线粒体功能与运动能力有效的方法,人体骨骼肌线粒体对间歇运动的适应性变化包括了SIRT1、线粒体转录因子A(Tfam)、核过氧化物酶体增殖物活化受体α的共活化物(PGC-1α)的增加。人体 PGC-1α急性上调的大多数研究采用的是长期的运动干预,但是,最近 Gibala M[16]的研究令人惊奇地发现,小负荷高强度间歇运动(全力运动 30 s,休息 4 min,重复4次)就足以让PGC-1αmRNA在恢复期内表达增加,间歇运动能迅速增强 PGC-1α与线粒体基因表达的信号通路的活性,包括AMP活化蛋白激酶(α1和α2亚单位)、p38丝裂原活化蛋白激酶。因而AMPK和MAPK p38与 PGC-1α的信号通路可以在一定程度上说明间歇运动的代谢适应性变化是部分通过细胞信号介导的,这也从细胞信号传导方面阐述了间歇运动的代谢适应性变化,这也是间歇运动成为高血压运动康复有效手段的重要的生理基础,但目前还未见间歇运动的降血压效应生理机制的研究报道。
4.2 IMD与高血压
IMD与肾上腺髓质素2(adrenomedullin2,ADM2)的核苷酸和氨基酸序列完全相同,被认为是同一物质,是近来发现的降钙素/降钙素基因相关肽(CGRP)超家族新成员[17,18]。CGRP超家族成员中包括降钙素、CGRP、肾上腺髓质素(ADM)和胰岛淀粉样多肽[19]。IMD与超CGRP家族中的CGRP和ADM等有共同的受体,IMD可以与标记的CGRP竞争性地与受体结合[17],这些受体包括降钙素受体(CTR)和降钙素受体样受体(CRLR)。CGRP超家族成员都可以用CRLR作为其受体成分,但单独表达CRLR并不与CGRP和ADM结合,也不产生任何效应。它需要一组称为受体活性修饰蛋白(RAMPs)的协同才起作用。RAMP分为 RAMP1、RAMP2和RAMP3。不同的 RAMP与CRLR结合,表现为对不同配体具有高亲和的受体表型,从而决定了其在体内的生物学效应,其中,RAMP1与 CRLR共同作用表达为 CGRP受体表型;RAMP2与CRLR共同作用表达为ADM受体表型[18]。IMD的受体也是 RAMPs/CRLR结合的复合物,但是,它与CGRP和ADM的不同点在于,它可以非选择性地通过 RAMP1/CRLR、RAMP2/CRLR、RAMP3/CRLR中任何一个受体表型发挥其生理作用,这就意味着,从理论上说 IMD作为活性多肽在机体内也不易因“失敏”而失去生物活性,它将发挥更加强大和广泛的心血管调节作用。
IMD主要分布于下丘脑-垂体系统,在心脏也有广泛分布[23]。目前的研究表明,IMD在中枢神经系统和心血管系统的各种细胞中均有表达,对心血管系统有强大的生理作用,具有舒张血管、降低血压、升高心率、增加冠脉流量和对心脏的正性肌力等生物学效应[21]。有研究表明,在一氧化氮合酶抑制剂左旋硝基精氨酸诱导的大鼠高血压和心肌肥大模型上,IMD及其受体成分表达均明显上调,说明 IMD在高血压心肌肥厚的病理过程中发挥了重要作用[22]。吴红梅等[1]报道了 IMD及其受体系统在高血压发病机制方面有着重要的作用,对高血压的病理生理起到重要的调控作用。IMD在调节心血管稳态等多方面具有重要的作用[23,24],还参与缺血再灌注损伤、氧化应激、高血压、心肌重塑等病理生理过程[4,16,25,26]。已有研究证实,给动物静脉注射 IMD1-47有强烈的降低血压和提高心率的作用,而且,这种降压作用强于ADM[17],然而,脑室内注射 IMD1-47则剂量依赖性地增加平均动脉血压和心率[25]。马俐华等[5]观察了 IMD对血管紧张素Ⅱ(AngⅡ)刺激血管平滑肌细胞(VSMCs)增殖的影响,结果说明,IMD可以抑制 AngⅡ诱导 VSMCs引起的增殖,保持 VSMCs的收缩特性,从而完成其扩张血管,进而降低血压的作用,且 IMD对离体 VSMCs的作用是随着 IMD浓度的增加,其抑制增殖作用增强。而且,给自发性高血压大鼠注射 IMD1-47也产生同样的降压效果[17]。Yang等[23]在离体大鼠灌流实验中发现,IMD1-53具有明显的正性变力效应。以上结果提示,IMD可能是一种调节心脏功能有关的心血管活性因子[26]。为此,笔者研究了连续10周的间歇运动对 SHR心肌组织IMD及其受体系统的影响与其降血压效应的相关关系,试图探讨 SHR的 IMD及其受体系统对间歇运动的适应性变化及其在降血压效应中的作用。
4.3 IMD对间歇运动的适应性变化
随着分子生物学技术的运用,人们对高血压发病机制的研究已发展到分子水平。探讨组织和器官内部物质血管活性肠肽、降钙素基因相关肽等活性物质及其信号转导途径在其发病过程中所发挥的作用已成为又一研究热点。然而,在运动医学领域,间歇运动(作为一种特殊典型的应激源)是否可以使自发性高血压大鼠心血管组织中IMD及其受体系统发生变化还未见报道。本研究观察了连续10周的间歇运动后 SHR大鼠的收缩压、舒张压比对照组分别要低13.7%、12.06%(P<0.05);运动组的 HW/BW、-dp/dt、LVSP、LVDP 与对照组相比 ,也都分别下降了 27.6%、21.4%、14.4%、14.2%(P<0.05),且这种变化与 SHR大鼠血浆 IMD水平呈显著正相关。本实验研究的结果显示,对照组 SHR的收缩压(SBP)越高,其血浆 IMD则相对较低,即 IMD与 SBP成负相关,与吴红梅等[1]的研究结果是一致的(可能是由于高血压状态出现了IMD的失代偿,具体机制目前还不清楚),然而,运动组SHR的血浆 IMD比对照组升高,却在运动组内出现了 SBP越高,血浆 IMD则越高的现象,即运动组SBP与IMD成正相关,推测这可能是由于高血压与运动干预共同作用的结果,提示间歇运动对于自发性高血压大鼠有良好的降压效应,且对于心肌功能的改善也具有良好的作用,并认为这种降血压效应与正性肌力效应可能是血浆 IMD的生理调节作用的结果。由此本实验首先从动物实验的角度证实,间歇运动也是高血压患者有效的运动干预方式。
目前,对于 IMD和 CRLR/RAMPs的变化在各种各样心血管疾病中已经开始了广泛的研究。但 IMD调节动脉血压的具体机制目前尚未完全阐明,文献报道 IMD在孵育的血管组织可上调NOS/NO系统[6]。有研究认为,IMD1-53增强心功能的作用可由cAMP途径介导[7,27]。为此本研究观察了连续10周间歇运动后 SHR大鼠心肌组织中IMD及其受体系统的运动适应性变化,发现运动后SHR血浆中IMD含量较对照组SHR明显升高,在心肌组织中 IMD mRNA水平也明显增加,且与SHR大鼠的血压变化明显相关,提示 IMD基因表达上调可能是间歇有氧运动引起SHR血浆 IMD含量增加的主要原因,且IMD可能参与了 SHR大鼠的运动降血压效应的调节过程。这也提示机体血压的变化可能受血浆IMD的调控,高血压状态下,由于调节通路的障碍及机体某种器官损伤,从而导致了 IMD的绝对或相对不足,而且,随着血压的升高和病理损伤过程的加重,这种失代偿状态更加严重。IMD被认为是具有多种心血管作用的内源性的心肾保护因子[28,29]。本研究同时观察了连续10周间歇运动后SHR心肌组织IMD及其受体系统-CRLR、RAMP1、RAMP2和 RAMP3 mRNA水平上调,且与 IMD mRNA水平与其受体系统-CRLR、RAMP1、RAMP2和RAMP3 mRNA水平呈显著正相关;另外,研究中还发现连续10周间歇运动后 SHR心肌组织 IMD的受体系统-CRLR、RAMP1、RAMP2和 RAMP3的蛋白表达也明显升高,与 IMD mRNA水平变化一致,且运动组 SHR主动脉中的CRLR、RAMP1、RAMP2的蛋白水平与其血浆中IMD的含量呈显著正相关,提示长期的间歇运动在高血压疾病状态时诱导了 IMD高水平表达,并参与了CRLR和RAMPs基因的表达调节,它可以非选择地通过CRLR/RAMP1、CRLR/RAMP2和 CRLR/RAMP3受体复合体发挥作用,很可能是高血压运动降血压的重要的调控机制之一。由此推测,IMD是通过 RAMP1/CRLR、RAMP2/CRLR和 RAMP3/CRLR中任何一个受体表型发挥其生理作用,促使细胞内第二信使cAMP含量的释放增加,从而来调节血压变化和执行心肌保护作用的。IMD与RAMP1同时上调,提示 IMD与 CGRP一样具有抗心肌缺血的作用[30、31],提示长期间歇运动增强 IMD及其受体系统的表达水平对于改善高血压心脏功能、促进康复效果具有重要的意义。
这些结果表明,IMD及其受体系统在研究高血压及心肌肥厚的发病机理方面有着重要的作用,为预防和治疗高血压提供了新的思路。探讨在自发高血压大鼠降压效应中的作用,及高血压运动降血压的分子机制对于我们正确理解高血压运动干预的本质,提高防治高血压的效果具有重要的意义。由于其受体表达及其信号传导机制的复杂性,IMD及其受体系统的运动适应性变化的生理病理意义还需进一步探讨。
5 结论
长期的间歇运动诱导了SHR心血管组织 IMD及其受体系统的高水平表达,很可能是高血压降血压效应的重要的调控机制之一。
[1]吴红梅,曾强,袁鹰,等.自发高血压大鼠心血管组织中肾上腺髓质素2受体系统的变化[J].临床心血管病杂志,2008,24(7):532-536.
[2]罗碧辉,曾昭华,易家骥,等.培哚普利对盐敏感性高血压大鼠心脏形态及其功能的影响[J].中国心血管杂志,2004,32(6):393-396.
[3]萨母布鲁克J,费里奇E F,曼民阿蒂斯 T.《分子克隆》实验指南[M].第2版,北京:科学出版社,1996:407-416.
[4]齐永芬,唐朝枢.降钙素基因相关肽家族的受体活性修饰蛋白[J].生理科学进展,2001,(32):251-253.
[5]马俐华,袁鹰,曾强,等.肾上腺髓质素2调控血管紧张素Ⅱ促血管平滑肌细胞增殖作用[J].中华高血压杂志,2009,17(12):1104-1108.
[6]杨靖辉,贾月霞,任永生,等.中叶素1-53对大鼠动脉血压的影响及其作用机制[J].高血压杂志,2005,13(11):711-715.
[7]杨靖辉,齐永芬,马存根,等.intermedin1-53对大鼠心血管功能的影响及机制探讨[J].中国应用生理学杂志,2009,25(3):308-311.
[8]WISLOFF U,ELLINGSENØ,KEMI O J.High-intensity interval training to maximize cardiac benefits of exercise training[J].Exe Sport Sci Rev,2009,37(3):139-146.
[9]ERICSSON M,SJALAND C,ANDRSSON KB,et al.Exercise training prior to cardiac specific serca2 disruption attenuates the decline in cardiac function in mice[J].J Appl Physiol,2010,109(6):1749-1755.
[10]SYRKIN A L,POL TAVSKAIA M G,SVET A V,et al.Interval training in patients with chronic heart failure[J].Kardiologiia,2008,48(7):65-71.
[11]KOBAYASHI H,YAMAMOTO R,KITAMURA K,et al.Cyclic AMP-dependent synthesis and release of adrenomedullin and proadrenomedullin N-terminal 20 peptide in cultured bovine adrenal chromaffin cells[J].Eur J Biochem,1999,263:702-708.
[12]KITAMURA K,KATO J,KAWAMOTO M,et al.The intermidiate form of glycine-extended adrenomedullin is the major circulating molecular form in human plasma[J].Biochem Biophys Res Commun,1998,244:551-555.
[13]HANSEN D,DENDALE P,VAN LOON LJ,et al.The impact of training modalities on the clinical benefits of exercise intervention in patients with cardio-vascular disease risk or type 2 diabetes mellitus[J].Sports Med,2010,40(11):921-940.
[14]GIBALA M J,MCGEE S L.Metabolic adaptations to shortterm high-intensity interval training:a little pain for a lot of gain[J].Exe Sport Sci Rev,2008;36(2):58-63.
[15]LITTLE J P,SAFDAR A,WIL KIN G P,et al.A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle:potential mechanisms[J].J Physiol,2010,588(Pt 6):1011-1022.
[16]GIBALA M.Molecular responses to high-intensity interval exercise[J].Appl Physiol Nutr Metab,2009,34(3):428-432.
[17]ROH J,CHANG C L,BHALLA A,et al.Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activitymodifying protein receptor complexes[J].J Biol Chem,2003,279:7264-7274.
[18]TAKEI Y,INOUE K,OGOSHI M,et al.Identifica tion of novel adrenomedullin in mammals:a potent cardiovascular and renal regulator[J].FEBS Lett,2004,556:53-58.
[19]AMARA S G,JONAS V,ROSENFELD M G,et al.Alternative RNA processing in calcitonin gene expression gene rates mRNAs encoding different polypeptide products[J].Nature,1982,298:240-244.
[20]HIROSE T,TOTSUNE K,MORI N,et al.Increased expression of adrenomedullin 2/intermedin in rat hearts with congestive heart failure[J].Eur J Heart Fail,2008,10(9):840-849.
[21]Morimoto R,Satoh F,Murakami O,et al.Expression of adrenomedullin 2/intermedin in human brain,heart,and kidney[J].Peptides,2007,28(5):1095-1103.
[22]ZHAO Y Y,DAVID B,LISA R S,et al.Differential expression of components of the cardiomyocyte adrenomedullin/intermedin receptor systerm following blood pressure reduction in nitric oxide-deficient hypertension[J].J Pharmacol Exp Ther,2006,316:1269-1281.
[23]YANGJ H,J IA Y X,PAN C S,et al.Effects of intermedin1-53 on cardiac function and ischemia/reperfusion injury in isolated rat hearts[J].Biochem Biophys Res Commun,2005,327:713-719.
[24]TAKAHASHI K,KIKUCHI K,MARU YAMA Y,et al.Immunocyto chemical localization of adrenomedulin2/intermedinlike immuno reactivity in human hypothalamus,heart and kidney[J].Peptides,2006,27(6):1383-1389.
[25]TAYLOR M M,BAGLEY S L,SAMSON W K.Intermedin/adrenomedullin-2 acts within the central nervous system to elevate blood pressure and inhibit food and water intake[J].Am J Physiol Regul Integr Comp Physiol,2005,288:R919-R927.
[26]PAN C S,YANGJ H,CAI D Y,et al.Cardiovascular effects of newly discovered peptide intermedin/adrenomedullin-2[J].Peptides,2005,26:1640-1646.
[27]IHARA T,IKEDA U,TATE Y,et al.Positive inotropic effects of adrenomedullin on rat papillary muscle[J].Eur J Pharmacol,2000,390(1-2):167-172.
[28]HINSON J P,KAPAS S,SMITH D M.Adrenomedullin,a multifunctional regulatory Peptide[J].Endocr Rev,2000,21(2):138-167.
[29]CHANG C L,ROH J,HSU S Y.Intermedin,a novel calcitonin family PePtide that exists in teleosts as well as in mammals:acomparson with other calcitonin intermedin family peptides in vertebrates[J].Peptides,2004,25(10):1633-1642.
[30]CUEILLE C,PIDOUX E,DE VERNEJOUL MC,et al.Inereased myocardial expression of RAMP1 and RAMP3 in rats with chronic heart failure[J].Biochem Biophys Res Commun,2002,294(2):340-346.
[31]WANG X,NISHIKIMI T,AKIMOTO K,et al.Up regulation of lig and,receptor system,and amidating activity of adrenomedullin in left ventricular hypertrophy of severely hypertensive rats:effects of angiotensin-converting enzyme inhibitors and diuretic[J].J Hypertens,2003,21(6):1171-1181.
Response of Heart Function and Myocardium Intermedin and Its Recipient System of Interval Exercise Training of Spontaneous Hypertensive Rat
LIU Xiang-hui1,HAO Xuan-ming2
目的:探讨间歇运动对自发性高血压大鼠的心功能、心肌组织垂体中叶素(intermedin,IMD)及其受体系统的影响。方法:20只自发性高血压大鼠随机分为运动组和对照组,运动组进行连续10周的间歇运动后,测定大鼠的血压、心功能、心肌组织 IMD及其受体系统mRNA水平和蛋白含量、血浆 IMD含量。结果:1)运动组 SHR的血压、HW/BW、-dp/dt、LVSP、LVDP低于对照组(P<0.05);2)运动组 SHR心肌 IMD、CRLR、RAMP1-3 mRNA水平及蛋白表达水平比对照组显著提高(P<0.05);3)运动组SHR血浆IMD与收缩压、心重/体重及其受体蛋白水平之间呈正相关(P<0.05);而对照组SHR血浆IMD与收缩压呈负相关(P<0.05),与心重/体重及其受体蛋白水平之间呈正相关(P<0.05)。结论:长期的间歇运动诱导了SHR心血管组织 IMD及其受体系统的高水平表达,很可能是高血压降血压效应的重要的调控机制之一。
高血压;间歇运动;垂体中叶素;降钙素受体样受体;受体活性修饰蛋白;鼠;动物实验
Objective:To investigate the difference of heart function and intermedin(IMD)and its receptor in genetic expression and protein content in myocardium tissue after interval training in SHR.Method:Twenty SHR were randomly divided into two groups,IE group trained in interval training,and CR group was set as control group.The mRNA expression of IMD and its receptor,protein levels of CRLR and RAMPs,the content of IMD in plasma were measured.Result:1)The blood pressure,HW/BW,-dp/dt,LVSP,LVDP of IE group were decreased comparing with CR group(P<0.05).2)The mRNA and protein content levels of IMD,CRLR,RAMP1,RAMP2 and RAMP3 in IE group were increased respectively in myocardia comparing with CR group(P<0.05).3)The elevated protein content of CRLR,RAMP1 and RAMP2 in myocardia was positively correlated with that of protein levels of its recipient system.Conclusion:Long-term interval training can induce the high level expression of IMD and its receptor system in myocardia.IMD and its receptor system may play an important role in the effect of decreased blood pressure of essential hypertension.
hy pertension;interval training;intermedin;CRL R;RA M Ps
G804.7
A
1000-677X(2011)02-0070-06
2010-11-25;
2011-01-10
湖南省全民健身服务体系建设研究基地资助项目(湘哲社领[2010]14号);广东省普通高校人文社会科学研究基地重大项目(07JDXM89002)资助。
刘向辉(1970-),男,湖南邵阳人,副教授,博士,研究方向为运动医学与康复,Tel:(020)84720361,E-mail:liuxh1062002@yahoo.com.cn;郝选明 (1954-),男 ,陕西韩城人,教授,博士研究生导师,研究方向为运动免疫与运动健身康复,Tel:(020)39310620,E-mail:haoxm@scnu.edu.cn。
1.Department of Physical Education of Shaoyang University,Shaoyang 422000,China;2.School of Physical Education,South China Normal University,Guangzhou 510006,China.
