机械生长因子对骨骼肌卫星细胞激活的影响及与其增殖的量效关系
2011-09-28陆耀飞
吴 嵽 ,陆耀飞
机械生长因子对骨骼肌卫星细胞激活的影响及与其增殖的量效关系
吴 嵽 ,陆耀飞
骨骼肌损伤是运动医学领域中很常见的一类运动创伤,其发生率从10%~55%不等[2]。由于骨骼肌再生能力有限、自然愈合时程较长以及瘢痕组织的形成,导致愈合质量不可靠。如果反复损伤,肌肉容易疲劳僵硬、直至肌肉瘢痕或骨化性肌炎形成,最终导致运动能力丧失。如何治疗骨骼肌损伤、加快愈合过程和提高肌肉愈合质量,成为迫切需要解决的问题。
骨骼肌损伤后,需要激活骨骼肌卫星细胞(satellite cell,SC)来提供足够的细胞核,通过增殖、分化,最终融合形成新的骨骼肌细胞来修复损伤肌纤维。有研究表明,胰岛素样生长因子-1(IGF-1)的表达对于骨骼肌局部的损伤修复及肌肉萎缩后的恢复有作用[3],机械生长因子(mechano growth factor,MGF)作为 IGF-1的剪接变构体和局部自分泌的生长因子,在骨骼肌损伤后,先于卫星细胞的激活发生并持续到卫星细胞表达至最大值,且能促进卫星细胞的增殖。因此,有研究做出了骨骼肌卫星细胞的激活可能与MGF有关的推断[14]。此外,虽然有研究表明 MGF有促进骨骼肌卫星细胞增殖的作用[15],但是对于使用的剂量与作用时间还没有明确的定论。
本研究通过骨骼肌卫星细胞的离体培养,观察MGF对于骨骼肌卫星细胞的激活作用及促进其增殖的量效关系,探讨MGF对骨骼肌卫星细胞在细胞和分子水平的调节机制,为骨骼肌损伤的修复提供了理论依据。
1 研究对象与方法
1.1 实验动物
雄性SD大鼠2只,4周龄,体重 120 g,清洁级,由上海第二军医大学实验动物中心提供。
1.2 主要实验试剂
Dulbecco改良 Eagle培养基(Dulbecco’s modified eagle media,DMEM)(Gibco),胎牛血清(Gibco),马血清(Gibco),青霉素/链霉素(Amresco),II型胶原酶(Sigma),胰蛋白酶+EDTA(上海博光),横纹肌肌动蛋白抗体(α-SCA;武汉博士德),SABC试剂盒(武汉博士德),噻唑兰(methylthiazol tetrazolium,MTT;上海博光),碘化丙锭(propidium iodide,PI;Sigma)。
1.3 骨骼肌卫星细胞原代培养
10%的水合氯醛以0.4 ml/100 g体重的剂量腹腔麻醉大鼠。
将大鼠浸泡在75%酒精溶液中3 min后,仰卧位固定,无菌条件下分离两侧腓肠肌与比目鱼肌。
用骨骼肌清洗液冲洗肌肉3次后,用眼科剪和眼科镊剥离筋膜、血管和脂肪组织,然后,充分剪碎至1 mm3大小,用骨骼肌清洗液清洗。
在剪碎的骨骼肌中加入0.1%II型胶原酶消化液50 ml,37℃时在磁力搅拌器搅拌下消化1 h,移入15 ml离心管中,以 1 000 rpm,离心 10 min。弃去上清液后加入0.25%胰蛋白酶30 ml,37℃在磁力搅拌器搅拌下消化15 min后,加入胎牛血清 1 ml终止消化,移入 15 ml离心管中,以1 000 rpm,离心 10 min。弃去上清液,加入 5 ml种植培养液后吹打混匀。收集细胞悬液,依次通过100目、200目、400目的不锈钢细胞筛过滤。收集滤液后继续吹打混匀,制成单细胞悬液,接种于未经多聚赖氨酸包被的细胞培养瓶中,种植密度不低于105个细胞/ml,放入培养箱中培养,培养条件为:37℃,5%CO2,100%空气湿度。2 h后,将细胞培养瓶中细胞悬液接种到新的未经多聚赖氨酸包被的细胞培养瓶中。2 h后,将第一次差速贴壁的细胞培养瓶中的细胞悬液接种到经多聚赖氨酸包被的细胞培养瓶中,48 h后首次换液。之后每隔2天换液一次。
1.4 骨骼肌卫星细胞传代培养
弃培养瓶中培养液,加入0.01 M PBS 1 ml清洗细胞后,弃去PBS。在培养瓶中加入预热至室温的0.25%胰蛋白酶1 ml,倒置显微镜下观察。观察到细胞皱缩变圆,且细胞间隙增大不再致密后,弃去培养瓶中胰蛋白酶。将培养瓶放入含5%CO2的37℃培养箱中约10 s后取出,倒置显微镜下观察。待大部分细胞从培养瓶壁脱落时,加入生长培养液终止消化,并用吸管吹打培养瓶壁,将细胞从培养瓶壁洗脱。按1∶3比例将细胞接种到培养瓶中。
1.5 骨骼肌卫星细胞纯度鉴定
原代培养后进行细胞传代,继续培养7天。弃去培养板中的生长培养液,用0.01M PBS清洗1次。4%多聚甲醛固定细胞20 min后,0.02M PBS清洗3次,3 min/次。梯度酒精脱水:75%,85%,95%各 1次,3 min/次。3%H2O2室温浸泡10 min,灭活内源性过氧化物酶后,0.02M PBS清洗3次,3 min/次。滴加5%BSA封闭液,37℃孵育20 min,弃去多余液体,无需清洗。滴加1∶100稀释的α-SCA,4℃过夜后,0.02M PBS清洗3次,3 min/次。滴加生物素化山羊抗小鼠 IgG,37℃孵育20 min,0.02M PBS清洗3次,3 min/次。滴加试剂SABC,37℃孵育20 min,0.02 M PBS清洗3次,3 min/次。使用DAB试剂盒,取1 ml蒸馏水,加试剂盒中A、B、C试剂各1滴,混匀后加至培养板中,室温显色,倒置显微镜下观察,控制反应时间。10 min后用蒸馏水终止反应,然后用洗涤0.02M PBS清洗。显微镜下观察阳性细胞数,计算细胞纯度。细胞纯度(%)=(细胞总数-阴性细胞数)÷细胞总数×100%。
1.6 骨骼肌卫星细胞增殖测定
1.6.1 分组
空白组:生长培养液中不加MGF不加细胞
对照组:生长培养液中不加MGF加细胞
MGF组:10 ng/ml MGF的生长培养液加细胞,25 ng/ml MGF的生长培养液加细胞,50 ng/ml MGF的生长培养液加细胞,100 ng/ml MGF的生长培养液加细胞,200 ng/ml MGF的生长培养液加细胞
干预时间 :24 h、48 h、72 h、96 h。
1.6.2 增殖测定
取15 ml离心管1支,加入9 ml生长培养液。将细胞制成单细胞悬液后,取1 ml加入上述离心管中。用吸管将细胞吹打混匀后置于倒置显微镜下计数。计算细胞悬液的密度:细胞密度=(4个大格细胞总数/4)×104个/ml。用生长培养液将细胞浓度调节为5×103个/ml后接种到96孔板中,每孔加入100μl。铺板后每隔30 min观察1次。2 h后细胞贴壁,弃去生长培养液,加入含不同浓度MGF的生长培养液100μl,同时设置空白组、对照组,每组设复孔6个。在5%CO2,37℃培养箱中培养。分别于培养 20 h、44 h、68 h、92 h后取出培养板 ,弃去生长培养液后,加入MTT溶液100μl,放入培养箱避光培养4 h。取出培养板后,弃去 MTT溶液,加入 DMSO 150μl,振荡混匀,使蓝紫色结晶充分溶解。选择波长490 nm,以空白组(B组)调零,在酶联免疫检测仪上测定各孔光吸收值A,记录结果。
作者单位:上海体育学院运动科学学院,上海200438
1.7 骨骼肌卫星细胞的同步化
以合适的密度将骨骼肌卫星细胞接种到培养瓶中,待细胞贴壁后,弃去生长培养液,无菌0.01M PBS清洗1~2次后,向培养瓶中加入DMEM 2 ml,放入5%CO2,37℃培养箱中培养24 h,使细胞退出细胞周期。
1.8 同步化检测
取出饥饿24 h后的骨骼肌卫星细胞,将培养瓶中DMEM收集至离心管中,加无菌0.01M PBS清洗细胞,将清洗液收集至离心管中,用胰蛋白酶消化细胞后,加少量生长培养液终止消化,将消化液收集至离心管中,再用无菌PBS清洗培养瓶中剩余细胞后,将清洗液收集至离心管中。将离心管中细胞以1 000 rpm,离心6 min后去上清液。再在离心管中加入无菌0.01M PBS 1 ml,重悬细胞后,再次以1 000 rpm,将细胞离心6 min后去上清液。用无菌0.01M PBS 300μl重悬细胞后,逐滴加入至含有700 μl于-20℃预冷的无水乙醇的 EP管中,使乙醇的终浓度为70%,4℃避光保存,放置18 h以上。取出固定于70%乙醇溶液中的细胞,以1 000 rpm,离心10 min,去上清液。无菌0.01M PBS清洗2次。将细胞重悬于 500μl含有Rnase A的 PBS中,37℃避光水浴30 min。细胞悬液用400目细胞筛过滤至流式管中,加入 PI工作液100μl,避光冰上孵育30 min。流式细胞仪上机检测。
1.9 细胞周期检测
1.9.1 分组
对照组 :不含 MGF 的 DMEM 刺激 0 h、8 h、16h、24 h、32 h;MGF组(浓度确定为 25 ng/ml):含 MGF的 DMEM刺激 8 h、16 h、24 h、32 h。
1.9.2 步骤
1.9.2.1 对照组
取出饥饿24 h后的骨骼肌卫星细胞后,弃去DMEM,更换新的DMEM,放入含5%CO2的37℃培养箱中培养,分别于 8 h、16 h、24 h、32 h 后取出 ,其余步骤同 1.8。
1.9.2.2 实验组
取出饥饿24 h后的骨骼肌卫星细胞后,弃去DMEM,加入含有25 ng/ml MGF的DMEM,放入含有5%CO2的37 ℃培养箱中培养 ,分别于培养后 8 h、16 h、24 h、32 h 取出,其余步骤同1.8。
1.10 统计学处理
采用SPSS 17.0软件进行统计处理。
MTT法增殖测定结果以平均A值表示,增殖趋势采用多因素方差分析,时间—剂量交互作用采用 Tukey-HSD法检验;同一时间点各组间采用单因素方差分析的LSD法检验;流式细胞仪检测结果以分别在 G0/G1期、S期和G2/M期的细胞所占细胞数的比例表示,同一时间点对照组与MGF组之间采用独立样本 t检验,组内采用单因素方差分析的LSD法检验。P<0.05有统计学意义。
2 实验结果
2.1 骨骼肌卫星细胞的鉴定和纯化
经横纹肌肌动蛋白免疫细胞化学染色,骨骼肌卫星细胞呈阳性反应,细胞质染成棕色(图1)。
本实验计数1 000个细胞。阴性细胞数为26个。

达到了纯化的目的(即细胞纯度≥95%)。
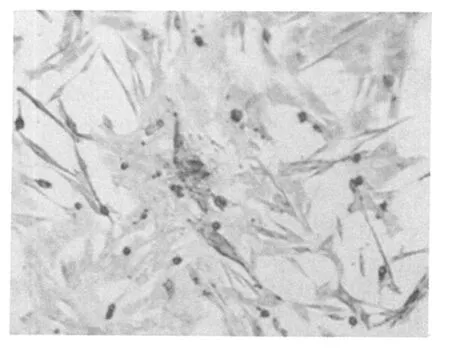
图1 骨骼肌卫星细胞的横纹肌肌动蛋白免疫化学染色图(100×)Figure 1 Skeletal Muscle Satellite Cells Immunochemistry Stained byα-Sarcomeric Actin(100×)
2.2 不同浓度MGF对骨骼肌卫星细胞增殖的影响
MGF干预骨骼肌卫星细胞24 h后已进入促增殖状态。
如图2:48 h:25 ng/ml组、50 ng/ml组A值显著高于对照组(P<0.01),10 ng/ml组 A值高于对照组(P<0.05),100 ng/ml组、200 ng/ml组与对照组之间差异没有显著性(P>0.05),即25 ng/ml组与50 ng/ml组的促增殖作用明显优于10 ng/ml组、100 ng/ml组、200 ng/ml组(P<0.01),100 ng/ml组与200 ng/ml组的促增殖作用的差异没有显著性 (P>0.05)。
如图3:96 h:10 ng/ml组与对照组之间差异没有显著性 (P> 0.05),25 ng/ml组、50 ng/ml组、100 ng/ml组、200 ng/ml组A值显著高于对照组和10 ng/ml组 (P<0.01),25 ng/ml组、50 ng/ml组、100 ng/ml组、200 ng/ml组之间差异没有显著性(P>0.05)。
结果显示,低剂量的MGF即可促进骨骼肌卫星细胞的增殖,随浓度升高至 25 ng/ml至 50 ng/ml时,MGF促骨骼肌卫星细胞增殖作用相对更明显,浓度继续升高,会出现增殖速度减缓现象;各个时相检测后发现,MGF干预到96 h增殖速度减缓。结合时间—剂量的结果显示,在48 h时25 ng/ml组和50 ng/ml组有交互作用,说明在48 h时,浓度在25 ng/ml到50 ng/ml之间的MGF有较好的促增殖作用。

图2 48 h不同浓度MGF对骨骼肌卫星细胞增殖的影响示意图Figure 2. Effects of MGF on the Dose-dependent Proliferation of Skeletal Muscle Satellite Cells at 48 h
2.3 血清饥饿对骨骼肌卫星细胞周期同步化的影响
使用不含血清的DMEM饥饿骨骼肌卫星细胞24 h后,通过流式细胞仪上机测得处于 G0期的细胞达到了86.76%。
2.4 MGF对骨骼肌卫星细胞细胞周期的激活影响
在骨骼肌卫星细胞退出细胞周期后8 h、16 h、24 h和32 h后,通过流式细胞仪上机检测骨骼肌卫星细胞在25 ng/ml的MGF作用下,细胞周期各个时相的比例变化(表1)。
如表1所示,8 h时MGF组与对照组相比无显著性差异 (P>0.05),16 h时MGF组 G0/G1期细胞含量低于对照组(P>0.05),24 h时 MGF组显著低于对照组(P<0.01),32 h时MGF组低于对照组(P<0.05)。

表1 MGF对骨骼肌卫星细胞的细胞周期激活影响一览表T able 1 Effects of MGF on Activation of Skeletal Muscle Satellite Cells (%, ±SD)
结果显示,MGF干预后,处于静息期的骨骼肌卫星细胞在16 h后开始部分退出 G0期;至32 h大部分细胞开始退出 G0期,重新进入细胞周期。
如图4所示,MGF组的 G0/G1期细胞百分比32 h低于 0 h、8 h、16 h和 24 h(P< 0.01),说明 MGF 干预骨骼肌卫星细胞历经潜伏期后,在32 h能够明显激活骨骼肌卫星细胞退出 G0期,使其重新进入细胞周期。

图4 各个时相MGF组中骨骼肌卫星细胞 G0/G1期百分比示意图Figure 4. Proportion of the Satellites Cells in G0/G1Phase of Operated G roup
3 分析与讨论
3.1 MGF对骨骼肌卫星细胞增殖的影响因素
本实验采用了培养的第三代骨骼肌卫星细胞,基本排除了自体因素的干扰,能更有效地说明MGF对其的影响。
本实验设定了5个MGF的不同浓度干预骨骼肌卫星细胞的增殖 ,在干预后 24 h、48 h、72 h、96 h发现:10 ng/ml、25 ng/ml、50 ng/ml、100 ng/ml、200 ng/ml的 MGF 均促进了骨骼肌卫星细胞的增殖,说明MGF具有促进骨骼肌卫星细胞增殖的作用,与以往的研究结果一致[15]。有研究发现,100 ng/ml的 IGF-1和100 ng/ml的 MGF联合使用与单独使用100 ng/ml的MGF的促增殖作用无明显差异[1],而本实验MTT增殖测定结果显示,MGF促进增殖的效果并没有随着浓度的升高而成比例上升:从图2可知,48 h时100 ng/ml与200 ng/ml的MGF促增殖作用无明显差异(P>0.05),说明在一定范围内,MGF促进骨骼肌卫星细胞的增殖具有浓度依赖性。
从图3可见,96 h后 25 ng/ml组、50 ng/ml组、100 ng/ml组与200 ng/ml组间没有差异(P>0.05),可能是因为在96孔板中每孔添加了100μl含不同浓度 MGF的生长培养液,在干预的96 h内未经换液,持续到72~96 h时,生长培养液本身已经不能提供骨骼肌卫星细胞足够的营养,而在营养不足的情况下,细胞会渐渐趋向 G0期而停止增殖,开始分化;也有可能是由于骨骼肌卫星细胞在生长过程中互相接触后产生了密度依赖性的生长抑制,即接触抑制,细胞膜上的糖类和蛋白质共同构成的糖蛋白在细胞上起识别作用,当细胞增殖到一定程度而相互接触时,糖蛋白可以识别该信号,使细胞停止增殖[9]。
MGF属于亲水性化学信号分子,不能直接进入细胞,只能通过膜表面的特异受体传递信号,使靶细胞产生效应[4],它与受体的结合会引起相应的生理反应,在一定范围内,反应的强弱与几何配体的受体数量呈正相关。在本实验中,可能在MGF能够结合足够数量受体的前提下,MGF的浓度越高,骨骼肌卫星细胞的增殖越快。从图2可以看出,25 ng/ml~50 ng/ml的 MGF可能较为接近促进其结合足够多的受体的浓度范围,使得骨骼肌卫星细胞的增殖效果较明显,作用的机制可能是:MGF+MGFR→MGF-MGFR→构象改变→RTK(受体型酪氨酸激酶)→启动底物蛋白质磷酸化及信号传递→诱导与增殖相关的基因表达→细胞增殖。当细胞持续处于信号分子刺激下的时候,细胞通过多种途径使受体钝化,产生适应,如1)修饰或改变受体,如磷酸化,使受体与下游蛋白隔离,即受体失活(receptor inactivation);2)暂时将受体移到细胞内部,即受体隐蔽(receptor sequestration);3)通过内吞作用,将受体转移到溶酶体中降解,即受体下行调节[11]。本实验发现,浓度到达25 ng/ml至 50 ng/ml后,继续升高 MGF浓度,增殖的效果却减弱(图2),提示,可能是由于 MGF的受体下行调节,即所有的MGF的特异性受体在结合了MGF后,并没有再循环利用,而是在溶酶体中降解。关于MGF的特异性受体,还需要做进一步的研究。
3.2 MGF对激活静息状态下骨骼肌卫星细胞的影响因素
骨骼肌卫星细胞通常处于静息状态,即 G0期,并不分裂[12]。只有在得到信号刺激的情况下,如骨骼肌受到外力作用或者损伤时,才会返回细胞周期,进行分裂增殖。体外培养骨骼肌卫星细胞时,在缺乏某些营养物质时,也可以进入 G0期,此时细胞仅可以生存,但不能分裂,一旦得到营养物质补充,很快会重返细胞周期,开始细胞分裂。对 G0期细胞的生成和它们重返细胞周期的机制研究,已越来越受到人们的重视,这不仅涉及到对骨骼肌卫星细胞增殖和分化调控机制的探讨,而且对于骨骼肌损伤的治疗、药物设计及筛选等,都有重要的指导意义。
通过细胞同步化获得 G0期骨骼肌卫星细胞的方法主要有血清饥饿和接触抑制。有研究认为,血清饥饿优于接触抑制[10],因此,本实验选用血清饥饿以同步化骨骼肌卫星细胞于 G0期。有研究发现,使用含0.2%胎牛血清(FBS)的DMEM饥饿48 h可以使细胞 G0/G1期比例达到68.0%[7];也有研究发现,使用含0.1%FBS的DMEM饥饿48 h可获得90%以上的 G0期细胞[6];许家林发现,使用含0.5%FBS的DMEM饥饿60 h可获得88.75%的G0期细胞[8]。本实验尝试使用不含血清的DMEM对骨骼肌卫星细胞进行饥饿24 h,通过流式细胞仪上机测得处于G0期的细胞达到了86.76%,即有86.76%的骨骼肌卫星细胞退出细胞周期。因此,认为不含血清的DMEM也可以达到较好的同步化效果,并减少了由于饥饿时间过长可能导致的细胞凋亡。
流式细胞仪在细胞周期研究中应用很广泛。从DNA含量着眼,G1期和G2/M期细胞含有固定的DNA含量,S期细胞的DNA含量介于 G1期和 G2/M期之间,应用流式细胞仪,可以通过检测细胞DNA含量在不同时间内的变化,从而确定细胞所处的各个周期及其时间长短。许家林在 HGF干预静息状态下骨骼肌卫星细胞的实验中选取了5个时间段,每个时间段为2 h[8],结果并不理想,因此认为需要延长刺激时间以观察到更理想的结果。又有研究通过在体实验测定了骨骼肌卫星细胞的细胞周期[13],结果显示,各个时相大致分布为:G1期:14 h;S期:14±1.4 h;G2/M期:4 h,且该研究认为,在体的骨骼肌卫星细胞的细胞周期可能长于体外实验中骨骼肌卫星细胞的细胞周期所经历的时间。因此,本实验将MGF干预的时间延长至32 h,并选取了4个时间点检测,平均每个时间段为8 h,以期望能观察到MGF在干预骨骼肌卫星细胞后各个周期相比率的变化。
骨骼肌卫星细胞从 G0期退出后重新进入细胞周期,可以完成一系列的生命活动:分裂、增殖、分化,融合为新的肌管后形成新的肌纤维,以此修复受损的骨骼肌。Hill和 G oldspink等通过在体实验推测 MGF可能与激活静息状态下的骨骼肌卫星细胞进入细胞周期有关[14],本实验通过离体实验验证了这一研究结果。从表1可知,24 h时MGF组 G0/G1期细胞比例明显低于对照组(P<0.01),32 h时MGF组低于对照组,为68.87%(P<0.05),因此,可以认为MGF干预后,处于静息期的骨骼肌卫星细胞在16 h后开始部分退出 G0期,重新进入细胞周期,至32 h大部分细胞开始退出 G0期,重新进入细胞周期。在成体中,肌细胞是一种高度分化的细胞,退出了细胞周期不再分裂[5],肌细胞退出细胞周期可能与 Rb基因的表达产物视网膜瘤(retinoblastoma,Rb)蛋白的去磷酸化有关:Rb蛋白是一种基因调节蛋白抑制蛋白,去磷酸化的Rb蛋白具有活性,可同特定的基因调节蛋白结合,使后者无法激活与细胞分裂相关基因的转录。MGF刺激骨骼肌卫星细胞退出细胞周期,可能的机制为:MGF与其特异性受体结合后,激活细胞内一定的信号,经胞内级联传递,激活 G1期蛋白-Cdk复合物后,后又激活S期蛋白-Cdk复合物,使Rb蛋白磷酸化而失去活性,失活的 Rb蛋白释放出基因调节蛋白,激活靶基因的转录,引起骨骼肌卫星细胞细胞重新进入细胞周期。
4 结论
1.MGF可以促进骨骼肌卫星细胞增殖。
2.MGF可以激活4周龄SD大鼠的 G0期骨骼肌卫星细胞。
[1]薄冰.MGF与IGF-I对离体骨骼肌卫星细胞增殖及分化能力的影响[D].上海:上海体育学院硕士学位论文,2009.
[2]陈世益.骨骼肌损伤与修复的研究进展[A].2005上海国际关节镜与运动医学高级学习班暨全国学术会议教程及论文汇编[C].2005.
[3]陈世益.骨骼肌损伤后促进愈合的研究[D].上海:复旦大学博士学位论文,2002.
[4]陈誉华.医学细胞生物学(第4版)[M].北京:人民卫生出版社,2008.
[5]韩贻仁.分子细胞生物学(第3版)[M].北京:高等教育出版社,2007.
[6]何丽洁,王汉民.人肾小管上皮细胞血清饥饿法同步化方法的研究[J].细胞与分子免疫学杂志,2007,23(3):275-276.
[7]伍春莲,王宏斌,马红玲,等.血清饥饿法诱导人角质细胞HaCaT细胞周期同步化的研究[J].西华师范大学学报(自然科学版),2008,29(2):127-131.
[8]许家林.骨骼肌肌卫星细胞体外培养及肝细胞生长因子体外刺激激活的研究[D].上海:上海体育学院硕士学位论文,2004.
[9]徐可,方祖军,李映川,等.大鼠骨骼肌卫星细胞体外培养生长和成肌特性[J].上海交通大学学报(医学版),2008,28(7):775-778.
[10]严丽萍,陶茂萱.血清饥饿和接触抑制两种G0期同步化方法效果评价[J].卫生研究,2007,36(3):275-278.
[11]翟中和.细胞生物学(第1版)[M].北京:高等教育出版社,2000.
[12]CHARGE S B,RUDNICKI M A.Cellular and molecular regulation of muscle regeneration[J].Physiol Rev,2004,84(1):209-238.
[13]EDWARD S.Satellite cell proliferative compartments in growing skeletal muscles[J].Developmental Biology,1996,175(1):84-94.
[14]HILL M,GOLDSPINK G.Expression and splicing of the insulin-like growth factor gene in rodent muscle is associated with muscle satellite(stem)cell activation following local tissue damage[J].J Physiol,2003,549(2):409-418.
[15]SHI Y Y,GEOFFREY G.Different roles of the IGF-1 Ec peptide(MGF)and mature IGF-1 in myoblast proliferation and differentiation[J].FEBS Letters,2002,522:156-160.
Effects of Mechano Growth Factor on Activation and the Dose-dependent Proliferation of Skeletal Muscle Satellite Cells in Vitro
WU Die,LU Yao-fei
目的:通过离体实验,观察机械生长因子(MGF)对于骨骼肌卫星细胞(SC)的激活作用及促进其增殖的量效关系,探讨MGF对SC在细胞水平的调节机制,为骨骼肌损伤的修复提供理论依据。方法:原代SC取自4周龄雄性SD大鼠双侧的腓肠肌与比目鱼肌。使用不同浓度的MGF干预第三代细胞后测定增殖效果。血清饥饿后通过MGF和DMEM干预骨骼肌卫星细胞,使用流式细胞仪检测其所处细胞周期,判断激活情况。结果:干预48 h后,25 ng/ml组、50 ng/ml组 A值显著高于对照组 (P<0.01),100 ng/ml组、200 ng/ml组与对照组之间差异没有显著性 (P>0.05);96 h后25 ng/ml组、50 ng/ml组、100 ng/ml组、200 ng/ml组之间差异没有显著性 (P>0.05)。25 ng/ml MGF干预 G0期的SC 24 h后MGF组低于对照组 (P<0.01)。结论:MGF可以促进 SC增殖;MGF可以激活4周龄 SD大鼠的 G0期SC。
骨骼肌卫星细胞;机械生长因子;细胞培养;细胞增殖;细胞激活;鼠;动物实验
Objective:This paper observed the effects of MGF on activation and the dose-dependent manner on proliferation of SC in vitro which increasing the number available for local repair,as well as the mechanism at the levels of molecular.Method:The primary passage SC was derived from gastrocnemius muscle and soleus muscle of the Sprague-Dawley rats(4 weeks of age,male).The third passage SC was treated with MGF and the cell proliferation rate was measured by cell proliferation assay.The third passage SC was serum starved and treated with MGF and DMEM.The cell cycle was detected with Flow Cytometry.Result:After 48h,values of the operated groups which treated with MGF of 25ng/ml and 50ng/ml were significantly higher than that of normal control group(P<0.01).There was no significant difference between 100ng/ml group and 200ng/ml group(P>0.05).After 96h,there was no significant difference among the operated groups of 25ng/ml,50ng/ml,100ng/ml and 200ng/ml(P>0.05).There were significant differences between the operated group and the normal control group,the proportion of the SC in G0/G1 phase of operated group treated with 25ng/ml MGF was significantly lower than that in normal control group after 24h(P<0.01).Conclusion:MGF increases skeletal muscle SC proliferation.MGF appears to initiate skeletal muscle SC activation of 4-week-old Sprague-Dawley rats.
skeletal muscle satellite cell;mechano growth f actor;cell culture;prolif eration;activation;rat;animal ex periment
G804.2
A
1000-677X(2011)02-0064-06
2010-11-01;
2010-12-10
上海市教育委员会科研项目(05IZ02);上海市第三期重点学科资助项目(S30802)。
吴嵽(1985-),女,江苏苏州人,硕士,主要研究方向为运动生理学,Tel:(025)84755197,E-mail:dale_wo@163.com;陆耀飞 (1961-),男 ,江苏太仓人 ,副教授 ,博士 ,硕士研究生导师,主要研究方向为运动生理学,Tel:(021)51253470,E-mail:yflu@sus.edu.cn。
Departmentof Kinesiology,ShanghaiUniversityof Sport,Shanghai 200438,China.
