烟酰胺磷酸核糖转移酶在大鼠涎腺的表达及定位
2011-02-09赵西博李秀秀张福胤
赵西博,张 歆,李秀秀,高 媛,向 彬,张福胤
(1.大连医科大学口腔医学院 口腔颌面外科,辽宁 大连 116044;2.大连育明高中,辽宁大连 116023;3.大连大学医学院 口腔系,辽宁大连 116622)
烟酰胺磷酸核糖转移酶在大鼠涎腺的表达及定位
赵西博1,张 歆2,李秀秀3,高 媛3,向 彬3,张福胤1
(1.大连医科大学口腔医学院 口腔颌面外科,辽宁 大连 116044;2.大连育明高中,辽宁大连 116023;3.大连大学医学院 口腔系,辽宁大连 116622)
[目的]研究烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,Nampt)在大鼠涎腺的表达和分布。[方法]应用半定量逆转录聚合酶链法(RT-PCR)和免疫印迹法检测大鼠正常腮腺、颌下腺和大舌下腺组织Namp tm RNA及蛋白质的表达。采用免疫组织化学法检测大鼠腮腺、颌下腺和大舌下腺组织Namp t的分布。[结果]大鼠腮腺、颌下腺和大舌下腺组织均有 Nampt的mRNA及蛋白质表达,RT-PCR结果显示其表达相对光密度值分别为:腮腺 82.04%,颌下腺 50.89%,大舌下腺30.53%(与 actin比较,P<0.05);Western Blot结果显示其表达相对光密度值分别为:腮腺 77.34%,颌下腺 47.61%,大舌下腺 31.78%(与 actin比较,P<0.05)。Nampt均主要分布于浆液性腺泡细胞的胞浆和胞核,以及闰管和纹状管的胞核中。[结论]大鼠腮腺、颌下腺和大舌下腺均存在Nampt的 mRNA和蛋白质表达,为深入研究Nampt在涎腺生理及病理状态下的功能意义提供初步实验依据。
烟酰胺磷酸核糖转移酶;腮腺;颌下腺;大舌下腺
烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,Nampt)是细胞内氧化型辅酶 I(nicotinam ide adenine dinucleotide,NAD)生物合成的限速酶,广泛表达在内脏脂肪、骨髓基质细胞、活化的淋巴细胞、巨噬细胞、肝脏、脾脏、子宫、胸腺、胰腺、肌肉组织及胎膜等组织[1]。近年研究表明,Nampt不仅在细胞代谢、生长、增殖及分化的调节中起着重要作用,而且参与癌症、炎症、急性肺损伤及其他应激反应[2-6]。但涎腺中有否 Nampt的表达,国内外尚未见文献报道。本实验采用形态学及分子生物学方法,从蛋白质及基因水平研究 Nampt在大鼠腮腺、颌下腺和大舌下腺的分布和表达,为深入研究 Nampt在涎腺生理及病理状态下的功能意义提供初步实验依据。
1 材料和方法
1.1 实验动物
健康成年 Wistar大鼠 6只,体重 200~250 g,雌雄不限,购自大连医科大学 SPF动物实验中心。
1.2 主要试剂及仪器
Trizol试剂购自 Invitrogen公司;RevertAid First Strand cDNA Synthesis Kit购自美国 Fermentas公司;2×Taq PCR MasterMix购自北京天根生物技术公司;兔抗鼠 Nampt多克隆抗体购自美国 Santa Cruz公司;辣根过氧化物酶标记的二抗及浓缩型 DAB试剂盒购自北京中杉金桥生物技术有限公司;其余试剂均为国产分析纯化学试剂。PCR仪(TC-512,TECHNE,英国),荧光凝胶成像系统(UVP BioChem i System,美国)。
1.3 RT-PCR检测 Nampt mRNA在大鼠腮腺、颌下腺及大舌下腺的表达
在 2%戊巴比妥钠麻醉下(20 mg/kg)分别取大鼠正常腮腺、颌下腺及大舌下腺组织约 20mg,Trizol法提取 RNA。再取 5μg RNA,进行 RT-PCR。根据 GenBank中大鼠 Nampt全基因序列(基因登录号:NM_177928)设计引物;Nampt上游引物为 5′-ATAGGGGCATCTGCTCATTT-3′;Nampt下游引物为 5′-ACTgTgCTCTGCCGCTGGAA-3′。 β-actin上游引物为 5′-TCCTCCCTGGAGAAGAGCTA-3′;β-actin下游引物为 5′-TCAGGAGGAGCAATGATCTTG-3′。设不加逆转录产物为阴性对照,以胰腺组织为阳性对照,引物由上海生工生物工程技术服务有限公司合成。PCR的扩增条件:94℃预变性 2 min,98℃10 s,68℃30 s3个循环后接 98℃ 10 s,55℃ 30 s,72℃ 30 s 27个循环,之后 72℃充分延伸 5 min。PCR产物经 1.5%琼脂糖凝胶电泳,DNA绿结合后在紫外灯下观察,UVP BioChemi System凝胶成像系统拍照,LEICA-Q-550IW图像分析系统对 PCR结果进行光密度扫描和分析。
1.4 Western Blot检测 Nampt蛋白在大鼠腮腺、颌下腺及大舌下腺的表达
大鼠腮腺、颌下腺及大舌下腺组织经裂解和离心后,取上清液 Bradford法测定蛋白。再取 80μg蛋白质于 12%十二烷基硫酸钠 -聚丙烯酰胺(SDSPAGE)凝胶电泳后,转至聚偏氟乙烯膜(polyvinylidene difuoride,PVDF)。电转后10%脱脂奶粉室温封闭 2 h,一抗的抗体(稀释度为 1∶500)4℃孵育过夜。经 PBST冲洗后加入辣根过氧化物酶标记的二抗室温孵育 2 h,化学发光剂发光并观察结果,以胰腺组织为阳性对照。用 LEICA-Q-550IW图像分析系统对所得区带的积分光密度进行扫描分析。
1.5 免疫组织化学方法(ABC法)检测 Nampt蛋白在大鼠腮腺、颌下腺及大舌下腺的分布
在 2%戊巴比妥钠麻醉下(20 mg/kg)取大鼠腮腺、颌下腺及大舌下腺组织,制备石蜡切片,用0.3%的 H2O2甲醇溶液室温孵育 30 min以阻断内源性过氧化物酶,20%的马血清室温封闭 20 min后加入兔抗鼠 Nampt抗体,37℃孵育 1 h后 4℃过夜。用生物素标记的二抗室温下孵育2 h,辣根过氧化物酶标记的亲和素室温下孵育 30 min,3,3'-二氨基联苯胺(3,3'-diam inobenzidine,DAB)显色,苏木素复染。阴性对照使用正常马血清代替一抗。
1.6 统计学方法
使用 SPSS 15.0软件进行数据分析,两组间差异显著性比较采用 t检验,多组资料分析采用单因素方差检验(ANOVA),P<0.05表示差异具有显著性意义。
2 结 果
2.1 NamptmRNA和 Nampt蛋白的表达
Nampt在大鼠腮腺、颌下腺及大舌下腺的表达:用大鼠 Nampt基因特异性引物对腮腺、颌下腺及大舌下腺的 cDNA进行扩增,以胰腺做阳性对照,扩增出 109 bp大小的 cDNA片段,不加逆转录产物的阴性对照未见条带(图 1),证明大鼠腮腺、颌下腺及大舌下腺均有 Nampt的 mRNA的存在,其表达相对光密度值分别为:腮腺 82.04%,颌下腺 50.89%,大舌下腺 30.53%(与 actin比较,P<0.05)。免疫印迹方法结果显示,大鼠腮腺、颌下腺及大舌下腺总蛋白中存在能够与抗 Nampt抗体特异结合的条带,说明在大鼠腮腺、颌下腺及大舌下腺中有 Nampt蛋白质的表达,其表达相对光密度值分别为:腮腺77.34%,颌下腺 47.61%,大舌下腺 31.78%(与 actin比较,P<0.05)(图 2)。 RT-PCR和 Western Blot结果一致显示 Nampt在大鼠涎腺的表达丰度腮腺最高,颌下腺次之,最少的是大舌下腺。
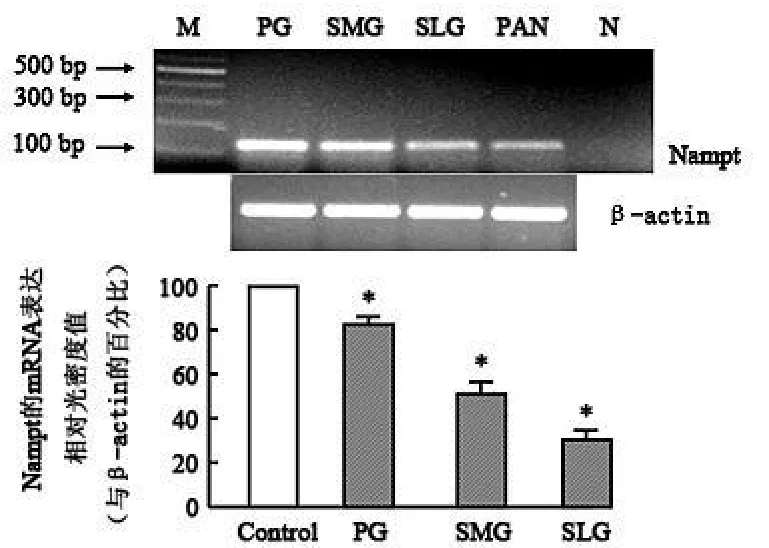
图1 大鼠涎腺NamptmRNA的表达Fig 1 Them RNA expression of Namp t in salivary glands of rat
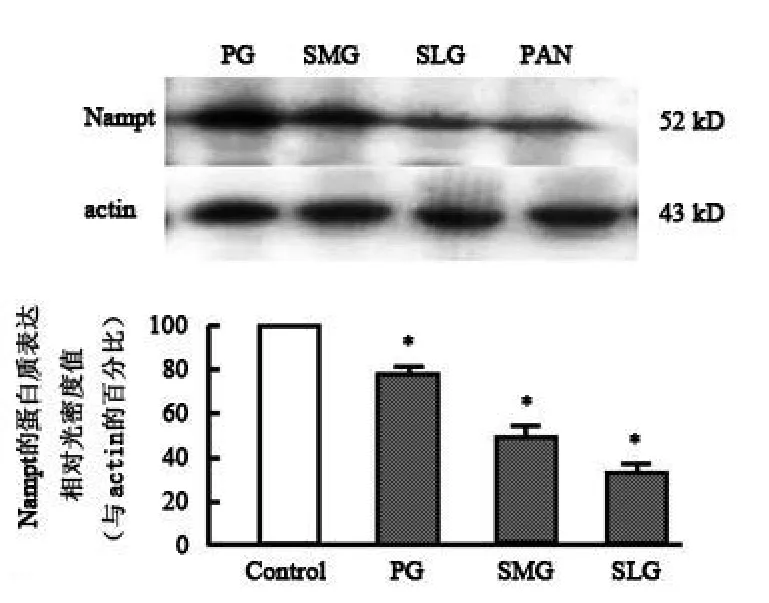
图2 大鼠涎腺 Nampt蛋白质的表达(胰腺为阳性对照)Fig 2 The p rotein exp ression of Nampt in salivary glands of rat
2.2 Nampt蛋白的分布
Nampt在大鼠腮腺、颌下腺及大舌下腺的分布:光镜下观察,Nampt免疫组化阳性染色为棕黄色颗粒,在大鼠涎腺中主要分布于浆液性腺泡细胞的胞浆和导管细胞的胞核中(图 3 B、D和 F)。
3 讨论
Nampt亦称前 B细胞克隆增强因子(Pre-B cell colony enhancing factor,PBEF)或内脏脂肪素(Visfatin),其氨基酸序列在各物种间具有高度同源性。Nampt在哺乳动物体内有两种形式:细胞内Nampt(intracellular Nampt,iNampt)和细胞外 Nampt(extracellular Nampt,eNampt)。iNampt已经被证明是 NAD的生物合成限速酶[7],但 eNampt的功能却依然存在广泛的争议。Nampt具有二聚体结构,源于一条 Nampt链的 193位苯丙氨酸与另一链的 18位酪氨酸在二聚物的交界面上形成两个与其催化产物烟酰胺单核苷酸(nicotinam ide mononucleotide,NMN)结合的活性位点,而每一单链上 Ser280-(丝氨酸)His247-(组氨酸)-Asp313(天冬氨酸)形成的三联体对该酶的催化活性亦至关重要,His247突变后,Nampt将丧失酶的活性[8]。Nampt的 mRNA有 3个转录产物,分别长 2.0 kb,2.4 kb和 4.0 kb,均可被有丝分裂原诱导及放线菌重复诱导,其中以 2.4 kb的转录产物占优势,中间 1476个核苷酸构成开放读码框架,编码 491个氨基酸,分子量为54 kD[9]。
Nampt在许多组织细胞的生理及病理过程中起着重要的调节作用,例如:(1)调节细胞生长、增殖及分化:PBEF最早在淋巴细胞中被发现,是 B细胞早期分化的一种生长因子,可以增强白细胞介素 -7(IL-7)促进前 B细胞向 B细胞转化的能力[9];PBEF是血管平滑肌细胞分化成熟的关键因素[10];同时,Visfatin可以促进血浆葡萄糖转化为甘油三酯,促进甘油三酯在前脂肪细胞的积聚。提示 Visfatin可以通过旁分泌途径作用于内脏脂肪组织,促进脂肪组织的分化、合成及积聚[11]。(2)调节细胞代谢:Nampt是细胞内 NAD生成的限速酶。在哺乳动物细胞中,Nampt可以催化烟碱和磷酸核苷焦磷酸转变为 NMN,NMN在烟酰胺单核苷酸腺苷酰转移酶的作用下转化为 NAD。在 Nampt表达的人类血管平滑肌细胞,Nampt可通过增加细胞 NAD水平,激活 sirtuins家族,使平滑肌细胞 SIRT1的活性增加,导致 p53基因的组蛋白去乙酰化,抑制 p53转录,使平滑肌细胞 p53的表达降低,从而延长细胞寿命。因此,Nampt近年也被认为是一种可以延缓人类细胞衰老的因子[6]。(3)类胰岛素作用:Visfatin具有像胰岛素一样降低血糖的作用。Visfatin能增强 3T3-L1脂肪细胞和 L6肌细胞对葡萄糖的摄取,抑制肝细胞葡萄糖的释放;将重组 Visfatin注入胰岛素抵抗的肥胖小鼠和有胰岛素分泌缺陷的小鼠中,可以使血糖水平显著下降。在 Visfatin基因敲除的小鼠,其血浆 Visfatin水平下降,血糖浓度升高[11]。(4)参与炎症:在急性肺损伤动物模型的支气管肺泡灌洗液和脓毒血症患者的中性粒细胞中,PBEF的表达明显增加[3,12];另外,PBEF可通过抑制半胱氨酸蛋白酶 caspase-8和 caspase-3的活性,抑制中性粒细胞的凋亡[3]。(5)参与癌症:FK866(一种高度特异的非竞争性 Nampt抑制剂)可诱导人肝癌细胞 HepG2凋亡[4];Nampt在人卵巢癌组织中表达显著增加[13]。由此可见,Nampt在不同组织或细胞中具有不同的生理及病理学意义和作用。在涎腺有无表达及其生理及病理意义尚未见文献报道。
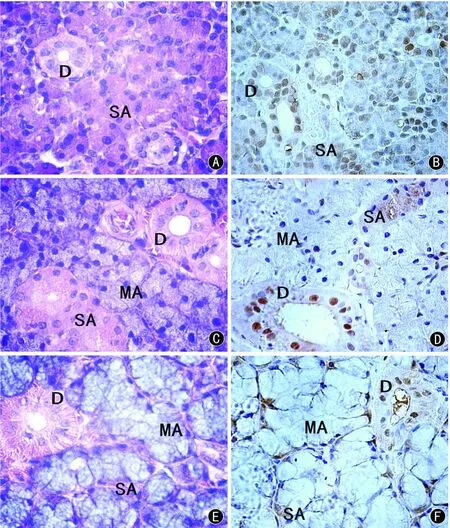
图3 Nampt在大鼠涎腺的定位Fig 3 The dislocation of Nampt in salivary glands of rat
本实验在基因及蛋白质分子水平研究了 Nampt在大鼠三大涎腺的表达。RT-PCR结果显示,Nampt基因在大鼠腮腺、颌下腺及大舌下腺均有表达,其表达丰度最高为腮腺,其次为颌下腺,最少的是大舌下腺,其差异有显著性意义。免疫印迹实验亦检测到 Nampt蛋白质在大鼠腮腺、颌下腺及大舌下腺均有表达,其表达丰度与 RT-PCR检测结果一致,差异有显著性意义。从而在基因及蛋白质水平两方面证明了 Nampt在大鼠腮腺表达最多,颌下腺次之,大舌下腺最少。采用免疫组织化学的方法首次发现 Nampt蛋白质在大鼠腮腺、颌下腺及大舌下腺均有表达,分布在细胞浆和细胞核中,且以浆液性腺泡细胞的胞浆及闰管、分泌管的胞核中表达为主。所以,Nampt在三大涎腺表达丰度不同的原因可能与各涎腺的性质有关(大鼠腮腺是纯浆液性腺,大鼠颌下腺是以浆液性腺为主的混合性腺,大鼠大舌下腺是以粘液性腺为主的混合性腺)。文献报道在神经细胞株 PC-12,细胞内 Nampt定位表达在胞浆、胞核和线粒体。在生理状态下,胞浆的表达多于胞核;然而,给予神经生长因子预孵育后,胞浆的表达却少于胞核[14]。从而提示 Nampt不是细胞因子样蛋白质,而是细胞内与调节细胞周期相关的蛋白质。但是,Nampt在涎腺不同性质腺泡细胞的分布和表达的差异的意义尚不清楚,其病理生理学作用及机制还有待更深入的研究。
已有研究表明,Nampt受多种因素的调节,地塞米松可以上调分化的 3T3-L1脂肪细胞 Nampt的表达,而生长激素和异丙肾上腺素等则明显下调3T3-L1脂肪细胞 Nampt的表达,且呈时间剂量依赖性[15];IFN-γ可以上调 B细胞中 Nampt的表达[16];肿瘤坏死因子 (TNF-α)、白细胞介素 6(IL-6)均可显著抑制 Visfatin的转录水平[15,17]。然而,Nampt在涎腺的信号分子调节途径尚需探讨。
Nampt是一种新发现的具有结合并激活胰岛素受体、模拟胰岛素作用的肽类激素,同时在不同的组织和细胞还具有多种不同的生物学效应。Nampt在涎腺的存在,其生理及病理学意义和作用仍有待阐明。Nampt在涎腺表达的发现为研究涎腺生理功能及疾病的发病机制增加了新内容,更可能成为涎腺疾病治疗中抗炎及抗肿瘤的一个新的药理学靶点。
[1]Sethi JK,Vidal-Puig A.Visfatin:them issing link between intra-abdom inal obesity and diabetes[J].Trends Mol Med,2005,11(8):344-347.
[2]Shin-ichiro Imai.Nicotinamide phosphoribosyl transferase(Nampt):A link between NAD biology,metabolism,and diseases[J].Curr Pharm Des,2009,15(1):20-28.
[3]Jia SH,Li Y,Parodo J,et al.Pre-B cell colony-enhancing factor inhibits neutrophil apoptosis in experimental inflammation and clinical sepsis[J].JClin Invest,2004,113(9):1318-1327.
[4]Hasmann M,Schemainda I.FK 866,a highly specific noncompetitive inhibitor of nicotinam ide phosphoribosyl transferase,rep resents a novelmechanism for induction of tumor cell apop tosis[J].Cancer Res,2003,63(21):7436-7442.
[5]Busso N,Karababa M,Nobile M,etal.Pharmacological inhibition of nicotinamide phosphoribosyl transferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD[J].PLoSONE,2008,3(5):e2267.
[6]van der Veer E,Ho C,O'Neil C,et al.Extension of human cell life span by nicotinamide phosphoribosyl transferase[J].JBiol Chem,2007,282(15):10841-10845.
[7]Rongvaux A,Shea RJ,Mulks MH,et al.Pre-B cell colony enhancing factor,whose expression is up-regulated in activated lymphocytes,is a nicotinamide phosphoribosyl transferase,a cytosolic enzyme involved in NAD biosynthesis[J].Eur J Immunol,2002,32(11):3225-3234.
[8]Wang T,Zhang X,Bheda P,et al.Structure of Nampt/PBEF/visfatin,amammalian NAD+biosynthetic enzyme[J].Nat Struct Mol Biol,2006,13(7):661-662.
[9]Samal B,Sun Y,Stearns G,et al.Cloning and characterization of the cDNA encoding a novel human p re-B-cell colony enhancing factor[J].Mol Cell Biol,1994,14(2):1431-1437.
[10]van derVeer E,Nong Z,O'Neil C,etal.Pre-B-cell colony enhancing factor regulates NAD+dependent protein deacetylase activity and promotes vascular smooth muscle cellmaturation[J].Circ Res,2005,97(1):25-34.
[11]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mim ics the effects of insulin[J].Science,2005,307(5708):426-430.
[12]Ye SQ,Simon BA,Maloney JP,et al.Pre-B-cell colony-enhancing factor as a potential novel biomarker in acute lung in jury[J].Am J Respir Crit Care Med,2005,171(4):361-370.
[13]Shackelford RE,BuiMM,Coppola D,etal.Over-expression of nicotinamide phosphoribosyl transferase in ovarian cancers[J].Int J Clin Exp Pathol,2010,3(5):522-527.
[14]Kitani T,Okuno S,Fujisawa H.Grow th phase-dependent changes in the subcellular localization of p re-B-cell colony-enhancing factor[J].FEBS Lett,2003,544(1-3):74-78.
[15]Kralisch S,Klein J,Lossner U,et al.Hormonal regulation of the novel adipocytokine visfatin in 3T3-L1 adipocytes[J].JEndocrinol,2005,185(3):R1-R 8.
[16]Patrone L,Damorea MA,Lee MB,et al.Genes expressed during the IFNγ-induced maturation of pre-B cells[J].Mol Immunol,2001,38(8):597-606.
[17]Kralisch S,Klein J,Lossner U,et al.Interleukin-6 is a negative regulator of visfatin gene exp ression in 3T3-L1 adipocytes[J].Am JPhysiol EndocrinolMetab,2005,289(4):E586-E590.
Exp ression and localization of nicotinamide phosphoribosyl transferase in salivary glands of rat
ZHAOXi-bo1,ZHANGXin2,LIXiu-xiu3,GAO Yuan3,XIANGBin3,ZHANG Fu-yin1
(1.Department of Oral Maxillofacial Surgery,School of Stomatology,Dalian Medical University,Dalian 116044,China;2.Dalian Yum ing Senior High School,Dalian 116023,China;3.Departmentof Oral Medicine,Medical College,Dalian University,Dalian 116622,China)
[Objective]To investigate the expression and distribution of nicotinamide phosphoribosyl transferase(Nampt)in rat salivary glands.[Methods]The exp ressions of NamptmRNA and p rotein were investigated by reverse transcriptionpolymerase chain reaction(RT-PCR)and Western Blot in the parotid,submandibularandmajor sublingualglands of rat.Immunohistochemical assay was applied to detect the distribution of Nampt in these glands too.[Results]The results of RT-PCR showed that the optical density of the expression of NamptmRNA was 82.04%,50.89%and 30.53%respectively in the parotid,submandibular and major sublingual glands of rat(P<0.05,compared with actin).The results of Western blotshowed that the optical density of the expression of Nampt protein was 77.34%,47.61%and 31.78%,respectively in these glands(P<0.05,compared with actin).Namptprotein waswidely distributed in them,mainly localized in the cytoplasm and nucleus of both serous acinarcells and ductal cells.[Conclusions]NamptmRNA and protein are exp ressed in the parotid,submandibu lar and major sublingual glands of rat,and may be involved in underlyingmechanisms of physiology and patho-physiology in the salivary glands.
nampt;parotid gland;submandibular gland;major sublingual gland
R 780.2
A
1671-7295(2011)01-0001-05
国家自然科学基金项目(30973335);辽宁省教育厅高校科研项目(2008026)
2010-12-03;
2010-12-16
赵西博(1982-),男,河南濮阳人,硕士研究生。
张福胤,教授。E-mail:zhangfuyin@msn.com
