一贯煎对 DMN肝纤维化大鼠肝卵圆细胞增殖分化的影响
2011-02-09朱英,刘平
朱 英,刘 平
(1.大连医科大学 附属第一医院 感染科,辽宁大连 116011;2.上海中医药大学 曙光医院 肝病研究所,上海 201203)
一贯煎对 DMN肝纤维化大鼠肝卵圆细胞增殖分化的影响
朱 英1,刘 平2
(1.大连医科大学 附属第一医院 感染科,辽宁大连 116011;2.上海中医药大学 曙光医院 肝病研究所,上海 201203)
[目的]探讨一贯煎有效逆转大鼠肝硬化的作用途径,促进中医药在组织结构重构研究中的发展。[方法]二甲基亚硝胺(DMN)制备大鼠肝硬化模型,于肝硬化造模成型后,给予一贯煎治疗,以Thy1.1为肝脏卵圆细胞(HOC)标记物,通过免疫组织化学、蛋白定量检测以及激光共聚焦检测技术,观察一贯煎对肝脏干细胞增殖及分化及相关因子的影响。[结果]DMN大鼠肝硬化形成过程中存在 HOC的动态变化,一贯煎组中羟脯氨酸含量减少,与模型组比较差异无显著意义(P>0.05)。Thy1.1与AFP共定位细胞像素密度值明显增高,与模型组比较,差异有显著性意义(P<0.01),Thy1.1与 CK 19共定位细胞像素密度值略高于模型组,差异无显著性意义(P>0.05)。[结论]具备养阴功能的一贯煎可诱导 HOC向肝细胞分化,促进已经成型的肝硬化的逆转,重构损伤的肝组织,从而改善肝脏功能。
一贯煎;DMN肝纤维化大鼠;肝卵圆细胞;增殖分化
肝硬化是伴随肝脏纤维化、肝细胞损伤和肝脏功能障碍的一种慢性疾病。肝纤维化逆转的关键在于病理性沉积的结缔组织的降解与损伤的实质细胞的再生。干细胞的增殖、分化对肝细胞的再生起主要作用。近年来大量研究表明,在抗肝纤维化的治疗中,中药复方多环节、多层次的综合药理学作用具有明显的优势和临床疗效,同时发现中药在干细胞诱导增殖分化方面也具有潜在的作用[1]。
本研究应用二甲基亚硝胺(Dimetlylnit nosamine,DMN)造成类似于人类的大鼠肝硬化模型[2],应用较为敏感的 Thy-1.1作为肝卵圆细胞(hepatic oval cell,HOC)标记物,观察 HOC在肝硬化形成与消减过程中的动态变化;同时应用双重荧光免疫激光共聚焦检测技术观察 HOC的分化趋向;应用一贯煎治疗,观察这些方剂在肝硬化逆转中的作用及其对 HOC的影响,研究中医药在肝硬化组织重构过程中的作用与意义。
1 材料和方法
1.1 研究对象
Wistar大鼠 ,雄性,体重(160±15)g,清洁级 ,由中国科学院上海实验动物中心提供。上海中医药大学实验动物中心清洁区动物房饲养、造模和观察,自由饮食。
1.2 主要试剂
DMN为东京化成工业株式会社产品:lot.MAL05。羟脯氨酸(Hydroxyproline,Hyp)标准品,购自日本ナカラィテスク株式会社,MIR8282。鼠抗α-SMA单克隆抗体为 Sigma公司产品;鼠抗Thy1.1单克隆抗体为 SeroTec公司产品;鼠抗 CK 19和 AFP单克隆抗体为北京中杉金桥生物技术有限公司产品;兔抗 HGF多克隆抗体为 Assay Designs公司产品;兔抗 SCF多克隆抗体为 SantaCruz公司产品;兔抗TGF-β1多克隆抗体为 Bivision公司产品。激光共聚焦检测用 cy3标记(红色)羊抗单克隆抗体及 FITC标记(绿色)驴抗单克隆抗体均为 Jackson Immuno Research公司产品。
1.3 药物
一贯煎 (《柳州医话》,由北沙参、生地、当归 、枸杞、川楝子组成)是上海中医药大学附属曙光医院国家中医药管理局中药制剂中心(国家中医药管理局三级实验室)水煎浓缩煎出液制成流浸膏,冷冻干燥,闭光保存。
1.4 主要仪器
控制系统 olympus PM-30;HPIAS-1000高清晰彩色病理图文分析系统,购自同济大千屏影像公司;复日 FR-980生物电泳图像分析系统,上海复日科技有限公司产品。激光共聚焦显微镜,为日本OLYMPUS公司产品,共聚焦型号为 FV1000SIMS Scanner,所用谱线为 488 nm、543 nm两种激光谱线,物镜为 PLSAPO60X(数值孔径为 1.4),显微镜型号为 IX81。
1.5 模型制备
Wistar大鼠 32只,雄性,重量为 (160±15)g。参照 Jenkins等[3]介绍的方法制备 DMN肝硬化模型。按 DMN 10mg/kg剂量(用生理盐水稀释)处理动物,腹腔注射,每周连续 3 d,1次/d,共 4周。正常对照大鼠腹腔注射同等量生理盐水。
1.6 分组与给药
于 DMN腹腔注射 4周造模完成后,将模型大鼠随机分为模型对照组、一贯煎组每组 12只,正常对照组 8只。于第 5周第 1天起,一贯煎按 60 kg成人体重日剂量的 10倍量灌胃,1次/d,共 2周;正常对照组及模型对照组以同体积生理盐水给予相应处理。
1.7 样品的采集
大鼠予戊巴比妥钠 40mg/kg体重剂量腹腔注射麻醉后打开腹腔,取 0.3~0.4 cm厚肝组织,OTC液包埋,液氮迅速冷冻,用恒冷切片机在 -20℃下进行 6μm厚连续冰冻切片,用于免疫组化染色。取1.0 cm×0.8 cm×0.3 cm肝组织,10%中性福尔马林液固定,24 h后逐级酒精脱水,二甲苯透明,56℃石蜡包埋,4μm厚切片,用于免疫组化染色。取肝组织 -70℃保存以备羟脯氨酸(Hyp)及 Western Blot检测。
1.8 观测项目与方法
1.8.1 肝组织 Hyp含量检测:采用 Jamall氏法[3]。
1.8.2 肝组织 α-SMA、Thy1.1、HGF、TGFβ1和SCF免疫组化观测:应用 Envision法检测。其中Thy1.1和 TGFβ1采用冰冻肝组织切片,α-SMA、HGF和 SCF采用石蜡切片。
1.8.3 肝组织 α-SMA、Thy1.1、HGF、TGFβ1和SCF蛋白定量分析:用免疫印迹法进行检测。
1.8.4 肝组织 AFP、CK 19与 Thy1.1共定位:采用冰冻肝组织切片,应用双重荧光免疫共聚焦激光扫描显微镜技术检测(Double Immuno Confocal Laser Scan Microscopy,DICLSM)。
1.9 统计学方法
计量资料用计算机统计软件 SPSS10.0中的ANOVA程序进行单因素方差分析,并用 LSD程序进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 肝组织病理学的变化
2.1.1 肝组织 Hyp含量的变化:与正常对照组大鼠比较,模型对照组的肝组织 Hyp含量显著增加(P<0.01);与模型对照组相比,一贯煎组有所降低,但差异无显著性意义(P>0.05)(图 1)。
2.1.2 肝组织 α-SMA蛋白表达的变化:α-SMA免疫组化结果显示,终止 DMN刺激后 2周,即 6周模型对照组大鼠肝组织 α-SMA表达明显多于正常对照组,主要表达于星状细胞,位于汇管区、纤维间隔及肝窦部位。与模型对照组大鼠比较,一贯煎组α-SMA表达明显减少,蛋白免疫印迹分析结果与免疫组化阳性染色动态变化趋势一致(图 2)。
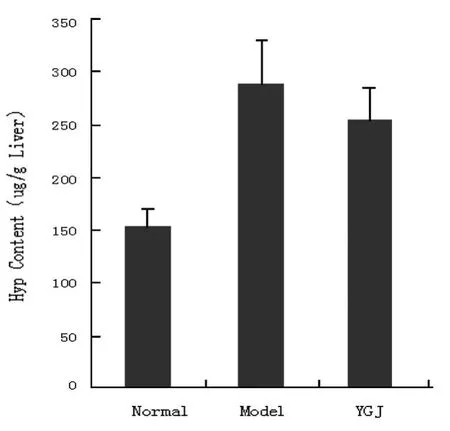
图1 肝组织羟脯氨酸(Hyp)含量的变化Fig 1 Change of hyd roxyp roling content in liver tissue Normal:正常组 ;Model:模型组 ;YGJ:一贯煎组

图2 肝组织 α-SMA免疫组织化学与免疫印迹检测Fig 2 Immunohistochem istry and Immunoblot ofα-SMA in liver tissueA:正常组(N);B:模型组(M);C:一贯煎组(J)
2.2 肝卵圆细胞标志物的变化
2.2.1 肝组织 Thy1.1蛋白表达的变化:肝组织Thy1.1免疫组化显示,模型对照组大鼠肝组织的Thy1.1高度表达于肝脏卵圆细胞,为胞膜染色,主要位于汇管区及纤维间隔周围,新生胆管上皮细胞明显染色。与模型对照组比较,一贯煎组阳性染色细胞增加,蛋白免疫印迹分析结果与免疫组化染色变化趋势基本一致(图 3)。
2.2.2 DICLSM检测肝组织 AFP、CK 19与 Thy1.1共定位:AFP与 Thy1.1共定位的变化:正常对照组大鼠肝组织中未见到 AFP与 Thy1.1共定位阳性细胞表达,6周模型大鼠有较多表达。与模型对照组比较,一贯煎组阳性表达量显著增加(P<0.01)(图 4)。胞;A 2,Thy1.1荧光染色,无阳性染色细胞;A3,AFP与 Thy1.1共聚焦染色,无共定位染色细胞;A 4,共定位细胞密度分布为零。
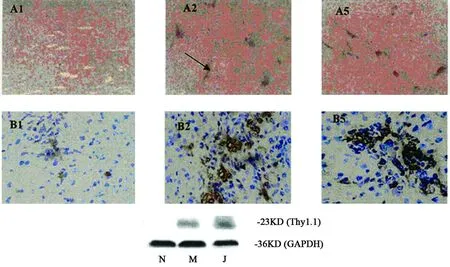
图3 肝组织Thy1.1免疫组化与免疫印迹染色Fig 3 Immunohistochem istry and Immunoblot of Thy1.1 in liver tissueA:肝脏 Thy1.1免疫组化阳性染色细胞变化(100×)。A 1:正常组(N),未见阳性染色细胞。A 2:模型组(M)终止造模后 2周,汇管区出现大量阳性染色细胞,形成团簇样,并形成胆小管。A 3:一贯煎组(J),汇管区出现大量阳性染色细胞,多于模型组B:肝脏 Thy1.1免疫组化阳性染色细胞变化(400×)。B1:正常组(N),未见阳性染色细胞。B2:模型组(M)终止造模后 2周,汇管区出现大量阳性染色细胞,形成团簇样,并形成胆小管。B 3:一贯煎组(J),汇管区出现大量阳性染色细胞,多于模型组
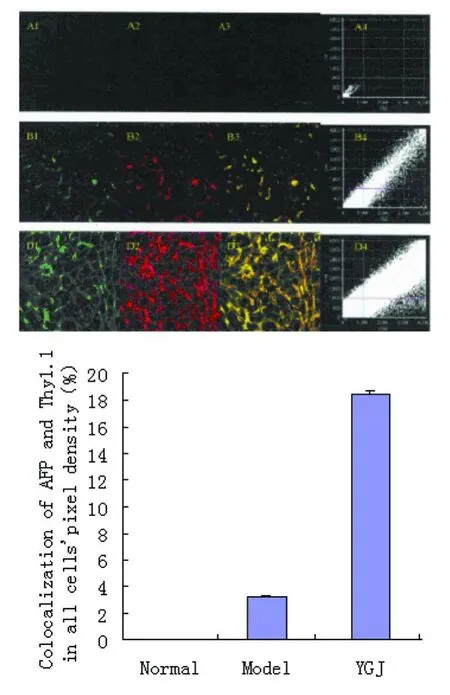
图4 DICLSM检测肝组织 AFP与 Thy1.1共定位Fig 4Colocalization of AFP and Thy1.1 in liver tissueA:正常组(Normal):A 1,肝组织 AFP荧光染色,无阳性染色细
B:模型组(Model):B1,肝组织 AFP荧光染色,出现红色染色细胞;B2,肝组织 Thy1.1荧光染色,出现绿色染色细胞;B3,AFP与Thy1.1共聚焦染色,出现黄色共定位染色细胞;B4,共定位细胞密度分布增加。
C:一贯煎组(YGJ):C 1,肝组织 AFP荧光染色,绿色染色细胞多于模型组;C2,肝组织 Thy1.1荧光染色,绿色染色细胞多于模型组;C3,AFP与 Thy1.1共聚焦染色,黄色共定位染色细胞多于模型组;C4,共定位细胞密度分布多于模型组。
CK19与 Thy1.1共定位的变化:正常对照大鼠肝组织中未见到 CK19与 Thy1.1共定位阳性细胞,6周模型对照组大鼠有显著表达。一贯煎组阳性表达量与模型对照组比较,差异无显著性意义(P>0.05)(图 5)。
2.3 HGF、SCF及 TGFβ1等生长因子变化
2.3.1 肝组织 HGF蛋白表达变化:正常对照组大鼠肝组织中 HGF蛋白呈较高水平表达;模型对照组大鼠仅有微量表达;与模型对照组比较,一贯煎组蛋白表达无明显变化(图 6)。

图5 DICLSM检测肝组织 CK 19与 Thy1.1共定位Fig 5 Colocalization of CK19and Thy1.1 in liver tissue

图6 肝组织HGF免疫印记Fig 6 Immu noblot of HGF in liver tissue N:正常组;M:模型组;J:一贯煎组
2.3.2 肝组织 SCF蛋白表达变化:正常对照组大鼠肝组织中可见 SCF蛋白少量表达,模型对照组表达明显高于正常对照组;与模型对照组比较,一贯煎组表达减少。该结果与肝组织 SCF免疫组化阳性染色变化趋势基本一致(图 7)。

图7 肝组织SCF免疫印记Fig 7 Immunoblotof SCF in liver tissue N:正常组;M:模型组;J:一贯煎组
2.3.3 肝组织 TGFβ1蛋白表达变化:正常对照组大鼠肝组织中未见到 TGFβ1蛋白表达,而 DMN模型对照组有大量表达;与模型对照组比较,一贯煎组无显著变化,接近模型对照组水平(图 8)。

图8 肝组织 TGFβ1免疫印记Fig 8 Immunoblot of TGFβ1 in liver tissue N:正常组;M:模型组;J:一贯煎组
3 讨 论
目前,纤维化或早期硬化组织器官的结构重构成为现代生物医学中的重大科学问题,而干细胞已成为组织器官结构重构过程中的研究焦点。现有研究显示肝组织中存在干细胞并参与了肝细胞再生和肝损伤修复,骨髓、胚胎等多种来源的干细胞也具有向肝细胞分化的潜能,这些结果显示了从干细胞的角度探讨肝细胞再生机制及再生肝脏功能的可行性和重要性。
关于干细胞(stem cells,SC)的研究发现,肝组织中存在有肝再生的种子细胞,即肝干细胞(hepatic stem cells,HSC),这些细胞在一定的条件下,可以增生分化为肝细胞[4]。在严重肝损伤时,如当肝组织损伤为广泛和慢性的或者肝细胞的增殖被抑制(如病毒感染)时,HSC被激活。在正常成年肝细胞(hepatic cell,HC)更新过程中有低水平、基础状态的 HSC参与分化。在胚胎发育过程中,HSC主要以成肝细胞的形式存在,而在成年组织则以卵圆细胞(hepatic oval cell,HOC)和小肝细胞(small hepatocyte-like progenitor cells,SHPC)的形式存在。在人慢性肝脏疾病中,HOC和疾病的严重程度有关和成熟肝细胞的增生抑制有关[5]。
本研究表明,DMN大鼠肝硬化形成过程中存在HOC的动态变化,即细胞的数量随着肝纤维化程度的不断加重而增加;在停止 DMN造模 2周后,即于肝纤维化开始消减时,该细胞数量的增加更为显著,随着肝纤维化的消减、停止 DMN造模 4周后,其数量有所减少[5]。表明 HOC的此种动态变化与大鼠肝硬化的形成与消减的病理变化有关,尤其对肝纤维化的消减具有重要病理生理意义。干细胞因子(SCF)表达对 DMN大鼠肝硬化形成与消减过程中HOC数量的动态变化具有重要作用,转化生长因子(TGFβ1)在肝硬化形成与逆转过程中可能起到控制HOC过度增殖的作用[6]。本实验中,一贯煎可显著降低血清 AST、T.Bil水平;也有一定降低肝组织Hyp含量的作用,改善肝组织炎症和纤维化程度;减少肝组织 α-SMA的表达;提高 Thy1.1的表达,可显著提高 Thy1.1和 AFP共定位细胞的表达。
在 DMN大鼠肝硬化模型中,一贯煎能够降低血清 AST、T.Bil和肝组织 α-SMA水平,同时在DMN大鼠肝硬化的逆转过程中能够增加 Thy1.1标记的 HOC的数量,并明显增加 Thy1.1与 AFP共定位细胞数量。表明具有养阴功效的一贯煎在 DMN大鼠肝硬化逆转过程中,也可有效促进 HOC的活化和增殖,通过改善肝脏微环境主要诱导 HOC向肝细胞分化,同时也有诱导 HOC向胆管上皮细胞分化的作用,从而改善 DMN大鼠肝硬化的肝功能和肝组织病理,重构损伤的肝脏,以利于肝硬化的逆转。因此,养阴一贯煎可促进 DMN大鼠肝硬化的逆转过程中 HOC的增殖,重在诱导 HOC向肝细胞的分化。进一步深入研究该方剂诱导 HOC分化的作用机制不仅有重要的应用价值,对中医药基础研究也将有重要的理论意义。
[1]慕永平,刘平,龙爱华,等.CCl4大鼠肝硬化成型阶段中医方证病机的研究[J].中国中西医结合杂志,2006,26(4):344-347.
[2]朱英,刘平.Thy1.1阳性肝脏卵圆细胞在大鼠肝硬化形成与消减过程中的动态表达[J].中华肝脏病杂志,2005,13(11):823-827.
[3]Jenkins SA,Grandison A,Baxter JN,et al.A dimethylnitrosamine-inducedmodelof cirrhosis and portal hypertension in the rat[J].JHepatol,1985,1:489-499.
[4]Laurson J,Selden C,Hodgson HJ.Hepatocyte progenitors in man and in rodents-multiple pathway,multip le candidates[J].Int JExp pathol,2005,86:1-18.
[5]耿莹,韩明子,洪钰,等.不同移植途径对大鼠骨髓干细胞迁移至肝脏及分化的影响[J].中华器官移植杂志,2008,29(7):402-404.
[6]朱英,刘平.肝脏卵圆细胞定向分化在二甲基亚硝胺大鼠肝硬化消减过程中的意义[J].大连医科大学学报,2007,29(2):106-109.
Effect of YGJ on proliferation and differenciation of hepatic oval cells in rat cirrhosisby DMN
ZHU Ying1,LIU Ping2
(1.Department of Infectious Disease,the First Affiliatde Hospital of Dalian Medical University,Dalian 116011,China;2.Institute of Liver Disease,ShanghaiUniversity of Traditional ChineseMedicine,Shanghai 201203,China)
[Objective]Discuss effectof YGJ in cirrhosis reverse,promote development of chinese traditionalmedicine in tissue remodeling.[Methods]Ratcirrhosismodelwas set up by dimethylnitrosamine(DMN),treated with YGJaftermodeling.Thy1.1was used asmarker ofhepatic oval cells(HOCs).Immunohistochemistry,Immunoblotand DICLSM were app llied to detect effect of YGJon proliferation and differenciation of HOC and interrelated faction in rat cirrhosis.[Results]There was dynamics change during cirrhosis progress.Contentof hyd roxyp roling(Hpy)decreased in YGJ.There was significantmeaning compared with themodel(P<0.01).Pixel density of colocalized cells of AFPand Thy1.1 was obvious higher.There was significantmeaning compared with themodel(P<0.01),thatof CK 19and Thy1.1were slighter higher,and no significantmeaning compared with themodel(P>0.05).[Conclusion]YGJwith function of nourishing Yin will induce HOCs differentiate into hepatocytes,promote cirrhosis reverse,rebuilt damaged liver tissue,improve liver function.
YGJ;cirrhosis of ratby DMN;hepatic oval cells(HOCs);p roliferation and differentiation
R 575.2
A
1671-7295(2011)01-0011-06
辽宁省教育厅科研项目(L2010128);辽宁省医学高峰建设工程项目(200919);大连市科技计划项目(2009E12SF153);大连市科技局国际合作项目(2009F11GH 178)
2010-12-08;
2010-12-15
朱 英(1965-),女,江苏无锡人,主任医师,博士。 E-mail:zhuuyingshu52@126.com
刘 平,教授,博士生导师。E-mail:liuliver@online.sh.cn
