黄连素对 2型糖尿病中国地鼠肝脏固醇调节元件结合蛋白转录调节系统表达的影响
2011-02-09刘栩晗李国生刘亚莉马春梅
刘栩晗,李国生,黄 澜,朱 华,刘亚莉,马春梅
(1.大连市中心医院内分泌科,辽宁 大连 116003;2.大连医科大学附属第一医院病理科,辽宁 大连 116011;3.中国医学科学院医学实验动物研究所病理科,北京 100021)
黄连素对 2型糖尿病中国地鼠肝脏固醇调节元件结合蛋白转录调节系统表达的影响
刘栩晗1,李国生2,黄 澜3,朱 华3,刘亚莉3,马春梅3
(1.大连市中心医院内分泌科,辽宁 大连 116003;2.大连医科大学附属第一医院病理科,辽宁 大连 116011;3.中国医学科学院医学实验动物研究所病理科,北京 100021)
[目的]研究黄连素对2型糖尿病中国地鼠肝脏固醇调节元件结合蛋白(SREBPs)、其调控基因及靶基因表达的影响,探讨黄连素治疗脂诱性肝胰岛素抵抗的分子机制。[方法]以高脂饮食及结合小剂量链脲菌素的方法建立胰岛素抵抗和 2型糖尿病中国地鼠模型。成模后随机分成正常对照组、胰岛素抵抗组、2型糖尿病组和 2型糖尿病黄连素治疗组,治疗 9周。应用实时定量PCR方法检测各组地鼠肝脏 SREBPs、其调控基因及靶基因的表达。[结果]PCR结果显示模型地鼠脂肪变的肝脏中SREBPs基因、SREBPs切割激活蛋白(SCAP)基因、蛋白酶 S1P和S2P基因和 SREBPs靶基因的表达增加,胰岛素诱导基因(Insigs)的表达降低。黄连素有效地改善胰岛素抵抗,同时,逆转了SREBPs、其调控基因及靶基因表达的改变。[结论]SREBPs转录调控系统参与黄连素治疗 2型糖尿病地鼠脂诱性肝胰岛素抵抗。
黄连素;2型糖尿病;固醇调节元件结合蛋白;胰岛素抵抗;中国地鼠;肝脏
胰岛素抵抗和胰岛素分泌受损是 2型糖尿病的重要特征。依据药物的作用机制,目前用于治疗 2型糖尿病的药物主要分为胰岛素增敏性药物和促胰岛素分泌性药物。黄连素是我国传统中草药黄连的主要生物活性成分,具有胰岛素增敏性药物的作用特点及较小的毒副作用。糖尿病脂毒性理论提出:高脂饮食性肥胖发生 2型糖尿病的潜在机制是胰岛素敏感组织异位脂沉积造成的脂诱性胰岛素抵抗[1,2]。因此,脂诱性肝脏胰岛素抵抗在肥胖相关 2型糖尿病形成中发挥重要作用。作者选择具有糖尿病易感性和脂代谢类人性的中国地鼠[3]建立肥胖胰岛素抵抗和2型糖尿病地鼠模型并研究黄连素对糖尿病地鼠肝脏 SREBPs转录调控系统表达的影响,探讨黄连素治疗肝脏脂诱性胰岛素抵抗的分子机制。
1 材料和方法
1.1 实验动物
健康中国地鼠,雌雄各半,60只,清洁级,血糖(4.41±0.59)mmol/L,26周龄,体重 (124.0±10.5)g,购自四川省医学科学院实验动物研究所,许可证号:SCXK(川)2004216。单笼饲养,饲以标准的颗粒饲料,自由摄食摄水,12 h光照周期。
1.2 主要药品试剂及仪器
高脂饲料购自军事医学科学院实验动物中心,配方为:1%胆固醇,0.02%牛胆酸钠,10%猪油,10%蛋黄粉及 78.98%基础饲料。链脲菌素(STZ)购自 Sigma公司。应用稳豪 One-Touch血糖仪监测血糖。鼠胰岛素 ELISA试剂盒(美国 Linco公司)购自吉泰公司。血甘油三酯(TG)试剂盒、游离脂肪酸(FFAs)试剂盒、低密度脂蛋白(LDL)试剂盒、高密度脂蛋白(HDL)试剂盒、总胆固醇(TC)试剂盒(Randox公司)均购自北京九强生物技术有限公司。日立 8060全自动生化分析仪。RNA提取试剂盒(RNeasy Mini Kit,德国 Qiagen公司)和逆转录试剂盒(Omniscript Reverse Transcription Kit,德国 Qiagen公司)购自基因有限公司。HotStarTaqTMDNA聚合酶(TaKaRa)购自百灵克公司,Mg2+及缓冲液为 Taq酶自带 。 RNase inhibitor、Oligo-dT(美国 Promea公司)和实时荧光定量 PCR反应试剂盒(iQ SYBR Green PCR Kit,美国 Bio-rad公司)购自东胜创新公司。实时荧光定量 PCR仪(美国 Bio-rad公司)。紫外分光光度计(美国 Amersham公司)。其余常用试剂购自北京鼎国生物技术公司。黄连素原料药,批号:200506065,购自东北制药总厂。
1.3 动物模型制备、分组及治疗
参照相关的造模方法[4-6]建立肥胖胰岛素抵抗和 2型糖尿病地鼠模型并加以改进。健康地鼠 60只,雌雄各半,随机分为普食正常对照组和高脂饮食组,前者 10只,饲以普通饲料;后者 50只,饲以高脂饮食。饲养 4周后,高脂饮食喂养的地鼠自发形成肥胖性胰岛素抵抗状态,将这些肥胖性胰岛素抵抗地鼠随机分成 2组,一组(40只地鼠)禁食 12 h后,按 40mg/kg(将 STZ用 0.1mmol/L,pH 4.2的无菌柠檬酸缓冲液配制成 1%STZ溶液,0.2 mm微孔过滤灭菌)的剂量间隔 2 d 2次腹腔注射 STZ,注射后继续禁食 12 h建立 2型糖尿病模型。另一组(10只)及普食正常对照组(10只)注射等量的 0.1 mmol/L,pH 4.2的无菌柠檬酸缓冲液(注射方式和剂量相同)。处理后,各组地鼠继续维持原饮食 2周。糖尿病和胰岛素抵抗地鼠模型依据空腹血糖(糖尿病地鼠≥9 mmol/L)和口服葡萄糖耐量试验确定。造模结束时共得到 2型糖尿病地鼠 29只,选择 20只,随机分为 2型糖尿病组和黄连素治疗的 2型糖尿病组,每组 10只,再将普通饲料组作为对照组,单纯高脂饮食选择 10只作为胰岛素抵抗组,共4组。黄连素治疗组按每日每只灌服 150 mg/kg黄连素(溶于羧甲基纤维素/PBS溶液)的剂量给药 9周。对照组、胰岛素抵抗组和 2型糖尿病组每日每只灌服相应剂量的羧甲基纤维素/PBS溶液。治疗期间对照组喂以普通饲料,其余各组继续喂以高脂饲料。实验结束时,各组地鼠禁食 12 h,在禁食 9.5 h时称重同时给药,在给药 2.5 h时,乙醚麻醉,眼内眦静脉取血并处死,剖开腹腔,迅速取出肝脏、称重、大部分肝脏液氮速冻并保存于 -80℃备用,少部分肝脏固定于 10%中性甲醛溶液。4℃3000 r/m in离心 20min分离血浆并保存于 -80℃备用。
1.4 口服葡萄糖耐量试验(OGTT)和糖耐量试验曲线下面积(AUC)
地鼠禁食 12 h后,给予葡萄糖 2 g/kg灌胃,乙醚麻醉后,在设定的时间点 (0、30、60、120和 180 min)眼内眦静脉取血测血糖。糖耐量曲线下面积 =1/2空腹测定值 +60 min测定值 +120 min测定值 +1/2 180m in测定值。
1.5 血生化检测
血浆 FFAs、TC、LDL、HDL和 TG的浓度采用Randox公司试剂盒,应用日立 8060全自动生化分析仪进行检测。应用稳豪血糖仪检测血糖。应用Linco公司鼠胰岛素 ELISA试剂盒检测血浆胰岛素浓度。
1.6 组织形态学观察
肝组织固定于 10%中性甲醛溶液,逐级脱水,石蜡包埋,切片,HE染色,光镜观察。
1.7 RNA的提取及逆转录反应
取冻存肝组织 30 mg,按 RNeasy Mini Kit说明书提取总 RNA。RNA浓度及纯度用紫外分光光度计(Amersham)进行检测。保证 260/280在 1.8~2.0之间,并用 1%琼脂糖凝胶电泳鉴定完整性。逆转录反应:1μg总 RNA,5×iScript Mix 4μL,iScript反转录酶 1μL,去核酸酶水 12μL,组成总体积 20 μL的反应体系。反应条件:25℃,5 m in;42℃,30 min;85℃,5min,冷却至 4℃。
1.8 实时定量 PCR检测
在实时定量 PCR扩增之前对引物进行普通PCR扩增以得到最适反应条件。实时荧光定量PCR按 iQ SYBR Green Mix Kit说明书操作。建立15μL的反应体系:50 ng总 RNA的逆转录产物,上游引物 0.5μL(6μmol/L),下游引物 0.5μL(6 μmol/L),2×iQ SYBRGreen Mix 7.5μL,去离子水5.5μL。使用 iQ Syber Green Supermix和 iCycler iQ Real-Time PCR Detection System扩增。反应条件是:95℃ 3min,95℃ 10 s,59℃45 s,45个循环。扩增之后,做溶解曲线检测产物的均一性,反应从59℃开始,每个循环 10 s上升 0.5℃,共 80个循环。每个反应均重复 3次。设立阴性对照。扩增之前测定每对引物的扩增效率,经检测所用引物的扩增效率均接近于 1。样本目标基因相对含量的计算使用2(-Delta Delta C(T))方法[7]。β-actin作为内参基因。引物序列见表 1。

表 1 实时荧光定量PCR引物列表Tab 1 Primers used for real-time RT-PCR
1.9 统计学方法
实验数据以均数 ±标准差(mean±SD)表示。统计学差异使用 SPSS13.0进行 t检验和单因素方差分析检验。P≤0.05为差异有统计学意义。
2 结 果
2.1 胰岛素抵抗组、2型糖尿病组和黄连素组地鼠的代谢特征
各组地鼠的表型和代谢特征见表 2。实验结束时,与对照组相比,胰岛素抵抗地鼠和 2型糖尿病地鼠的体重显著增加(P<0.05),表现肥胖,但两者之间的体重差异无显著性意义 (P>0.05)。胰岛素抵抗地鼠和 2型糖尿病地鼠的肝脏重量明显增加(P<0.05),肝重/体重的比值显著高于对照组(P<0.05),肝脏呈肿大状态。与对照组相比,除了 HDL水平降低以外,胰岛素抵抗地鼠和 2型糖尿病地鼠的血脂(包括 FFAs、TC、LDL和 TG)水平显著升高(P<0.05)。胰岛素抵抗地鼠的血糖虽然有所升高,但未达到糖尿病的血糖标准。与对照地鼠和胰岛素抵抗地鼠相比,2型糖尿病地鼠的血糖显著升高(P<0.05)。与对照组相比,胰岛素抵抗地鼠表现明显的高胰岛素血症,而 2型糖尿病地鼠的胰岛素水平与对照组相似。与对照组相比,胰岛素抵抗地鼠和 2型糖尿病地鼠 OGTT各指定点的血糖值增高(P<0.05),血浆胰岛素的水平异常,OGTT的糖曲线下面积增大(P<0.05),胰岛素抵抗地鼠的胰岛素曲线下面积增大(P<0.05),而 2型糖尿病地鼠的胰岛素曲线下面积与对照组地鼠相近似(图1)。胰岛素抵抗地鼠和 2型糖尿病地鼠的胰岛素敏感指数降低(P<0.05),而胰岛素抵抗指数升高(P<0.05)(表 2)。经过黄连素治疗后,糖尿病地鼠的体重有所降低,但无显著性意义(P>0.05)。与糖尿病地鼠相比,黄连素治疗组地鼠的肝脏重量明显降低(P<0.05)。除了 HDL水平增高以外,治疗组地鼠的血脂(FFAs、TC、LDL和 TG)水平和血糖浓度显著的降低(P<0.05)。治疗组地鼠血浆胰岛素水平与对照组地鼠和模型组地鼠血浆胰岛素水平相似。与糖尿病地鼠相比,治疗组地鼠的 OGTT各指定点的血糖浓度减低(P<0.05),各指定点血浆胰岛素的分泌和分泌水平趋近于恢复正常。治疗组地鼠糖曲线下面积减少(P<0.05),胰岛素曲线下面积与模型组相比无差异(P>0.05)(图 1)。治疗组地鼠胰岛素敏感指数增大而胰岛素抵抗指数减小(P<0.05)(表 2)。

表 2 对照组、胰岛素抵抗组、2型糖尿病组和黄连素治疗组地鼠的代谢表型特征Tab 2 Basalmetabolic characterization of control,insulin-resistant,diabetic and berberine-treated diabetic groups

图1 对照组、胰岛素抵抗组、2型糖尿病组和黄连素治疗组地鼠口服糖耐量试验Fig 1Oralglucose tolerance tests(OGTT)in control,insulin-resistant,diabetic and berberine-treated diabetic hamsters口服葡萄糖耐量试验A:葡萄糖曲线;B:胰岛素曲线;C:葡萄糖曲线下面积;D:胰岛素曲线下面积*与对照组比较,P<0.05;#2型糖尿病组与治疗组比较,P<0.05
2.2 胰岛素抵抗组、2型糖尿病组和黄连素治疗组地鼠肝脏组织形态改变
组织形态学研究显示,对照组地鼠肝组织结构和细胞形态正常。胰岛素抵抗地鼠和 2型糖尿病地鼠均出现肝脏脂沉积(肝脂肪变性)。胰岛素抵抗地鼠的肝细胞内出现中等大小和较大的脂滴并呈现中重度的肝脏脂肪变性。2型糖尿病地鼠的肝细胞内出现中等大小和较大的脂滴并且含有较大脂滴的肝细胞数目稍增多,但亦呈现中重度的肝脏脂肪变性。总体看来,二者肝脏脂沉积程度相似,无本质差异。黄连素治疗组地鼠肝脏内也见脂肪沉积。肝细胞内见中小脂滴,有的仅为小脂滴并呈现轻中度的肝脏脂肪变性,与糖尿病地鼠肝脏的病变程度有明显的差异(图 2)。
2.3 胰岛素抵抗组、2型糖尿病组和黄连素治疗组地鼠肝脏中 SREBPs、其调控基因及靶基因表达的改变
实时定量 RT-PCR的结果(RT-PCR产物的琼脂糖电泳图见图 3)显示与对照组相比,胰岛素抵抗地鼠和 2型糖尿病地鼠肝脏中 SREBPs(SREBP-1a、SREBP-1c和 SREBP-2)基因 、SCAP基因、S1P和 S2P基因的表达增加,Insigs(Insig-1和 Insig-2)基因的表达降低。SREBP-1c调节的脂肪酸合成相关靶基因,如脂肪酸合成酶(FAS)、乙酰辅酶 A羧化酶(ACC)和硬脂酰辅酶 A去饱和酶 -1(SCD-1)的表达升高。SREBP-2调节的胆固醇代谢相关靶基因,如羟甲戊二酰辅酶 A合成酶(HMG CoA synthase)、羟甲戊二酰辅酶 A还原酶(HMG CoA reductase)和高密度脂蛋白受体(LDLR)的表达也增加。SREBPs、其调控基因及靶基因表达的改变在胰岛素抵抗地鼠和 2型糖尿病地鼠之间差异存在显著性意义 (P<0.05)。黄连素治疗后,与对照组相比,黄连素治疗组地鼠肝脏中 SREBPs、SCAP、S1P、S2P、FAS、ACC、SCD-1、HMG CoA synthase、HMG CoA reductase和 LDLR的表达增加,Insigs的表达也增加。但与 2型糖尿病组地鼠相比较,黄连素治疗组地鼠肝脏中 SREBPs、SCAP、S1P、S2P、FAS、ACC、SCD-1、HMG CoA synthase、HMG CoA reductase和 LDLR的表达显著降低,Insigs的表达显著增加。SREBPs、其调控基因及靶基因表达的改变在黄连素治疗组和 2型糖尿病组之间差异存在显著性意义 (P<0.05)(图 4)。
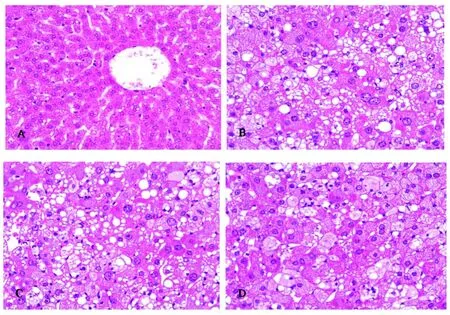
图2 对照组、胰岛素抵抗组、2型糖尿病组和黄连素治疗组地鼠肝脏的形态学改变(HE染色,200×)Fig 2 Alteration in morphology of livers from control,insulin-resistant,diabetic and berberine-treated diabetic groups(H&E stain,200×)A:对照组肝脏;B:胰岛素抵抗组肝脏;C:2型糖尿病组肝脏;D:黄连素治疗组肝脏

图3 RT-PCR产物的琼脂糖电泳图Fig 3 The picture of agarose gel electrophoresis of products of RT-PCR
3 讨 论
胰岛素抵抗是 2型糖尿病发生的重要诱发因素。糖尿病脂毒性学说提出脂诱性肝胰岛素抵抗是饮食诱导的肥胖相关 2型糖尿病重要的发病机制之一。所以,胰岛素增敏剂对脂诱性肝胰岛素抵抗的治疗是治疗饮食诱导的肥胖相关 2型糖尿病的重要策略。黄连素是作为糖尿病治疗方剂的主要成份之一的中草药黄连的主要生物活性成份之一,是一种异喹啉生物碱,具有广泛的药理学和生物化学效应。实验研究显示黄连素具有胰岛素增敏剂的药理学特性,其治疗机制可能是受体后效应[8,9]。尽管目前对黄连素降低 2型糖尿病血糖血脂作用的分子机制已有相关研究,但黄连素对 2型糖尿病胰岛素抵抗,尤其是对脂诱性肝胰岛素抵抗治疗作用的分子机制了解甚少。本研究结果显示 SREBPs、其调控基因及靶基因参与了黄连素治疗 2型糖尿病地鼠脂诱性肝胰岛素抵抗。
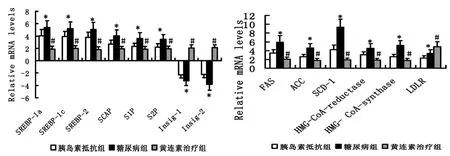
图4 黄连素对肝脏SREBPs、其调控基因及靶基因表达的影响Fig 4 The effects of berberine on the exp ression of hepatic SREBPs,their regulating genes and their target genes*糠尿病组与胰岛素抵抗组比较,P<0.05;#黄连素治疗组与 2型糠尿病组比较,P<0.05
SREBPs属于转录因子家族,哺乳动物细胞基因组编码 3个 SREBP的异构体,分别为 SREBP-1a、SREBP-1c和 SREBP-2。SREBP-1a具有较高的转录活性,是所有 SREBP敏感基因的激活者,包括胆固醇、脂肪酸和甘油三酯的合成。SREBP-1优先增强脂肪酸合成基因的转录与脂肪酸的合成,而SREBP-2则优先激活胆固醇的合成[10]。SREBPs的转录后调节与 SCAP、S1P、S2P、Insigs和细胞内脂的含量及种类相关[11]。本研究结果显示与对照组相比,胰岛素抵抗地鼠和 2型糖尿病地鼠肝脏中SREBPs、SCAP、S1P、S2P及 SREBPs靶基因的表达增加,Insigs(Insig-1和 Insig-2)的表达降低。在黄连素治疗地鼠肝脏中上述基因表达相反。这些基因表达改变显示胰岛素抵抗地鼠和 2型糖尿病地鼠肝脏中表达增加的 SCAP基因有助于增强伴侣作用,护送 SREBPs到达高尔基体。表达增加的蛋白酶 S1P和 S2P基因有助于增强切割水解释放出成熟的 SREBPs(nSREBPs),进而有助于成熟的SREBPs进入核内诱导胆固醇和脂肪酸合成基因的转录。当细胞内胆固醇或氧化胆固醇浓度较高时,SCAP/SREBPs复合体驻留在内质网中,当细胞内胆固醇或氧化胆固醇浓度较低或排空时,SCAP护送SREBPs到达高尔基体进行水解[11]。Insigs具有与胆固醇协同抑制 SCAP/SREBPs复合体从内质网到高尔基体的运输作用[12,13]。本实验结果显示降低表达的 Insigs似乎在细胞内胆固醇增高时不能有效地以一个固醇依赖的方式与 SCAP相互作用并形成一个 SCAP/SREBPs/Insigs复合物,使 SCAP/SREBPs复合体驻留在内质网中。因此,胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中上述 SREBPs调控基因表达的改变有助于 SREBPs基因表达产物的成熟及其诱导成脂效应的发挥。模型地鼠肝脏增加表达的SREBPs可能主要由高脂饮食[14]或增高的血糖[15]诱导形成并通过此机制加速成熟并发挥成脂效应。同时,本研究结果显示在胰岛素抵抗地鼠和 2型糖尿病地鼠肝脏中 SREBPs的靶基因 FAS、ACC、SCD1、LDLR、HMG CoA synthase和 HMG CoA reductase的表达增加。表达增强的 SREBP-1c将诱导脂合成基因,如 FAS,ACC和 SCD1的表达,增加肝脏甘油三酯的沉积[16],有助于脂诱性胰岛素抵抗的形成。另外,增强表达的 SREBP-1c也可以通过直接抑制胰岛素受体底物 2基因转录而抑制胰岛素信号通路,从而引起或加重胰岛素抵抗[17]。表达增强的 SREBP-2将诱导 LDLR,HMG CoA synthase和HMG CoA reductase的表达而增加胆固醇的摄取和合成[18]。表达增强的 SREBP-1a似乎可以同时参与脂和胆固醇的合成[19]。因此,表达改变的 SREBPs转录调控系统将导致肝脏脂代谢异常和脂沉积,这将有助于胰岛素抵抗地鼠和 2型糖尿病地鼠脂诱性肝胰岛素抵抗的形成。黄连素逆转了 SREBPs、其调控基因及靶基因在 2型糖尿病地鼠肝脏中的表达,似乎具有 SREBPs剂量效应调节剂的性质。黄连素降低了糖尿病状态下表达增加的 SCAP、S1P和S2P的表达。表达降低的 SCAP有助于减弱护送SREBPs到高尔基体的伴侣作用。表达降低的 S1P和 S2P有助于减少 SREBPs的成熟,进而有助于削弱成熟的 SREBPs对胆固醇和脂肪酸合成基因的激活效应。同时,黄连素增加了糖尿病状态下表达降低的 Insigs的表达。表达增加的 Insigs有助于在细胞内胆固醇增高时有效地抑制 SCAP/SREBPs复合体从内质网的外输。在黄连素治疗地鼠肝脏中表达降低的 SREBPs及其靶基因将有助于降低肝脏的成脂过程、减轻肝脂沉积和改善脂诱性肝胰岛素抵抗。这从基因表达水平上解释了黄连素对肝脏脂代谢的调节效应。然而,结果亦显示,与对照相比,在黄连素治疗地鼠肝脏中 SREBPs及其靶基因的表达仍然处于升高状态,但即使如此,表达增加的成脂基因似乎并没有加重脂诱性肝胰岛素抵抗和影响黄连素对脂诱性肝胰岛素抵抗的治疗效应。因此,表达增加的肝脏 SREBPs转录调控系统是否是进一步降低血脂所必需的仍需进一步研究。另外,表达增加的肝脏 SREBPs转录调控系统是暂时的还是较持久的尚不清楚。因此,黄连素诱导的肝 SREBPs转录调控系统表达的改变有助于改善脂诱性肝胰岛素抵抗,进而防止肥胖相关糖尿病的进展。
SREBPs转录调控系统参与 2型糖尿病脂诱性肝胰岛素抵抗的形成及黄连素治疗 2型糖尿病脂诱性肝胰岛素抵抗的效应。
[1]McGarry JD.Dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J].Diabetes,2002,51(1):7-18.
[2]Unger RH,Orci L.Lipotoxic diseases of nonadipose tissues in obesity[J].Int J Obes Relat Metab Disord,2000,24(Suppl 4):S28-32.
[3]Wu Q,Ortegon AM,Tsang B,et al.FATP1 is an insulinsensitive fatty acid transporter involved in diet-induced obesity[J].Mol Cell Biol,2006,26(9):3455-3467.
[4]Danda RS,Habiba NM,Rincon-Choles H,et al.Kidney involvement in a nongenetic ratmodel of type 2 diabetes[J].Kidney Int,2005,68(6):256-257.
[5]Luo J,Quan J,Tsai J,et al.Nongenetic mouse models of noninsulin-dependent diabetes mellitus[J].Metabolism,1998,47(6):663-668.
[6]Mu J,Woods J,Zhou YP,et al.Chronic inhibition of dipep tidyl pep tidase-4 with a sitagliptin analog p reserves pancreatic beta-cellmass and function in a rodentmodel of type 2 diabetes[J].Diabetes,2006,55(6):1695-1704.
[7]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[8]陈其明,谢明智.小檗碱对正常小鼠血糖调节的影响[J].药学学报,1987,22(4):161-165.
[9]欧阳礼枝,陆付耳,刘文军,等.小檗碱对胰岛素抵抗大鼠肝脏葡萄糖激酶及其调节蛋白的影响[J].世界华人消化杂志,2007,15(3):885-889.
[10]Brown MS,Goldstein JL.The SREBP pathway:regu lation of cholesterolmetabolism by proteolysis of a membranebound transcription factor[J].Cell,1997(89):331-340.
[11]Adams CM,Goldstein JL,Brown MS.Brown cholesterolinduced conformational change in SCAP Insig proteins and m imicked by cationic amphiphiles[J].Proc Natl Acad Sci USA,2003,100(19):10647-10652.
[12]Yang T,Espenshade PJ,W right ME.Crucial step in cholesterol homeostasis:sterols p romote binding of SCAP to INSIG-1,amembrane protein that facilitates retention of SREBPs in ER[J].Cell,2002,110(4):489-500.
[13]Yabe D,Brown MS,Goldstein JL.Insig-2,a second endoplasmic reticu lum protein that binds SCAP and b locks export of sterol regulatory element-binding p roteins[J].Proc Natl Acad Sci USA,2002,99(20):12753-12758.
[14]Finck BN,Kelly DP.PGC-1 coactivators:inducible regulators of energy metabolism in health and disease[J].J Clin Invest,2006,116(3):615-622.
[15]Hasty AH,Shimano H,Yahagi N,et al.Sterol regu latory element-binding protein-1 is regulated by glucose at the transcriptional level[J].J Biol Chem,2000,275(40):31069-31077.
[16]Yahagi N,Shimano H,Hasty AH,et al.Absence of sterol regulatory element-binding protein-1(SREBP-1)ameliorates fatty livers but not obesity or insulin resistance in Lep(ob)/Lep(ob)mice[J].JBiol Chem,2002,277(22):19353-19357.
[17]Ide T,Shimano H,Yahagi N,et al.SREBPs suppress IRS-2-mediated insulin signalling in the liver[J].Nat Cell Biol,2004,6(4):351-357.
[18]Miserez AR,Muller PY,Barella L,et al.Sterol-regu latory element-binding protein(SREBP)-2 contributes to polygenic hypercholesterolaem ia[J].Atherosclerosis,2002,164(1):15-26.
[19]Liang G,Yang J,Horton JD,et al.Dim inished hepatic response to fasting/refeeding and liver X receptor agonists in m ice with selective deficiency of sterol regulatory ele ment-binding protein-1c[J].JBiol Chem,2002,277(11):9520-9528.
Effectsof berberine on expression of hepatic sterol regulatory element-binding protein,its control and target genes in type 2 diabetic Chinese ham sters
LIU Xu-han1,LIGuo-sheng2,HUANG Lan3,ZHU Hua3,LIU Ya-li3,MA Chun-mei3
(1.Departmentof Endocrine,Dalian Municipal Central Hospital,Dalian 116003,China;2.Department of Pathology,the First Affiliated Hospitalof Dalian Medical University,Dalian 116011,China;3.Department of Pathology,Institute of Laboratory Anima l Science,Chinese Academy of Medical Sciences(CAMS)and Peking Union Medical College(PUMC),Beijing 100021,China)
[Objective]To study the effects of berberine on the exp ression of hepatic sterol regulatory element-binding p rotein(SREBPs)and their control and target genes in type 2 diabetic Chinesehamsters and explore the therapeutic molecu larmechanisms of berberineon fat-induced hepatic insulin resistance.[Methods]The insulin-resistantand type 2 diabetic Chinese hamster models were induced by high-fat diet without or with low-dose strep tozotocin.Then,the hamsters were randomly divided into 4groups:normal control,insu lin-resistant,diabetic and berberine-treated diabetic groups.After nine-week treatment,the expression of hepatic SREBPs and their control and target genes from different groups were measured by RT-PCR.[Results]It was indicated that the expression of SREBPs,SCAP,S1P,S2P and SREBPs target genes was increased and the expression of Insigs was decreased in the fatty liver ofhamstermodel.Berberine effectively improved insulin resistance and reversed the altered expression ofhepatic SREBPs and its controland targetgenes in diabetic hamsters.[Conclusion]SREBPs gene transcriptional programs are involved in the therapeutic molecu lar mechanisms of berberine on fat-induced hepatic insu lin resistance in type 2 diabetic hamsters.
berberine;type 2 diabetes;sterol regulatory element-binding p rotein;insu lin resistance;Chinese hamster;liver
R 583.1
A
1671-7295(2011)01-0023-08
2010-11-16;
2010-12-18
刘栩晗(1975-),女,辽宁锦州人,主治医师,医学博士。E-mail:xuhanliu281277@yahoo.com.cn
李国生,主治医师。E-mail:guoshengli998@163.com
