不同类型黄酒中杂醇油含量分析及其机制初探
2011-01-12夏小乐朱小明张斌夏梅芳杨海麟赵慧沈蒙蒙王武
夏小乐,朱小明,张斌,夏梅芳,杨海麟,赵慧,沈蒙蒙,王武
1(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)2(南通如皋白蒲水明楼黄酒有限公司,江苏如皋,226500)
黄酒是中国独有的酒种,按照含糖量多少和发酵工艺,可分为干型、半干型、半甜型、甜型[1]。它具有低酒精度、营养丰富等特点。
黄酒的传统酿造是采用多菌种,边糖化、边发酵的三边工艺,除产生乙醇、功能寡肽和大量各类香气物质外,还会产生一些不利人体健康的物质,典型的如过量的杂醇油、甲醇、醛类和游离的嘌呤类物质等,这些有害物质在一定程度上影响了黄酒的饮用和发展。黄酒饮用后相较其他酒而言普遍反映有易上头、易醉和严重的“后反功”,而造成黄酒上头的主要物质是过量的杂醇油。杂醇油是一类高沸点的混合物,是淡黄色至棕褐色的透明液体,是3个碳以上的一元醇类物质的总称,其主要成分是正丙醇、正丁醇、异丁醇、仲丁醇、戊醇、异戊醇、活性戊醇、辛醇、苯乙醇、色醇、酪醇等高级醇[2-3];它们在黄酒中普遍存在,其在黄酒中正常的生成和合理存在无疑对酒质呈香呈味有积极作用,但是过量就会影响酒质和对人体产生危害[7]。杂醇油生成机制被认为主要通过Ehlrich途径和糖合成途径形成中间产物α-酮基酸,继而产生杂醇油[5]。国内外对杂醇油有较多报道,己经证实饮酒上头与杂醇油含量直接相关,一些酒类标准也对杂醇油含量进行了限制[6]。
殷德荣等采用气相色谱法测定绍兴黄酒中正丙醇含量为 128.1 mg/L,异丁醇 118.7 mg/L,异戊醇284.5 mg/L[7]; 郭 翔 等[8]利 用 固 相 微 萃 取 技 术(SPME)结合GC-MS测定半干型黄酒中醇和酯,其中丙醇为3.3 ~16.3mg/L,异丁醇45.1 ~150.6 mg/L,异戊醇 162.3 ~295.5 mg/L;夏小乐等[9]等利用外标气相色谱法测定了清爽型黄酒中的乙醛和杂醇油含量,乙醛含量达到40.5 mg/L,杂醇油达到38.3 mg/100mL。上述研究均未涉及黄酒类型和工艺间的差异,未能全面深入的对杂醇油的含量和生成因素进行分析。黄酒经过多年的发展,已存在多种类型、传统工艺与现代工艺并存的格局,因此发酵周期和酵母生长繁殖存在较大差异,黄酒中的杂醇油含量和生成机制也各不相同[10]。
本研究建立了一种顶空进样毛细管气相色谱法测定黄酒中杂醇油的含量的方法,通过比较不同类型黄酒中杂醇油含量的差异,探讨杂醇油生成机制和影响因素,对在生产中控制杂醇油的含量提供建议和思路。
1 材料和方法
1. 1 仪器与试剂
岛津 GC2010气相色谱仪,FID检测器,DANI HSS86.50顶空进样器;毛细管色谱柱:PEG-20(25 m ×0.53 mm ×1 μm),正丙醇、异丁醇、异戊醇均为色谱纯(迪马科技,China),其余试剂均为市售分析纯。黄酒样品均为超市购买,详见表1。
1. 2 标准溶液配制
用6%的乙醇溶液分别配成浓度为2.0 g/L的正丙醇、异丁醇和异戊醇标准储备溶液,储存与4℃冰箱待稀释用。准确移取上述标准储备溶液至50 mL容量瓶中,用6%乙醇溶液定容,配制成正丙醇、异丁醇、异戊醇标准溶液浓度均为20.0 mg/L的标准溶液,置冰箱中保存备用。
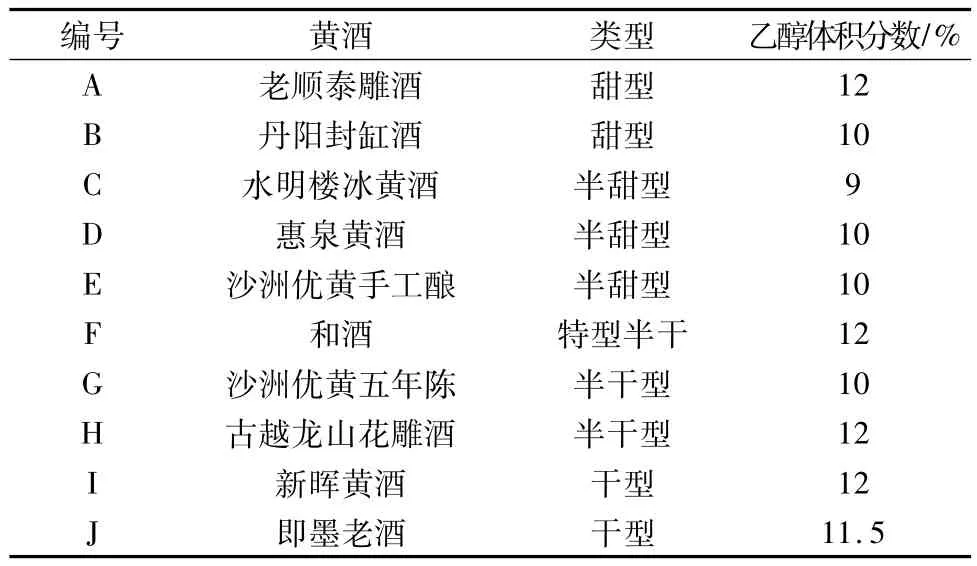
表1 黄酒样品列表
1. 3 气相色谱分析
1.3.1 气相色谱测定条件
柱温:起始40℃,保持5 min,再以10℃/min升温至180℃,保持5 min。进样口温度:200℃;检测器温度:250℃;载气为氮气,流速1.5 mL/min(恒流);氢气:30 mL/min;空气300 mL/min;尾吹气28.0 mL/min;顶空:70 ℃保持30 min,分流比1∶1,顶空进样。
1.3.2 回归方程和线性范围
移取标准品50mL于容量瓶中,用6%乙醇溶液定容,配制成标准储备液系列浓度为:20.0、50.0、100.0、200.0、400.0、500.0、1000.0mg/L。在上述色谱条件下依次测定,绘制标准曲线并得到回归方程。
1.3.3 精密度和回收率
取一黄酒样品于50 mL容量瓶中稀释定容,在稳定的条件下按上述色谱条件测定其含量,平行实验5次,计算平均值及相对标准偏差(RSD)。在黄酒样品中加入一定量的标准品,然后进行加标回收率实验,平行实验5次。
1.3.4 黄酒样品测定
将各黄酒样品均稀释到乙醇体积分数为6%,50mL容量瓶定容。将标准样品和各酒样通过0.45m滤膜过滤,然后分别取4 mL进行顶空进样分析,重复3次。
2 结果与讨论
2. 1 利用保留时间定性分析
通过外标法测定黄酒中杂醇油的含量,结果见图1。各组分按出峰先后顺序依次为乙酸乙酯、乙醇、正丙醇、异丁醇、异戊醇。在上述色谱分离条件下,按照国家相关标准,测定的杂醇油指标为正丙醇、异丁醇、异戊醇 3种,其保留时间分别为 7.563 min,8.779 min和11.111 min,各峰分离效果很好。图2为黄酒样品中各组分气相色谱图,对照标准色谱图可知所要分析的3种高级醇均得到很好的分离。

图1 混合标样色谱图

图2 黄酒样品色谱图
2. 2 定量分析
2.2.1 回归方程、线性范围
在上述色谱条件下进行测定,得到标准曲线的回归方程如表2所示,其中标准曲线中y为峰面积比(AP/AI),x为浓度比(CP/CI)。由表2中数据可以看出回归方程相关系数均在0.995以上,相关性较好。

表1 杂醇油各组分的回归方程、线性范围
2.2.2 精密度和回收率
取一黄酒样品50mL容量瓶稀释定容,在稳定的条件下按上述色谱条件测定其含量,平行实验5次,计算平均值及相对标准偏差(RSD)。如表2所示,RSD 在1.09% ~1.72%,结果良好。
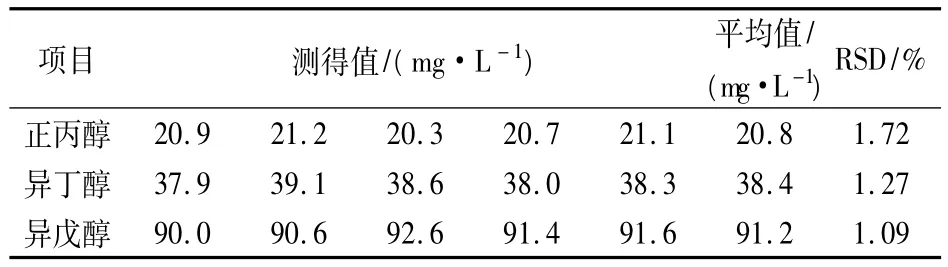
表2 分析方法的精密度检验(n=5)
在黄酒样品中加入一定量的标准品,然后进行加标回收率实验,平行实验5次,结果如表3所示,本方法加标回收率均大于96%。综合上述实验,证明所建立的方法准确可靠。

表3 黄酒样品加标回收率
2. 3 酒样测定
按上述方法,对市场上的10种黄酒中的杂醇油含量进行测定。如表4所示,检测的10个黄酒样品中,均呈现异戊醇>异丁醇>正丙醇,杂醇油的总含量差异明显。以12%的体积分数计算,编号为J的杂醇油含量最低,为152.8mg/L,编号为A的杂醇油含量最高,为528.4mg/L,是黄酒J的3.45倍。如表4所示,杂醇油含量按黄酒类型,基本呈现出干型<半干型≈半甜型<甜型的现象,这说明黄酒工艺对于其杂醇油含量存在较大的影响。

表4 黄酒样品杂醇油检测结果
一般认为,干型黄酒发酵醪液较稀,发酵温度较低,开耙时间较短,酵母发酵繁殖较好,因此杂醇油含量较低。同时认为其酵母生长充分,残糖较低,因此杂醇油可能主要通过糖合成途径生成。甜型黄酒则刚好相反,发酵中以酒代水,抑制了酵母菌的生长,发酵不充分,因此易于生成杂醇油;酒醪中的残糖量较高,酵母代谢不旺盛,因此杂醇油较难通过糖合成途径,应当主要通过Ehlrich途径生成[11]。考虑到目前甜型和半甜型仍占据相当大的市场份额,那么抑制Ehlrich途径是今后工作的方向和重点。

表5 各种酒的杂醇油含量
普遍反映,黄酒饮后舒适度较差,那么是否是杂醇油含量造成的呢?如表5所示,与其他酒相比较,除了清酒之外,其它酒中也呈现异戊醇>异丁醇>正丙醇的现象。以单次饮用100 mL酒精量的酒计算,摄入的杂醇油含量黄酒最高,为292.3 g,是白酒的6.3倍,德国啤酒的3.9倍。虽然也有报道,饮后所带来的不适感,不仅与杂醇油相关,也与酒中酯、醇的含量、组成密切相关。但是不可忽视的是,杂醇油仍是其中最重要的影响因素之一。
为何黄酒会产生如此高含量的杂醇油,经分析主要是工艺上的差异造成的。黄酒是边糖化边发酵,发酵醪的浓度较高,酵母生长不旺盛,促进了杂醇油的产生。相比较而言,以啤酒为例,啤酒酿造是纯种发酵,酵母量充足,繁殖世代少,同时糖分消耗迅速,对氨基酸作用不充分,这在一定程度上均降低了杂醇油的产生。黄酒的主发酵温度相对于啤酒更高也促进了杂醇油的生成。因此改善黄酒等是降低杂醇油含量的一个重要措施,也已有一些工作报道出现[17],也可以借鉴其它酒种的发酵工艺等或通过改造酵母菌种等措施来降低杂醇油含量。
3 结论
实验结果表明,顶空进样毛细管气相色谱法对黄酒中杂醇油的检测,免除了繁杂的样品前处理过程,具有进样准确、重复性好、使用方便等优点。本实验中对不同来源、类型的10个酒样中的杂醇油进行了测定,结果表明:黄酒中杂醇油含量在200~500 mg/L之间。所有酒样的杂醇油分布均表现为异戊醇>异丁醇>正丙醇,杂醇油含量在黄酒中的分布呈现出干型<半干型≈半甜型<甜型的现象。
本研究结果比较了不同来源、类型的黄酒的杂醇油的含量,初步分析了生产工艺对于杂醇油含量的影响,尤其是甜型和半甜型中以酒代水的工艺应当加以改善,但是深入具体的研究仍有待进行。同时本研究结果,初步揭示了黄酒中杂醇油含量对于其品质的影响,因此是否将杂醇油这一指标引入黄酒标准以适应日益提高的食品安全需求也是当前亟需考虑的问题。
[1] Calderbank J,Hammond J R M.Influence of higher alcohol availability on ester formation by yeast[J].J Am Soc Brew Chem,1994,52(2),84-90.
[2] Cisbani B,Muecio A and Travia L.Contents of higher aleohols in wine distillates and grape residue distillates[J].Rivista della Societa Italianadi Scienza,1977(3):187-189.
[3] Dickinson,J R,Harrison J,and Hewlins M J.An investigation of the metabolism of valine to isobutyl alcohol in Saccharomyces cerevisiae[J].J Biol Chem,1998,273:25751-25756.
[4] 毛青钟,石彩琴.黄酒中主要上头物质及控制技术的研究[J].酿造与发酵,2010,(3):27-32.
[5] Lucie A H,Jean-Marc D,Antonius J A van Maris,et al.The Ehrlich Pathway for Fusel Alcohol Production:a Century of Research on Saccharomyces cerevisiae Metabolism[J].Applied and Environmental Microbiology,2008,74(8):2 259-22 66.
[6] 毛青钟.浅谈机械化黄酒中高级醇含量的控制[J].酿酒,2000,1:51 -53.
[7] 殷德荣.毛细管气相色谱法测定绍兴黄酒中挥发性物质[J].中国卫生检验杂志,2006,16(8):930-931.
[8] 郭翔,胡普信,徐岩,等.黄酒挥发性风味物质的研究[J].酿酒科技,2004(5):79 -81.
[9] 夏小乐,夏梅芳,杨海麟,等.气相色谱法测定清爽型黄酒中的乙醛和杂醇油含量[J].酿酒,2010,37(6):72-74.
[10] 陈佩仁,叶春勇,王友崇,等.无蒸煮麦曲黄酒产品的质量控制[J].酿酒科技,2007(12):65-67.
[11] 刘永乐,俞健,黄寿恩,等.甜型黄酒发酵过程中的生物和化学成分性质研究[J].中国食品学报,2004,4(1):60-64.
[12] Dan Y Y,Yukio K,Ronald E S.Higher alcohols,diacetyl,acetoin and 2,3 - butanediol biosynthesis in grapes undergoing carbonic maceration[J].Food Research International,2006,39:112 -116.
[13] 王晓茹,王颉.苹果酒酿造工艺及高级醇的气相色谱分析[J].中国食品学报,2006(6):351-356.
[14] 李春红,云霞,杨红.气相色谱内外标法分析啤酒中高级醇含量的比较[J].中国酿造,2007(4):61-65.
[15] 傅金泉.日本清酒芳香成分研究概述[J].酿酒科技,2000(2):83-85.
[16] 王立钊,梁慧珍,马树奎,等.影响固态发酵白酒中杂醇油生成因素的研究[J].酿酒科技,2006(5):43-48.
[20] 张秋汀,魏桃英.改良型黄酒工艺初探[J].酿酒科技,2007(1):71-72.
