新疆豆制品生产环境中肉毒梭菌的分离鉴定*
2011-01-12刘凯卢士玲李开雄
刘凯,卢士玲,李开雄
(石河子大学食品学院,新疆石河子,832000)
肉毒梭菌(Clostridium botulinum)属于厌氧性梭状芽孢杆菌属,是具有厌氧性的杆状菌,能形成芽孢,芽孢比繁殖体宽,呈梭状,革兰氏染色为阳性[1]。肉毒梭菌被证实能在厌氧环境中生长,即使侵入胃肠道内也不发芽增殖,而是随粪便排出[2]。当在营养丰富,高度厌氧的条件下芽孢即转变为菌体且可产生强烈外毒素-肉毒毒素(Botulinum neurotoxin)[3]。肉毒毒素是1种特殊的蛋白质,性质稳定,毒力比氰化钾毒力高1万多倍,小鼠LD50为1.0ng/kg,对人的致死量为1.0pg/kg,是现今已知化学毒物和细菌毒素中毒性最强的一种[4]。自“911”恐怖袭击事件后,美英等西方国家便把其列为最有可能被使用的生物恐怖剂之一[5]。
据不完全统计,1949~2001年,我国已有20个省、区先后发生肉毒中毒908起,其中新疆718起,占中毒次数的79.07%,全国中毒人数3 903人,其中新疆2 259人,占57.88%[6]。新疆为肉毒毒素中毒高发区,豆制品中肉毒毒素中毒屡见报端,在一定程度上制约了新疆豆制品产业的发展。本实验从豆制品加工厂附近土壤中分离出一株肉毒梭菌,应用病原形态学鉴定、细菌生理生化分析、凝胶电泳成像及16SrDNA测序分析相结合的方法对分离出的肉毒梭菌进行鉴定。为今后豆制品中肉毒梭菌的检测,及控制技术研究奠定了基础。
1 材料和方法
1.1 样品与仪器
采集豆制品生产环境附近的土壤样品,其中菜市场20份,豆制品加工厂附近15份,污水沟旁草地15份,食品厂污水淤泥:10份,共计60份。以上样品均采自伊宁市察布查尔县。
细菌DNA试剂盒购自北京诺维森生物科技有限公司,PCR扩增所需引物为3种:通用引物,上游引物为 U968:5’-AACGCG AAG AACCTT AC-3’,下游引物为 L1401:5’-GCGTGTGTACAA GACCC-3’;A上:5'GTGATACAACCAGATGGTAGTTATAG3',A 下:5'AAAAAACAAGTCCCAATTATTAACTTT3';B 上:5'GAGATGTTTGTGAATATTATGATCCAG3',B 下:5'GTTCATGCATTAATA TCAAGGCTGG3'。由上海生工生物工程有限公司合成。表1和表2为其反应体系和反应参数。
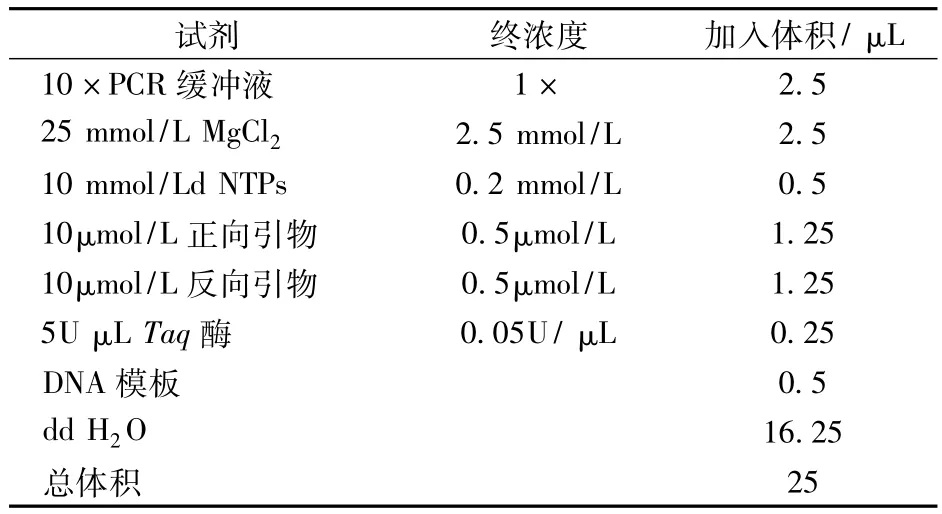
表1 PCR反应体系

表2 PCR反应参数
1.0 %葡萄糖庖肉培养基:
蛋白胨12 g,牛肉浸液400 mL,酵母浸膏2 g,葡萄糖1.2 g,NaHPO42 g,碎肉渣适量,调节pH为7.4~7.6。
制法:牛肉浸液制法:取新鲜(除脂肪和筋膜)牛肉200 g,加蒸馏水400 mL和1 mol/L NaOH 10 mL,搅拌煮沸15 min,充分冷却,除去表层脂肪,澄清过滤,加水补足至400 mL。将牛肉碎块装于试管,每管约15 mm高。然后加入pH 7.4~7.6的牛肉浸液及其他成分,再于121℃灭菌20 min备用。
卵黄琼脂(EYA)培养基:
胰蛋白胨12 g,蛋白胨8 g,NaCl 2 g,琼脂粉8 g,牛肉浸膏20 g,蒸馏水400 mL,50%蛋黄盐水40 mL。
制法:取新鲜鸡蛋,经75%乙醇浸泡1h后,再于无菌操作下取出卵黄放入量筒,再加入等量无菌生理盐水混匀即得蛋黄盐水,除蛋黄盐水外其余成分混合,加热溶解调节至pH值7.3~7.4,121℃灭菌20 min,冷至60℃加入50%的蛋黄盐水,混匀倾注平板。
发酵培养基:
0.04 %溴甲酚紫水溶液5 mL,蛋白胨4 g,乳糖(葡萄糖或蔗糖或麦芽糖)2 g,蒸馏水200 mL。
制法:将蛋白胨和乳糖(葡萄糖或蔗糖或麦芽糖)溶于水中,校正pH,加入指示剂,115℃高压灭菌15 min。
石蕊牛奶培养基:
10% ~15%脱脂奶粉溶液100 mL,石蕊乙醇液2.5 mL
石蕊乙醇液的制法:8g石蕊在34 mL 40%乙醇中研磨,取上清液,重复操作2次。加40%乙醇到总量为100 mL,并煮沸1 min,取用上清液。上述成分混匀分装试管,每管5~10 mL 115℃灭菌20 min。
明胶培养基:
牛肉浸膏0.6g,蒸馏水200 mL,蛋白胨1 g,明胶24 g。
制法:各成分加入蒸馏水中,浸泡约20 min,随时搅拌,加热溶解,调节至pH 7.5,分装小试管,115℃灭菌20 min。
EL3002电子天平,梅特勒-托利多仪器(上海)有限公司;SW-CJ-超净台,苏州安泰空气技术有限公司;SPX-250B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;GMSX-280型压力蒸汽消毒器,北京市永光明医疗仪器厂;GRX20型干热消毒箱,上海精宏实验设备有限公司;电子万用炉,北京市永光明医疗仪器厂;MCL-3型微波炉,微波化学实验仪器厂;DMI4000B置荧光显微镜,Leica公司;BIO-RAD凝胶成像仪,美国BIO-RAD公司;BIO-RAD电泳仪,美国BIO-RAD公司;高速冷冻离心机,德国eppendorf公司。
1.2 实验方法
1.2.1 样品预处理
1.2.1.1 热处理法
样品预处理采用乙醇处理法[7]。以50%乙醇与样品混合作用1h,然后稀释、均质备用。
1.2.2 富集培养
预处理过的样品液吸取0.2 mL,加入到装有20 mL庖肉培养基的试管中,30℃培养5 d,观察细菌生长状况。庖肉培养基用液体石蜡封液面,在使用前于沸水中煮沸15 min后急速冷却,再接种待检物,厌氧培养。
1.2.3 分离培养
于卵黄琼脂培养基(EYA)上进行划线分离,用焦性没食子酸除氧法35℃厌氧培养48h[8],同时设有氧环境对照。挑选菌落形态与C.botulinum相似的菌落革兰氏染色观察,多次分离,直至得到形态单一的菌落并将类似菌落进行菌株保存。
1.2.4 目标菌的形态观察及生理生化测定
仔细观察细菌在庖肉培养基和EYA培养基上的生长情况和菌落形态,同时通过革兰氏染色观察细菌形态。将在EYA培养基上培养了48 h的细菌接种到不同的生理生化鉴定培养基中,30℃恒温培养48h。参照《伯杰细菌鉴定手册》[9]鉴定反应结果。
1.2.5 目的基因的PCR及16SrDNA V6-V8片段的序列测定
取对数期生长期的新鲜菌液,依细菌DNA试剂盒的操作说明提取基因组DNA。PCR反应体系及参数如表1和表2所示。通用引物扩增目标片段为430bp左右,A型肉毒毒素基因扩增目标片段为980bp左右,B型肉毒毒素基因扩增目标片段为490 bp左右。用BioRad凝胶成像系统照相,通用引物所扩增PCR产物送北京六合华大基因公司测序。
1.2.6 系统发育进化分析
将所测得的16SrRNA基因序列提交到GenBank数据库中,用BLAST进行相关序列的搜索,与Gen-Bank中现有的近缘菌株的序列比较,并从数据库获得相关属、相关种的16SrRNA序列,建立系统发育树[10]。序列用CLUSTAL X program软件对齐,进化距离的计算应用邻接法neighbor-joining method,采用p-distances法和Kimura-2parameter双参数法进行,进化树分支模式的稳定性用MEGA v.3.1软件分析,采用bootstrap法,重复次数为1 000,构建进化树。
2 结果与分析
2.1 目标菌的富集培养和分离纯化结果
2.1.1 目标菌的富集培养结果
60份样品进行富集培养的结果见表3。

表3 富集培养结果
在初步鉴定出的7份50%乙醇处理液的样品庖肉培养管中,牛肉渣部分表面变黑,肉块呈暗红色,培养液黏稠浑浊,产生气泡且伴有恶臭。
其余的样品中有38份培养液黏稠浑浊,但有白色絮状物沉积在管底,肉渣无明显变色。另有15份无明显现象。
培养结果表明,其中7种样品的培养特征与肉毒梭菌的培养特征相似,因此将这7种样品的庖肉培养液接种到分离培养基上进行初步分离。
2.1.2 分离培养结果
将富集培养的7种样品培养液稀释涂布到EYA平板上,分做2份,30℃的恒温培养箱中分别进行有氧和厌氧的培养,培养48 h,观察生长情况及菌落形状,如表4所示。
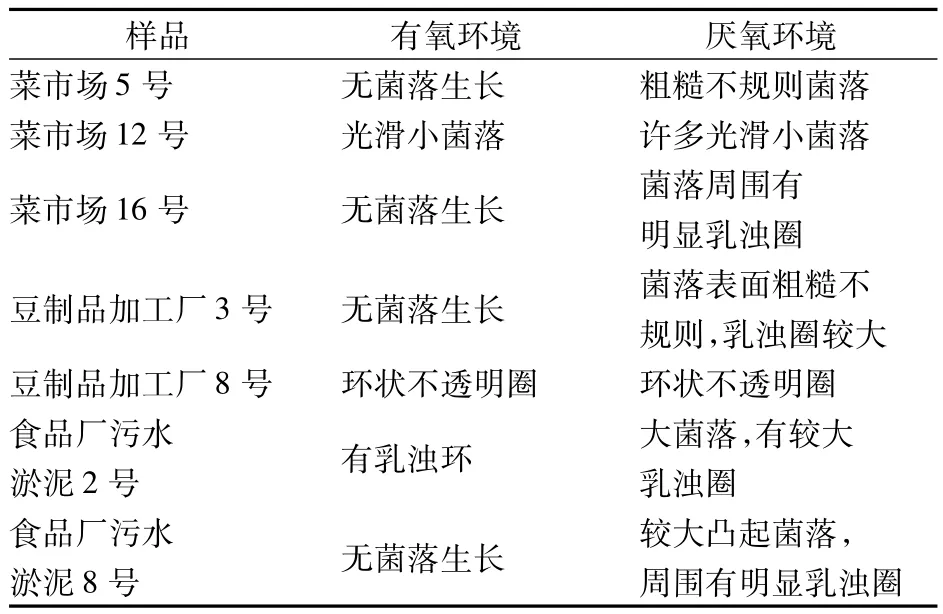
表4 七种样品EYA平板上的菌落形态
由表4可知,菜市场16号、豆制品加工厂3号、食品厂污水淤泥8号的培养液在EYA平板上生长出的菌落形态与所要筛选的肉毒梭菌的菌落形态相似。
将这3种样品,在EYA平板上反复划线分离,直至镜检观察中未发现杂菌,同时挑取新鲜培养物进行革兰氏染色,显微镜下观察其菌体形态。根据菌体形态观察初步断定食品加工厂3号样品为肉毒梭菌,此待检菌暂命名为JGC-3。
挑取JGC-3菌在EYA平板上的菌落,如图1所示,做革兰氏染色。镜检结果见图2,待检菌JGC-3为粗大杆菌,两侧平行,两端钝园,直杆状或稍弯曲,芽孢为卵圆形,位于次极端,呈网球拍形,革兰氏染色阳性,呈现肉毒梭菌的个体形态特征。

图1 EYA平板上JGC-3菌的菌落形态

图2 JGC-3菌革兰氏染色油镜镜检结果
2.2 生理生化特性
JGC-3菌的生理生化特性与A型肉毒梭菌一致,即可分解葡萄糖、麦芽糖、果糖、蔗糖,不发酵半乳糖、甘露醇、甘露糖。石蕊牛乳培养基变蓝色,说明该菌株分解酪蛋白,产生碱性物质,使石蕊变蓝色,在培养后期,产生大量气体。明胶液化试验中,明胶最后呈液体状态,属阳性反应,说明JGC-3菌含胶原酶(蛋白分解酶),将明胶分解为氨基酸,使明胶低于20℃时不再凝固,呈液化状态。
2.3 凝胶电泳与系统进化分析
2.3.1 肉毒毒素基因和16SrDNA V6-V8片段的扩增
由分离菌株JGC-3的电泳图谱(图3)可以看到,采用A型肉毒毒素基因引物所扩增出的条带在目标条带附近,所得到的扩增片段长度与实际相符。采用B型肉毒毒素基因引物为阴性,同时空白样反应也为阴性。
2.3.2 16SrDNA V6-V8的序列系统发育进化分析
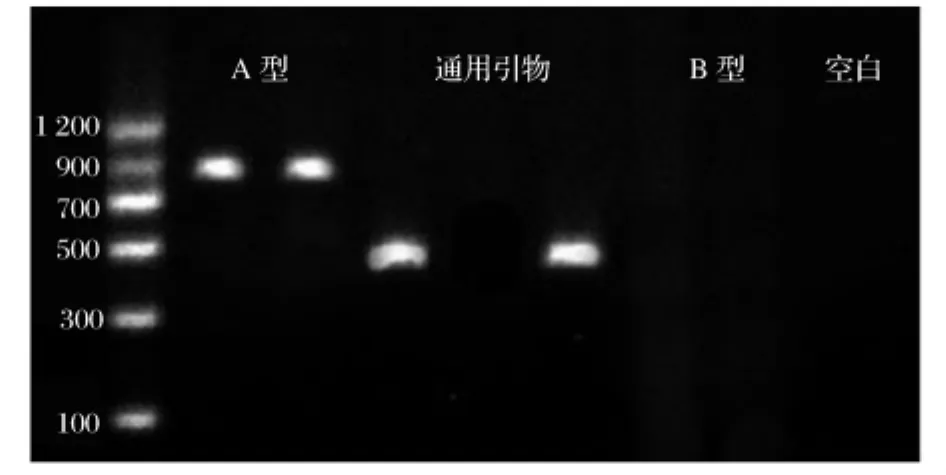
图3 分离菌株JGC-3的肉毒毒素基因和16S rDNA V6-V8片段的PCR产物的电泳图谱
将获得的序列在GenBank数据库中进行Blast分析,结果表明菌株 JGC-3的16SrDNA V6-V8序列(GenBank登录号:JN248616)与GenBank基因库中同源性最为接近的菌株均为梭状芽孢杆菌属(Clostridium),表明该菌属于所均属的细菌。下载同源性较高的细菌序列,用CLUSTAL X program软件进行多序列比对分析并构建系统发育树,结果表明:JGC-3与GenBank报道的其他A型肉毒梭菌株形成一个簇群,与GenBank中登录号为X73844.1的A型肉毒梭菌的亲缘关系最近,结合该菌的形态学和生理生化特性,将其鉴定为A型肉毒梭菌,序列比对的同源性分析和进化树构建如图4所示。

图4 JGC-3及相关梭菌属菌株的系统进化树
3 结论
本实验从新疆察布查尔锡伯族自治县的土壤中分离出一株细菌,经形态学和生理生化特征分析,结合16SrDNA序列分析对其进行研究,主要结论如下:
(1)在生理生化鉴定中,目标菌可分解葡萄糖、麦芽糖、果糖、蔗糖,不发酵半乳糖、甘露醇、甘露糖。石蕊牛乳培养基变蓝色,在培养后期,产生大量气体。明胶液化试验中,明胶最后呈液体状态,反应呈阳性。
(2)采用通用引物和特异性引物对目标菌的DNA进行PCR扩增,经琼脂糖凝胶电泳检测有清晰条带。所得PCR产物测序结果进行BLAST分析后,其与GenBank中A型肉毒梭菌序列相似度高达97%,将其确定为A型肉毒梭菌。
[1] 温玉梅.现代医学微生物学[M].上海:上海医科大学出版社,1999:243-247.
[2] 刘长文,梁艳华,祁兴州.肉毒中毒的发生及特点[J].承德医学院学报,1995(12):59-61.
[3] Gao Q Y,Huang Y F,Wu J G,et al.A review of botulism in china[J].Biomed En-viro Sci,1990(3):326 - 336.
[4] Jankovic J,Brin MF.Therapeutic uses of botulinum toxin[J].N Engl J Med,1991,324:1 186 -1 194.
[5] Whitby M,Street AC,Ruff TA,et al.Biological agents as weapons:Smallpox and botulism [J].Med J Aust,2002,176(9):431-433.
[6] 夏宏器,刘国全.肉毒中毒[M].新疆:新疆人民出版社,1982:18-22.
[7] 江扬.肉毒梭菌的筛选及菌株的鉴定[D].南京:南京工业大学,2003.
[8] 袁桂秀,林晨,江振友,等.改良焦性没食子酸法培养厌氧菌[J].暨南大学学报:自然科学与医学版,1999,4:24-25.
[9] 布坎南 R E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:768-773.
[10] Ghalfi H,Allaoui A,Destain J,et al.Bacteriocin activity by Lactobacillus curvatus CWBI-B28 to inactivate Listeria monocytogenes in cold - smoked salmon during 4°C storage[J].J food pro,2006,69:1 066 -1 071.
