多糖添加对固体基质培养发菜细胞生物量的影响
2011-01-12陈雪峰尹文翠
陈雪峰,尹文翠
(陕西科技大学生命科学与工程学院,陕西西安,710021)
发菜(Nostoc flagelliforme)是发状念珠藻的简称,隶属蓝藻门,主要生长在干旱、半干旱地区的荒漠地带,是一种经济价值很高的食用性蓝藻[1]。发菜具有光合作用和固氮作用,是荒漠土壤中有机碳和氮的重要来源,对维持荒漠草原生态系统具有重要意义。发菜生长缓慢,自然资源非常有限,目前虽有关于发菜固体培养的研究报道[2],但是发菜的大面积人工种植尚未成功实现。
本课题研究了一种较为简便的加速固体培养发菜细胞生长的方法。选取粗沙、细沙和PA6三种不同的固体基质材料,通过添加不同浓度的胞外多糖调节发菜细胞与固体材料的润湿性,来提高发状念珠蓝细菌在固体基质上的的生长速率,以期为发状念珠蓝细菌的大规模栽培奠定一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 发菜单体细胞
发菜采集于宁夏银川贺兰山东麓。将发菜原植体经光合活性恢复,匀浆法分离单体细胞,纯化后,收集细胞,重新悬浮于新鲜BG11培养基中,备用。
1.1.2 固体培养基质
选取河沙(粗沙、细沙)和PA6不同润湿性的固体培养基[3],用水洗涤干净,烘干,添加量以平铺至Ф90mm培养皿5mm高度为宜,即粗沙和细沙每培养皿用量60 g,PA6每培养皿30 g。
1.1.3 添加多糖
选用食用级的阿拉伯胶;食用级果胶;食用级海藻酸钠。
1.2 方法
1.2.1 原料分级及粒度测量
河沙采用不同目数的泰勒标准筛进行筛分,粒度小于32目的河沙收集后命名为细沙,粒度在5~14目的河沙收集后命名为粗沙。分别对细沙、粗沙和PA6固体基质材料清洗直至清洗水透彻明亮,80℃烘干。
显微镜法是测定粒度分布最直观的方法[4-5],随机选取少量3种材料,PA6材料为圆柱形,粒度用长×宽表示,细沙和粗沙均属于不规则形状,粒度也用长×宽表示。
1.2.2 发菜细胞的固体培养
固体基质材料选用粗沙、细沙和PA6,培养液为BG110,收集发菜细胞,洗涤、离心后,用BG110稀释,细胞浓度为A410=0.4左右。取5 mL稀释液滴加于所有培养皿内,并补加15 mL含有0.1%,0.3%,0.6%,1.0%的多糖培养液BG110,同等方法补加BG110培养液至15 mL作为空白对照,加盖置于光照培养箱内培养。光照强度90 μ/molm2s1,光暗比12∶12(白天从8∶00 -20∶00,夜晚20∶00 - 次日8∶00),白天温度25℃,夜晚10℃,每2~3天补少量水,使固体基质材料表面保持湿润,每10天取样测定生物量。
1.2.3 生物量的测定
采用叶绿素含量法间接测定发菜细胞生物量[6],发菜细胞中的叶绿素含量计算[7]:
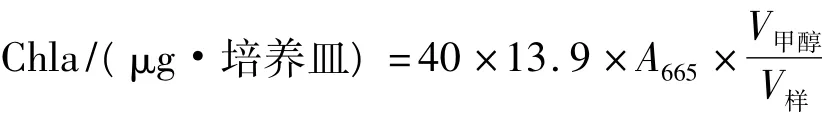
1.2.4 数据统计分析
所有实验数据重复3次测定,采用SPSS 17.0软件处理。数值采用均数(平均数)±标准差来表示,并作差异性分析。
2 实验结果
不同固体基质材料平均粒度见表1。
2.1 固体基质材料粒度

表1 不同固体基质材料的平均粒度(单位:mm)
由表1可知,PA6平均粒度最大,粗沙次之,细沙最小。依据其粒度大小,3种固体材料属于中等大小的颗粒。
2.2 粗沙上添加不同浓度多糖的发菜细胞生物量情况
以粗沙为固体基质,在BG110培养液中分别添加阿拉伯胶、海藻酸钠和果胶,设定多糖浓度均为0.1%、0.3%、0.6%、1.0%。培养一段时间(60天),测定其生物量,以BG110为对照,进行差异显著性分析处理,其结果见表2。

表2 粗沙上添加多糖与BG110生物量的比较
由表2知,同一种多糖不同的浓度与对照组之间均有显著性差异,均能显著促进发菜细胞生物量的提高。在多糖添加浓度为0.3%时,3种多糖对发菜细胞的促进作用均最好,细胞生物量均达到最高,其中海藻酸钠和果胶的促进作用最大,阿拉伯胶次之。在多糖浓度为0.1%时,果胶促进作用最好,海藻酸钠次之,阿拉伯胶最小。在多糖浓度为0.6%时,果胶促进作用最好,阿拉伯胶次之,海藻酸钠最小。在多糖浓度为1.0%时,果胶促进作用最好,阿拉伯胶和海藻酸钠促进作用次之。某一浓度下,3种多糖与对照组之间均有显著性差异。结果表明,多糖之间,无论何种使用浓度,均以果胶的促进作用为最好;浓度之间,均以0.3%添加量促进作用最好。
图1为粗沙上添加0.3%的多糖的发菜细胞生物量情况。从图1可以看出,粗沙上发菜细胞均呈直线生长。培养50天内,0.3%的果胶对发菜细胞生物量的促进作用明显高于0.3%的海藻酸钠和0.3%的阿拉伯胶。培养到60天时,0.3%的果胶和0.3%的海藻酸钠对发菜细胞生物量的促进作用基本相同,此时,发菜细胞生物量达(150.305±0.321)μg/培养皿,而对照组 BG110的生物量仅为(125.471±0.321)μg/培养皿。20~40 d时,0.3%的阿拉伯胶和0.3%的海藻酸钠对发菜细胞生物量的促进作用基本一致。40天后,添加0.3%的海藻酸钠的发菜细胞生物量迅速增加。

图1 粗沙上添加0.3%多糖的发菜细胞生物量情况
2.3 细沙上添加不同浓度多糖的发菜细胞生物量情况
以细沙为固体基质,在BG110培养液中分别添加阿拉伯胶、海藻酸钠和果胶,设定多糖浓度均为0.1%、0.3%、0.6%、1.0%。培养一段时间(60天)时,测定其生物量,以BG110为对照,进行差异显著性分析处理,其结果见表3。
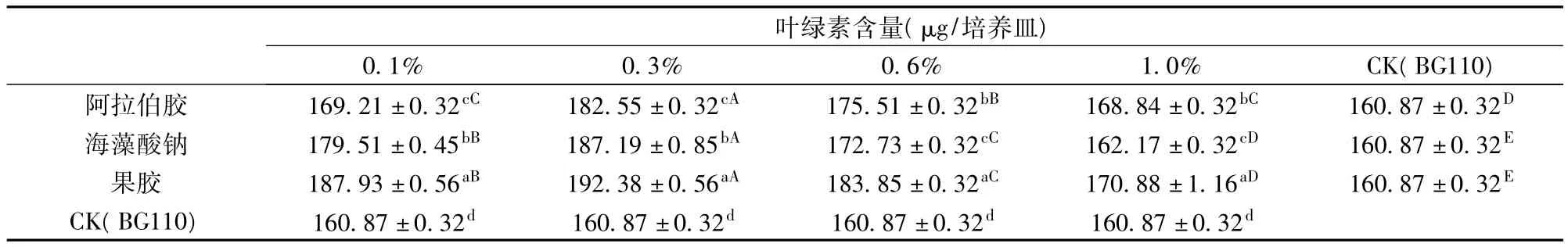
表3 细沙上添加多糖与BG110生物量的比较
由表3知,0.1%的阿拉伯胶和1.0%的阿拉伯胶之间没有显著性差异,海藻酸钠和果胶的不同浓度与对照组之间均有显著性差异。在多糖添加浓度为0.3%时,3种多糖对发菜细胞的促进作用均最好,细胞生物量均达到最高,其中果胶的促进作用最大,海藻酸钠次之,阿拉伯胶最小。在多糖浓度为0.1%时,果胶促进作用最好,海藻酸钠次之,阿拉伯胶最小。在多糖浓度为0.6%时,果胶促进作用最好,阿拉伯胶次之,海藻酸钠最小。在多糖浓度为1.0%时,果胶促进作用最好,阿拉伯胶次之,海藻酸钠促进作用最小。某一浓度下,3种多糖与对照组之间均有显著性差异。结果表明,多糖之间,无论何种使用浓度,均以果胶的促进作用为最好;浓度之间,均以0.3%添加量促进作用最好。
图2为细沙上添加0.3%的多糖的发菜细胞生物量情况。从图2可以看出,细沙上发菜细胞也呈直线生长,0~40 d内,0.3%的果胶对发菜细胞生物量的促进作用明显好于0.3%的海藻酸钠和0.3%的阿拉伯胶。10~30天时,0.3%的海藻酸钠和0.3%的阿拉伯胶对发菜细胞生物量的促进作用基本一致。40~60天时,0.3%的果胶对发菜细胞生物量的促进作用略微高于0.3%的海藻酸钠。培养到60 d时,添加0.3%果胶的发菜细胞生物量达(192.376±0.556)μg/培养皿;添加0.3%海藻酸钠的发菜细胞生物量达(187.187±0.849)μg/培养皿,添加0.3%阿拉伯胶的发菜细胞生物量达(182.553±0.321)μg/培养皿,对照组 BG110的发菜细胞生物量为(160.869±0.321)μg/培养皿。与图1相比,细沙上的发菜细胞生物量高于粗沙上的发菜细胞生物量。

图2 细沙上添加0.3%多糖的发菜细胞生物量情况
2.4 PA6上添加不同浓度多糖的发菜细胞生物量情况
以PA6为固体基质,在BG110培养液中分别添加阿拉伯胶、海藻酸钠和果胶,设定多糖浓度均为0.1%、0.3%、0.6%、1.0%。培养一段时间(60天)时,测定其生物量,以BG110为对照,进行差异显著性分析处理,其结果见表4。

表4 PA6上添加多糖与BG110生物量的比较
由表4知,同一种多糖不同的浓度与对照组之间均有显著性差异,均能显著促进发菜细胞生物量的提高。在多糖添加浓度为0.3%时,3种多糖对发菜细胞的促进作用均最好,细胞生物量均达到最高,其中果胶和海藻酸钠的促进作用最大,阿拉伯胶次之。在多糖浓度为0.1%时,果胶和海藻酸钠促进作用最好,阿拉伯胶次之。在多糖浓度为0.6%时,果胶促进作用最好,阿拉伯胶和海藻酸钠次之。在多糖浓度为1.0%时,3种多糖对发菜细胞的促进作用均最小,其中果胶促进作用最好,海藻酸钠次之,阿拉伯胶促进作用最小。某一浓度下,3种多糖与对照组之间均有显著性差异。结果表明,多糖之间,无论何种使用浓度,均以果胶的促进作用为最好;浓度之间,均以0.3%添加量促进作用最好。
图3为PA6上添加0.3%的多糖的发菜细胞生物量情况。从图3可以看出,PA6上发菜细胞也呈直线生长,但趋势比较缓慢。培养60天内,0.3%的果胶和0.3%的海藻酸钠对发菜细胞生物量的促进作用明显好于0.3%的阿拉伯胶;但是0.3%的果胶和0.3%的海藻酸钠的促进作用基本一致。0~30天内,0.3%的海藻酸钠对发菜细胞生物量的促进作用略微高于0.3%的果胶,40~50天内,0.3%的果胶对发菜细胞生物量的促进作用略微高于0.3%的海藻酸钠,培养到60天时,两者之间的生物量基本相同(添加0.3%果胶的发菜细胞生物量达121.579±0.321μg/培养皿,添加0.3%海藻酸钠的发菜细胞生物量达121.023±0.321μg/培养皿)。与图1和图2相比,固体基质PA6上的发菜细胞生物量明显低于细沙和粗沙上的发菜细胞生物量。

图3 PA6上添加0.3%多糖的发菜细胞生物量情况
3 讨论
对于固体材料来说,细小的颗粒具有较大的比表面积,容易与各种物质相互结合与吸附。另一方面,固体颗粒粒径越小,堆积密度越大,相同体积下堆积的固体颗粒越多,因此颗粒与颗粒之间的空隙越小。在固体颗粒堆积的层面上进行发菜细胞培养时,空隙越小,毛细作用越强,从而利于底部水分的输送,满足发菜细胞对水分的需求,从这一角度考虑,有利于发菜细胞培养的固体基质材料依次为细沙>粗沙>PA6。另外,固体材料的亲水性、疏水性也非常重要[8],沙石的接触角为 22.4°,PA6 的接触角为44.7°,3种固体基质材料都具有一定亲水性,并且沙粒的亲水性高于 PA6[9],从亲水性上来说,沙粒比PA6更有利于发菜细胞的生长。这与实验中的对照结果相符合。
实验过程中,添加3种多糖均能提高发菜细胞生物量,其中添加果胶最有利于发菜细胞的生长,海藻酸钠次之,阿拉伯胶的作用最小。这主要是因为果胶的结构是由多聚半乳糖醛酸α-1,4苷键连成的直链,含有大量亲水性的羧基和羟基,在水中可形成一种带负电荷的粘性胶体溶液,随着果胶的加入,提高了固体基质表面的亲水性[10],使得固体基质之间的润湿状况变得最好,有利于发菜细胞的生长;海藻酸钠主要由古洛糖醛酸和立体异构体甘露糖醛酸两种结构单元组成,分子量在36万左右,结构中含有大量的羟基和-COONa,在添加多糖量相同的情况下,海藻酸钠的亲水性基团略少于果胶;阿拉伯胶结构的中央是以β-1,3键相连的半乳聚糖,L-鼠李糖分布在结构的外表,鼠李糖的碳六位上是CH3[11],阿拉伯胶的结构上还连有2%左右的蛋白质,蛋白质的亲水性小于多糖类,这可能会导致阿拉伯胶的亲水性不及果胶和海藻酸钠,致使添加阿拉伯胶的发菜细胞生物量小于添加海藻酸钠和果胶的发菜细胞生物量。
另外,实验结果表明,多糖的添加量并非越多越好,0.3%的多糖添加量为最宜,超过0.3%后,发菜细胞生物量反而会减少。这是因为多糖的浓度越高,发菜细胞生长环境的渗透压就越大,为使细胞内外渗透压相等,发菜细胞内水分子会向细胞外移动,这就导致发菜细胞脱水,从而不利于发菜细胞的生长,使发菜细胞生物量减少。在发菜细胞生长过程中,加入多糖是为了帮助细胞从周围环境吸附水,但多糖的添加量过高,也会导致环境渗透压过高引起细胞失水,由此说明,在发菜细胞固体培养过程中,为了改善发菜细胞水分的供给,多糖的添加量要控制在适中水平。
总之,发菜细胞在固体培养过程中,通过添加多糖可以改变细胞与固体依附基质表面之间的润湿性,调节细胞从周围环境获取水分的供需状况,有利于发菜在干旱环境中的生长,从而提高发菜的生长速率,但其添加量要控制在合适水平。
[1] 唐进年,赵明,张盹明,等.发菜的生物学特性及资源保护[J].中国野生植物资源,2000,19(5):20-24.
[2] 于瑞红,刘天庆,李香琴,等.固体材料性质对生物垢形成的影响[J].精细化工,2002,19(9):512 - 514.
[3] 陈雪峰,王岳.发菜细胞在不同润湿性的固体基质上生长情况的研究[J].食品工业科技,2010,31(5):218-219.
[4] 高福成,王海鸥.现代食品工程高新技术[M].北京:中国轻工出版社,1997:42-43.
[5] 李毅,谢利利,王名福,等.粉体颗粒形貌特征的提取与识别技术[J].重庆大学学报:自然科学版,2000,23(5):67-69.
[6] Mack inney G.Absorp tion of light by chlorophyll solutions[J].Biol Chem,1941,140:315- 322.
[7] HallD O,Rao K K.Photosynthesis[M].Cambridge:the Press Syndicate of Cambridge,1981:57 -80.
[8] 王修垣.微生物与界面[J].微生物学通报,1999,26(3):230-231.
[9] Chen XF,Jia SR,Yue SJ,et al.Effect of solid bed-materials on vegetative cells of Nostoc flagelliforme[J].Journal of Applied Phycology,2009,22(3):341 -347.
[10] 张爱华,姚康德.壳聚糖/明胶/果胶复合材料的性能研究[D].天津:天津大学,2006.
[11] 王卫平.阿拉伯胶的种类及性质与功能的研究[J].中国食品添加剂,2002(2):23-24.
