蛋白质分析技术在牛乳和人乳鉴别方面的应用
2011-01-08李运飞付绪梅彭泽萍孟洁周衣来卜林
李运飞,付绪梅,彭泽萍,孟洁,周衣来,卜林
(1.六安初创人乳库有限公司,安徽六安 237000;2.六安市金安区妇幼保健院,安徽六安 237000)
蛋白质分析技术在牛乳和人乳鉴别方面的应用
李运飞1,付绪梅2,彭泽萍2,孟洁1,周衣来1,卜林1
(1.六安初创人乳库有限公司,安徽六安 237000;2.六安市金安区妇幼保健院,安徽六安 237000)
概要归纳了人乳、牛乳和大豆中的主要蛋白质在质量分数和特性上的差别,综述了将电泳、色谱、质谱、光谱和免疫组化等蛋白质定量、定性分析技术应用于各类蛋白的分离、鉴定和纯度检测的文献报道,比较了各种检测方法的优缺点,认为变性凝胶电泳技术因其操作简便和成本低廉更适用于人乳产业化初期的原料乳纯度检测。
人乳;蛋白质分析技术;组分鉴别;纯度检测
0 引言
人乳库在采集母乳时,会对捐乳产妇进行必要的营养补偿。一部分产妇往往会受各种因素的驱使,掺入其他类乳物质(如牛乳、奶粉、豆粉等),从而给原料乳带来质量和安全隐患。因此必须对采集的乳汁进行纯度测定。常规的理化检测[1],会因捐乳产妇的体质、饮食、生产方式等而使各参数出现较大范围的波动[2],难以应用。而利用人乳中主要蛋白质的生物学特性,通过各种分析技术,将不同样品之间特征图谱或特征反应的差异作为纯度鉴定的直接依据,却是一种可靠性高、重复性好的方法。
本文全面回顾了采用电泳、色谱、质谱、光谱和免疫组化技术研究人乳和牛乳主要蛋白质的文献,重点关注了鉴别牛乳和人乳中异源蛋白从而判断乳样纯度的报道;从中比较各方法在分辨率、检测限、检测速度、操作难易上的差异,为深入探寻可行的产业化人乳纯度鉴别手段提供思路。
1 差异分析基础——乳蛋白的种类与质量分数
人乳与牛乳以及大豆中的主要蛋白成分在质量分数[3]、分子量和等电点上均有较大差异,这些都成为各种检测技术的分析基础。如表1和表2所示。
表1中,a为泌乳30 d后的常乳;b为β-乳球蛋白单体分子量,其常以二聚体形式存在;c为免疫球蛋白A二聚体的分子量。在强还原剂的作用下可分解为4条重链(分子量约50 000 u)、4条轻链(分子量约25 000 u)、1条分泌片(分子量约78 000 u)和1条J链(分子量约15 000 u);d为免疫球蛋白G单体的分子量,包括2条重链(分子量约55 000 u)和2条轻链(分子量约25 000 u)。
2 蛋白质电泳技术
近年来,电泳已成为蛋白质鉴别与定量检测时最常采用的技术。一般可以分为变性凝胶电泳(SDSPAGE)、等电聚焦电泳(IEF)、二维电泳(2-DE)和毛细管电泳(CE)等。
2.1 变性凝胶电泳(SDS-PAGE)
在SDS-PAGE中,不同分子量的高丰度乳蛋白均可以在电泳图谱上显现。根据蛋白条带的位置和灰度,并结合标准品的图谱,可以判断出蛋白种类,进而可推测乳样的纯度。
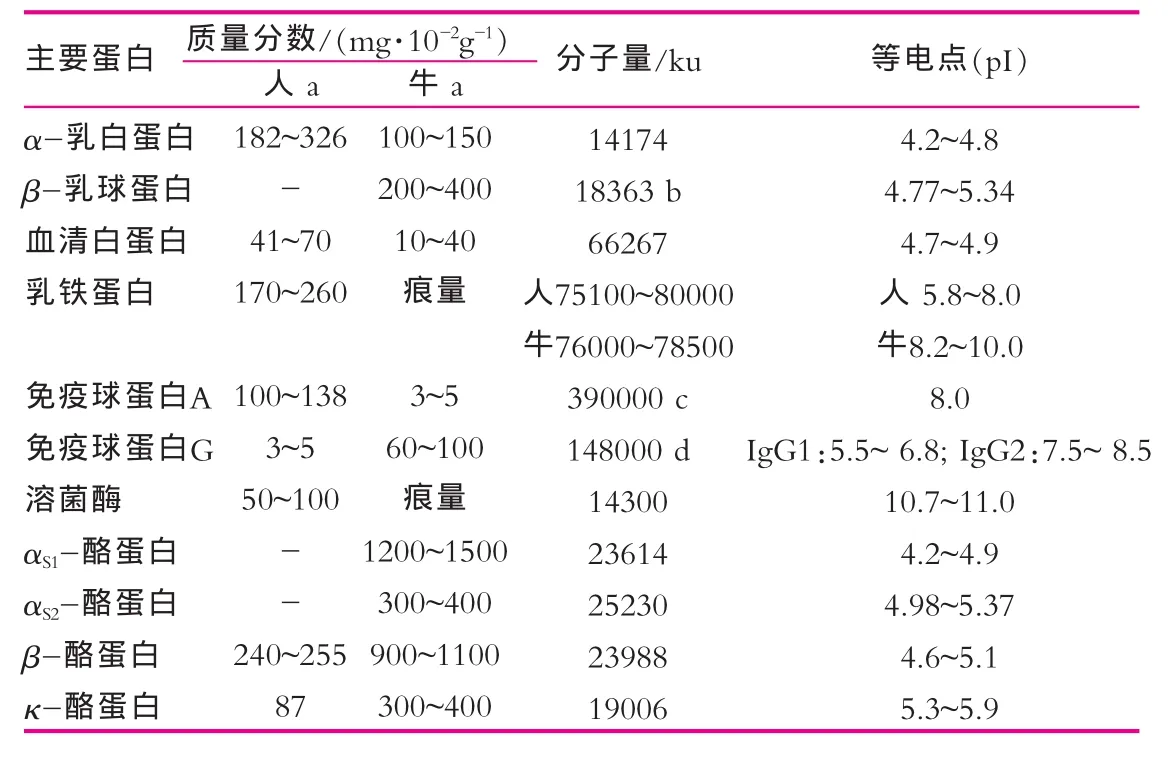
表1 人乳、牛乳中主要蛋白质的生物学特性
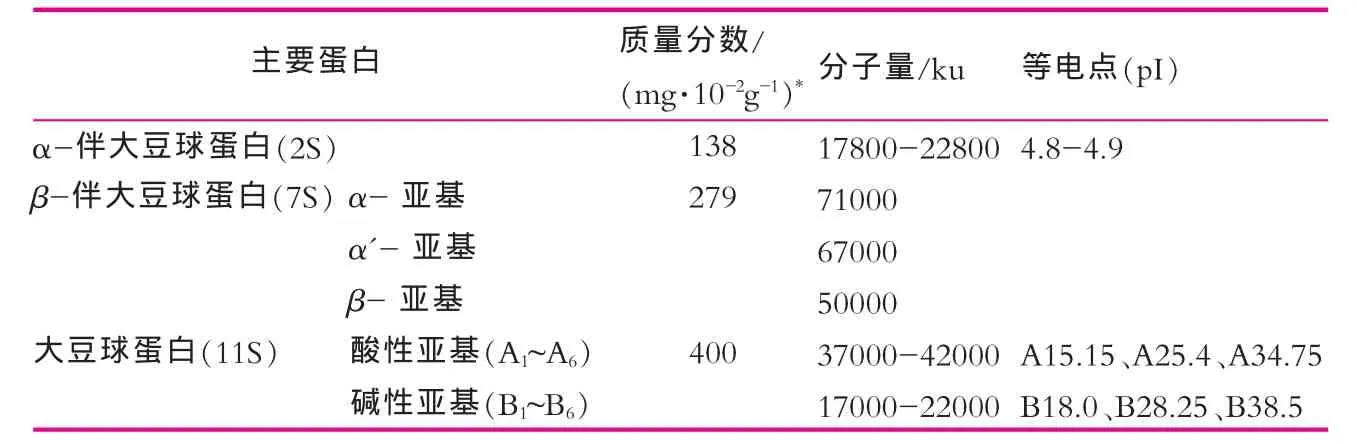
表2 大豆中主要蛋白质的生物学特性
SDS-PAGE最初被用于牛乳中酪蛋白的分离鉴别,获得了αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白和γ-酪蛋白的3个亚基,以及β-乳球蛋白、α-乳白蛋白的电泳图谱。此后,徐丽、张杉、张春刚和韩奕奕等人[4-7]分别对新鲜脱脂牛初乳液、乳清蛋白浓缩粉、牛初乳乳清、牛常乳乳清、免疫牛乳乳清等进行了SDS-PAGE,相继得到了IgG重链、乳铁蛋白、血清白蛋白等蛋白图谱。黄慧华等[8]观察了不同处理条件下大豆蛋白的电泳图谱,其中大豆分离蛋白呈现出12条带,大豆水浸提液获得17条带。这些蛋白图谱所传达出的蛋白分子量和质量分数信息与文献报道呈现出较好的一致性,成为日后鉴别人乳纯度的有力依据。
Hewedy M.M[9]较早地将SDS-PAGE用于牛乳中异类蛋白的检测。他对比了掺入豆乳的牛乳SDSPAGE图谱,发现质量分数为5%的豆乳添加量即可在图谱上显示出与纯牛乳明显的差异。赵慧芬[10]对牛乳、豆奶和二者混合物进行电泳,得到了7条牛乳蛋白带和13条豆奶蛋白带,并且通过颜色最深的豆奶蛋白带推算出牛乳中掺入的豆奶最低检测限为5%。高巍[11]也对新鲜脱脂牛乳、羊奶、豆粉溶解液的电泳图谱差异进行了研究。结果显示,3种乳样的蛋白条带呈现出明显差异,其中牛乳与羊乳在低分子量区域的蛋白条带较为相似,但中高分子量则差异较大;而豆乳在整个区域内的蛋白条带均与牛乳和羊乳有显著区别。
在使用SDS-PAGE研究人乳蛋白的文献中,王静等人[12]对母乳进行免疫亲和层析,并用SDS-PAGE检验免疫前后母乳中高丰度蛋白的质量分数,得到了6条清晰的蛋白条带(乳铁蛋白、血清白蛋白、IgA的重链和轻链、酪蛋白以及被疑为血清白蛋白碎片的蛋白)。David J.Palmer等人[13]在研究脱脂人初乳中的微量蛋白时,用SDS-PAGE检测脱除高丰度蛋白的效果,在脱除前的初乳电泳图谱上也观察到了乳铁蛋白+IgA的分泌片、血清白蛋白+IgA的重链、IgA轻链、I-gA的J链以及α-乳白蛋白共5条带。Mary Boesman-Finkelstein等人[14]对脱脂脱酪蛋白的人乳乳清液进行了SDS-PAGE,得到了乳铁蛋白、血清白蛋白、IgA重链、IgA轻链、溶菌酶以及分子量约30000和20000的蛋白共7条带。Ronayne de Ferrer P.A.等人[15]在研究南象海豹初乳汁成分时,使用了人乳和牛乳作为对照,在SDS-PAGE中获得了5条人乳和4条牛乳的蛋白条带。
2.2 等电聚焦电泳(IEF)
IEF始于20世纪60年代。因其pH值可以达到0.02~0.001的分辨率,远优于SDSPAGE的分离与鉴别效果,因此也成为研究乳蛋白的有力工具。
Peterson[16]于1969年最早使用了IEF技术分析牛乳酪蛋白,获得了20条酪蛋白带。此后,IEF技术被广泛应用于κ-酪蛋白A型与B型的鉴别、全牛乳蛋白的分析以及对牛乳乳清蛋白和酪蛋白中遗传变异特性的分析中。
至今尚未见到利用单独的IEF技术研究人乳蛋白的报道,原因在于IEF与SDS-PAGE结合,可以发展成更高分辨率的电泳技术—2-DE。
2.3 二维电泳(2-DE)
2-DE充分利用了蛋白质分子在等电点与亚基分子量上的二相差异,在IEF后将泳道旋转90度,在第二维方向上继续SDS-PAGE,可以获得分辨率极高的蛋白点。因此,尽管2-DE技术问世只有30多年,但已被认为是当前分辨率最高、信息量最大的电泳技术,广泛使用于乳蛋白质组学的研究中。
2-DE最早于1981年被用于牛乳酪蛋白的分析上。此后数年中,又分别被用到牛乳清蛋白和脱脂牛乳的研究中。Yamada M.等人[17]应用2-DE结合微阵列和质谱分析,鉴定牛初乳和常乳中低丰度蛋白的表达差异。图谱表明:IgG的重链与轻链以及β-酪蛋白在牛初乳与牛常乳中的含量有较大差异,而α-乳白蛋白、β-乳球蛋白的质量分数较稳定。此外,在牛初乳的2-DE图谱上还发现了至少6个低丰度蛋白点,在牛常乳中未见。
在人乳研究方面,Kouki Murakami等人[18]利用2-DE技术详细研究了人初乳与人常乳乳清中微量蛋白的差异。用免疫亲和层析去除乳清中的绝大部分乳铁蛋白、α-乳白蛋白和sIgA后,对剩余的微量乳清蛋白进行分析,得到了约400个蛋白点。对其中较为清晰的28个点进行氨基酸序列分析,并检索蛋白质数据库,根据序列契合程度确认了其中的22种蛋白质,包括αS1-酪蛋白和β-酪蛋白、溶菌酶、血清白蛋白、转铁蛋白和sIgA的重链及轻链等。Kim H.Y.和Jemenez-Flores R.[19]深入研究了5种哺乳动物(人、牛、山羊、猪和鼠)乳汁蛋白在2-DE下的图谱差异。他们认为人、猪和鼠的蛋白斑点分布与牛和山羊的差别较大,可能源于食性的根本不同。Anderson N.G.等人[20]对全人乳(指包含酪蛋白和乳清蛋白)和人乳清进行2-DE后,识别出主要的人乳蛋白,包括14个酪蛋白点(9个翻译后修饰的β-酪蛋白和5个α-酪蛋白)、α-乳白蛋白、乳铁蛋白、血清白蛋白和转铁蛋白;Goldfarb M.等人[21]对脱脂人乳进行2-DE后获得34个蛋白点,涵盖了I-gA、酪蛋白、乳铁蛋白、血清白蛋白、α-乳白蛋白和溶菌酶。
以2-DE为基础的多种分析手段的联合使用不仅大大提升了人们认识乳蛋白的能力,也使得从更高精度和更微量水平上分析异种乳蛋白间的差异成为可能。如Goldfarb M.等人[22,23]在1997年进行完2-DE后用选择性抗体识别出多种人乳脂肪球膜蛋白;在其1999年的研究中又使用了酪蛋白单克隆抗体和计算机成像技术分析出人乳中酪蛋白的细微组分和质量分数。2-DE结合特异性抗体的免疫印记技术研究人乳中的微量蛋白(如巨噬细胞转移抑制因子)也获得成功。
2.4 毛细管电泳(CE)
CE利用了细管径(500~5 μm)带来的热效应低、进样量少、流动速度快和高分辨率等优点,迅速成为与2-DE技术一样的乳蛋白质组学研究的有力工具。
国内外将CE技术用于牛乳制品掺杂检测的研究已经有多篇报道。Isidra Recio等人[24]综述了用CE检测牛乳中各蛋白的多态性、热处理对蛋白构象的影响以及如何检测掺假物质。Jesús López-Tapia等人[25]研究了在脱脂奶粉中添加不同量(从0至44%)大豆浓缩蛋白和大豆分离蛋白时的CE图谱,结果奶粉中的α-乳白蛋白、β-乳球蛋白和α-酪蛋白;大豆中的α-伴大豆球蛋白(2S)、大豆球蛋白(11S)中的酸性亚基、β-伴大豆球蛋白(11S)中的β-亚基以及α-和α’-亚基4条峰均随着添加量的变化呈现出“此消彼长”的变化趋势。刘婷[26]进行了类似研究。在CE图谱中,可见牛乳中的α-乳白蛋白、β-乳球蛋白、α-酪蛋白、β-酪蛋白和κ-酪蛋白;以及大豆中的8条蛋白吸收峰,并且峰形位置和峰值不随乳样品种而变化。她最终根据牛乳酪蛋白峰的积分面积与大豆蛋白峰积分面积的比值估算出掺入大豆蛋白的比例。张智武[27]在对比SDS-PAGE、CGE(毛细管凝胶电泳)和CZE(毛细管区带电泳)分离鉴别脱脂牛乳蛋白的效果时,在最优的CZE图谱上也观察到上述5条带。Isidra Recio等人[28]研究了UHT牛乳中掺入牛皱胃酶凝乳清固体的检测方法。此外,鲜牛乳和不同阶段婴幼儿奶粉在CE下的吸收峰图谱、不同物种(牛、绵羊和山羊)间乳的CE图谱以及对牛乳不同处理方式(原料牛乳、巴氏杀菌乳核UHT乳)下乳清蛋白对总蛋白比率(通过CE吸收峰面积累加计算)的差异也被深入研究,均被认为可以作为牛乳中异源蛋白(包括非鲜乳)检测的备选方法。
Manso M.A.等人[31]利用毛细管区带电泳(CZE)进行了开创性的人乳与牛乳的鉴别比较研究。他分析了不同泌乳阶段下脱脂人乳中主要蛋白的电泳图谱,同时以UHT(超高温瞬时灭菌)牛乳做为对照,结果在3周时的人乳中出现了溶菌酶、乳铁蛋白的峰形,而牛乳则没有;牛乳特有的β-乳球蛋白在人乳中也没有出现。并且α-乳白蛋白、β-酪蛋白的峰高;以及α-酪蛋白的峰位置在人乳和牛乳间也有明显差异。该报道还进一步归纳了从0至17周的各段人乳中乳清蛋白对酪蛋白的比例以及β-酪蛋白的6种磷酸化异构体的相对质量分数(均由峰面积计算得出),为区分鉴别人乳与牛乳、人初乳和人常乳提供了重要依据。
3 液相色谱技术
HPLC具有特异性强、灵敏度高、速度快、对蛋白质变性不敏感等诸多优点,被许多研究者用于乳蛋白分离鉴定和纯度鉴别中。
HPLC技术可以轻松实现对乳蛋白中各种成分乃至遗传变异体的分离。如Hollar C.M.等人[30]通过离子交换快速蛋白质液相色谱(CE-FPLC)从牛乳酪蛋白分离出αS1-、αS2-、β-、κ-和γ-5种亚型。Bordin G.等人[31]使用离子束反相HPLC从UHT乳、巴氏杀菌乳、乳粉和鲜牛乳中分离出αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白和κ-酪蛋白,α-乳白蛋白,以及β-乳球蛋白的A型和B型。王浩等人(2009)[32]和王娟等人(2009)[33]也获得过相近的分离结果。
在异类乳蛋白检测方面,HPLC得到了充分发挥,利用不同的特征指示物反映出各种异源蛋白的掺加程度。如通过对比水解动物蛋白与乳粉的氨基酸指纹图谱,确定出甘氨酸、丙氨酸等差异显著的6种特征氨基酸,从而建立一种对乳粉中掺加的水解动物蛋白的半定量检测方法。通过检测牛乳中羟脯氨酸的含量,间接反映出乳中掺加的胶原水解蛋白的量,可获得质量浓度为2.5 mg/L的检出限。通过检测γ-和κ-酪蛋白以及β-乳球蛋白的含量,推算奶酪中牛乳、绵羊乳和山羊乳的百分比,从而判断奶酪的掺假情况。Jerzy Dziuba等人[34]在将混杂了牛乳蛋白的大豆分离蛋白用胰蛋白酶水解后,通过HPLC观测到两类乳蛋白水解物中游离氨基酸的特征峰,可以判断出5%的牛乳掺加量。
单纯利用HPLC技术研究人乳蛋白的文献少有报道。而以HPLC作为分离手段,以MS、光谱或免疫组化技术作为鉴定手段的报道却屡见不鲜。
4 生物质谱技术
生物质谱技术兴起于20世纪80年代末。由于具有检测灵敏度高,质量范围宽,分析速度快,样品用量少和性能可靠等优点,所以很快就成为复杂生物体系中多肽与蛋白质分析鉴定的首选工具。目前被广泛用于蛋白质组学研究的质谱技术包括电喷雾质谱(ESIMS)、基质辅助激光解吸电离飞行时间质谱(MALDITOF-MS)和傅里叶变换离子回旋共振质谱(FT-ICR-MS)。此外,将HPLC与MS结合使用的报道也屡见不鲜。
早期的质谱技术被用于研究奶牛乳汁的蛋白成分。随后,又相继被用于研究婴儿配方奶粉中蛋白质的构成、绵羊乳中主要蛋白及其变异体、山羊乳蛋白和牛乳乳清蛋白。
与HPLC一样,MS应用于乳样中异类蛋白检测时,也根据特征标志物进行判断。如根据大豆球蛋白,β-伴大豆球蛋白和豌豆球蛋白被胰蛋白酶水解后的多肽含量,判断脱脂牛乳粉中掺加的大豆或豌豆蛋白,可估算出最低1%的添加量。以α-乳白蛋白和β-乳球蛋白作为标志物,推测出绵羊乳、山羊乳和水牛乳中添加的牛乳比例,以及在原料牛乳中掺加的乳粉,检测限均可达到5%。Kristian Hovde Liland等人[35]对应用于牛乳、山羊和绵羊乳鉴别检测的MALDI-TOF-MS技术,从参数优化到准确度分析进行了详细的讨论。
利用MS技术对人乳进行的研究虽然仍未涉及到检测其中的异类蛋白,但对各种人乳蛋白及其异构体的精准分析,仍让我们看到了它所具有的巨大潜力。Silvia Catinella等人[36]利用MALDI-TOF-MS技术研究了脱脂后的人初乳、人常乳的质谱图,发现随着泌乳期的延长,乳铁蛋白、sIgA的重链呈递减趋势,α-乳白蛋白、溶菌酶、β-酪蛋白和κ-酪蛋白则逐渐增多,而血清白蛋白基本保持恒定。Gianluca Picariello等人[37]用亲水相互作用色谱(HILIC)结合MALDI-TOF-MS分析脱脂人乳中的N-交联糖蛋白,在质谱图上可以分辨出αS1-酪蛋白的2种异构体、β-酪蛋白的4种异构体、κ-酪蛋白以及乳铁蛋白的3种异构体。石磊等人[38]利用FT-ICR-MS技术分析了经过脱脂和酶解的人乳乳脂、乳清和乳粒中的蛋白成分,其中在乳清部分获得了乳铁蛋白、α-乳白蛋白、β-酪蛋白、κ-酪蛋白、αS1-酪蛋白剪接亚型2和免疫球蛋白多聚体受体的质谱信息;在乳粒部分获得了乳铁蛋白、αS1-酪蛋白剪接亚型2、免疫球蛋白多聚体受体和溶菌酶C的质谱信息。John W.Froehlich等人[39]应用无标记液相色谱串联质谱法(Label-free liquid chromatography–tandem mass spectrometry)分析了人乳中蛋白磷酸化的动力学特征,其中α-酪蛋白、β-酪蛋白和免疫球蛋白多聚体受体的各磷酸化异构体均得到定量。
5 近红外光谱技术
近红外光谱具有分析速度快、精度高、成本低,不产生化学污染,仪器操作和维护简单等优点,以它为基础开发出的牛乳成分自动分析仪已在国内乳品行业中得到广泛应用。因此国内的研究报道普遍聚焦于近红外光谱技术对牛乳成分的全面分析,通过对牛乳蛋白、脂肪、乳糖各类物质中的含氢基团的振动图谱来推断其中是否掺有外来物质,如韩东海等人[40]通过光谱分析可以判断出生鲜牛乳中掺入的10%的还原乳,正确率达96.7%;李亮等人[41]应用主成分分析法得到能反映牛乳99.32%红外光谱信息的6个主成分,由这些成分的得分图可以区分掺羊奶和豆浆的牛乳,鉴别正确率在95%以上。
国外学者将光谱技术用于检测动物乳样中异类蛋白的报道也有数篇,如Beatriz Miralles等人[42]使用四阶导数光谱技术测定了UHT灭菌乳中乳清蛋白对总蛋白的比率,可以推算出UHT乳中掺加的最少5%的乳清蛋白。I.González-Martín等人[43]用远程反射光纤探头获取不同成熟期奶酪中各成分的近红外光谱数据,从中可以分析出牛乳、绵羊乳和山羊乳的添加比例。N.Nicolaou等人[46]利用傅里叶转换红外光谱(FT-IR)技术分析牛乳、绵羊乳和山羊乳的任意二相或三相混合物,可以测定出质量分数为5%的任何一种乳。目前尚无应用红外光谱技术分析人乳成分的文献报道。
6 免疫组织化学技术
免疫组织化学技术按照标记物的种类可分为免疫荧光法、免疫酶法、免疫铁蛋白法、免疫金法及放射免疫自显影法等。目前采用较多的是免疫酶法,又称酶联免疫吸附法(ELISA)。由于酶的高催化效率,间接放大了反应结果,故可以达到很高的灵敏度。
免疫组化做为一种快速且准确度较高的蛋白质分析手段,已被多位研究者用于各类乳蛋白的定量检测上。如对牛乳制品中α-乳白蛋白、β-乳球蛋白、αS-酪蛋白和κ-酪蛋白的定量研究;对牛乳β-酪蛋白、κ-酪蛋白的检测;对牛初乳中乳铁蛋白的检测;以及对人初乳与成熟乳中的分泌型IgA的检测等。
在研究乳样中异类蛋白的检测方面,国外学者较多研究了绵羊乳、山羊乳和牛乳的鉴别方法。按照制备的抗体种类,可以分为①兔抗乳蛋白抗体,如Teresa García等人[45]和Elena Rodríguez等人[46]采用的兔抗牛乳清蛋白抗体和抗牛酪蛋白抗体;ERODRíGUEZ等人[47]采用的兔抗山羊酪蛋白单克隆抗体。②鸡抗乳蛋白抗体,如Manfred Beer等人[48]和Wolfgang Richter等人[49]采用的鸡抗牛β-乳球蛋白抗体、鸡抗牛γ3-酪蛋白抗体。③鼠抗乳蛋白抗体,如I.P.Hurley等人[50]采用的交联过氧化物酶的鼠抗牛IgG抗体。④反刍动物间的乳蛋白抗体,如P.Aranda等人[51]采用的交联过氧化物酶的山羊抗绵羊免疫球蛋白抗体;Ian P.Hurley等人[52]采用的连接山羊抗牛IgG多克隆抗体的单克隆抗体。
此外,免疫组化技术也被直接用在牛乳中掺杂的豆乳;奶酪中掺加的巴氏杀菌乳、UHT灭菌乳或热变性乳清粉以及脱脂乳粉和酪乳粉中掺加的牛皱胃酶凝乳清粉的检测上。E Bertino等人[53]在研究母亲膳食中牛乳摄入量对乳汁成分的影响时,用ELISA法测定出牛β-乳球蛋白含量;并且在将抗原抗体复合物分开后,识别出了母乳中的乳铁蛋白、β-酪蛋白和α-乳白蛋白。此结果也为免疫组化技术用于人乳纯度鉴别提供了最直接的依据。
免疫化学与其他分析手段结合产生的新方法也逐渐被应用到乳中异类蛋白的检测中。Carmen Martín-Hernández等人[54]利用侧流免疫层析试纸条测试(immunochromatographic lateral-flow test dipstick test)技术检测了脱脂牛乳粉、鲜牛乳、巴氏杀菌乳和UHT乳中的乳清掺加量。通过两种特异性抗牛κ-酪蛋白单克隆抗体与牛酪蛋白糖巨肽的结合,最低可以观察到4%的乳清存在。Harvey E.Indyk[55]应用近几年才出现的无标记型免疫传感技术,用表面等离子共振传感器测定了牛乳中抗牛α-乳白蛋白抗体含量,检测限为0.12 g/L。这些研究都为免疫组化技术分析乳蛋白领域注入了新动力。
7 结束语
总体上看,SDS-PAGE、2-DE和MS对人乳蛋白的研究相对较多,尤其是2-DE,其研究的深度与广度对我们在高分辨率和微观量上探讨适合产业化的原料乳纯度检测技术大有裨益。而在涉及牛乳与异类蛋白差异方面,CE、HPLC、MS和免疫组化技术无疑走得更远一些。直接研究人乳中异类蛋白检测的文献尚无报道,这也成为人乳产业化中需尽全力攻克原乳纯度检测难题的动力之一。
SDS-PAGE虽然分辨率并不高,但由于操作简便,对仪器设备要求不高,而日益成为分离、定量乳蛋白质的基础技术,也多作为预分离手段广泛用于2-DE,CE,HPLC,MS和免疫分析中。2-DE技术具有高通量、高分辨率的特点,但其对蛋白点图像处理的繁琐与费时限制了它用于原料乳纯度检测的范围。HPLC和MS一般被联合使用,将HPLC对复杂样品的高分离能力与MS的高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,更多的用于检测乳样中的农残、药残。HPLC和MS设备昂贵,对使用者有较高要求,限制了技术的普及。以ELISA为代表的免疫组化技术需要制备高纯度的乳蛋白克隆抗体,操作繁琐,且多针对几类假想的掺假物质,应用面窄。红外光谱技术需要建立稳定性和可靠性强的模型,对建模人员的经验要求较高;此外乳样中水分、各类物质的存在形式(如真溶液、胶体溶液、乳浊液等)也会干扰红外光的穿透,造成散射影响结果的准确。
人乳男,生理医学博士,从事生长激素和综合考虑各种技术的优缺点,CE具有高检测精度和较快的检测速度,但仪器设备昂贵,操作复杂。对于处在初创期的生产型企业来说,SDS-PAGE技术具有更为现实的性价比,并且易于普及推广。
[1]庞广昌,陈庆森,胡志和,等.乳品安全性和乳品检测技术[M].北京:科学出版社,2005.
[2]ROBERT G J.Miscellaneous Factors Affecting Composition and Volume of Human and Bovine Milks[M].San Diego,USA:Academic Press,1995:237-271.
[3]GUO Mingruo,GREGORY H M.Chemistry and Biological Properties of Human Milk[J].Current Nutrition&Food Science,2008,4(4): 305-320
[4]徐丽.牛初乳中免疫球蛋白的提取与活性保持技术研究[D].北京:中国农业大学,2005.
[5]张杉,陈敏,李慧.SDS-PAGE电泳测定乳清蛋白方法的研究[J].食品科技,2008(1):215-219.
[6]张春刚,王加启,刘光磊,等.牛初乳、常乳和免疫乳乳清中主要蛋白的SDS-PAGE分析[J].扬州大学学报(农业与生命科学版),2008,29(2):43-47.
[7]韩奕奕,黄菲菲,王建军,等.凝胶电泳法(SDS-PAGE)测定乳与乳制品中β-乳球蛋白的含量[J].乳业科学与技术,2009,32(2):74-77.
[8]黄惠华,高孔荣,郭乾初,等.大豆原料及其分离蛋白的SDS-PAGE图谱研究[J].食品科学,2000,21(6):15-19.
[9]HEWEDY M M,SMITH C J.Detection of SOY milk in pasteurized bovine milk[J].Food Hydrocolloids,1989,3(5):399-405.
[10]赵慧芬.十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测牛奶中掺杂的豆奶[J].食品科学,1996,17(11):50-53.
[11]高巍,孙庆林,王鹏.聚丙烯酰胺凝胶电泳快速鉴定牛乳蛋白质的研究[J].畜牧与饲料科学,2008,29(6):1-3.
[12]王静,王利红,高艳,等.母乳蛋白质组学研究[J].中国乳品工业,2009,37(1):4-9.
[13]DAVID P J,VAN K C,SMIT A,et al.Human Colostrum,Identification of Minor Proteins in the Aqueous Phase by Proteomics[J/OL]. Proteomics,2006,6(7):2208-2216.
[14]BOESMANFINKELSTEIN M,RICHARD F A.Sequential Purification of Lactoferrin,Lysozyme and Secretory Immunoglobulin a from Human Milk[J].FEBS Letters,1982,144(1):1-5.
[15]PETERSON F R.Electrofocusing of Milk Proteins[J].Journal of Dairy Science,1969,52(6):903.
[16]FERRER A P,COLASO A R,MARQUEZ E M,et al.Southern Elephant Seal(Mirounga Leonina)ii.Studies of Milk Protein Fractions by GEL Electrophoresis[J].Polar Biology,1996,16(4):241-244.
[17]MASAMICHI Y,MURAKAMI K,JOHN W C,et al.Identification of Low-Abundance Proteins of Bovine Colostral and Mature Milk Using Two-Dimensional Electrophoresis Followed by Microsequencing and Mass Spectrometry[J].Electrophoresis,2002,23(7):1153-1160.
[18]MURAKAMI K,LAGARDE M,YUKI Y D.Identification of Minor Proteins of Human Colostrum and Mature Milk by Two-Dimensional Electrophoresis[J].Electrophoresis,1998,19(14):2521-2527.
[19]KIM H H Y,JIMENEZ-FLORES R.Comparison of milk proteins using preparative isoelectric focusing followed by polyacrylamide GEL electrophoresis[J].Journal of Dairy Science,1994,77(8):2177-2190.
[20]ANDERSON N,POWERS M,TOLLAKSEN S.Proteins of human milk.i.identification of major components[J/OL].Clinical Chemistry, 1982,28:1045-1055.
[21]MARCIA G F,MAUREEN S S,JEAN I A.Two-Dimensional Electrophoretic Analysis of Human Milk Proteins[J/OL].Electrophoresis,1989,10(1):67-70.
[22]GOLDFARB M D.Two-Dimensional Electrophoretic Analysis of Human Milk-Fat-Globule Membrane Proteins with Attention to Apolipoprotein E Patterns[J].Electrophoresis,1997,18(3):511-515
[23]GOLDFARB M D.Two-Dimensional Electrophoresis and Computer Imaging:Quantitation of Human Milk Casein[J].Electrophoresis, 1999,20(4):870-874
[24]ISIDRA R,LOURDES A,ROSINA L F.Assessment of the Quality of Dairy Products by Capillary Electrophoresis of Milk Proteins[J]. Journal of Chromatography B,1997,697(1):231-242.
[25]JESÙS L T,MÓNICA R G R,MARÍA A,et al.Detection of the Presence of SOYA Protein in Milk Powder by Sodium Dodecyl Sulfate Capillary Electrophoresis[J].Journal of Chromatography a,1999, 836(1):153-160.
[26]刘婷,姜金斗,刘宁.毛细管电泳检测奶粉中添加的大豆分离蛋白[J].分析科学学报,2008,24(1):37-41.
[27]张智武,许建香.3种电泳方法定量分析牛奶蛋白的比较[J].中国乳品工业,2005,33(8):51-54.
[28]ISIDRA R,MÓNICA R G R,ROSINA L F,et al.Detection of Rennet WHEY Solids in UHT Milk by Capillary Electrophoresis[J]. International Dairy Journal,2000,10(5):333-338.
[29]MANSO M A,MIGUEL M,LPEZ-FANDIOR.Application of Capillary Zne Electrophoresis to the Characterisation of the Human Milk Protein Profile and Its Evolution Throughout Lactation[J].Journal of Chromatography a,2007,1146(1):110-117.
[30]HOLLAR C M,LAW A J R,DALGLEISH D G,et al.Separation of major casein fractions using Cation-Exchange fast protein liquid chromatography[J].Journal of Dairy Science,1991,74(8):2403-2409.
[31]BORDIN G,CORDEIRO RAPOSO F,CALLE B.DE LA,et al. Identification and quantification of major bovine milk proteins by liquid chromatography[J].Journal of Chromatography a,2001,928(1): 63-76.
[32]王浩,张志国,常彦忠,等.RP-HPLC法对乳制品中主要牛奶蛋白的分离及定量测定[J].食品科学,2009(24):376-380.
[33]王娟,张庆合,王志华,等.反相高效液相色谱法测定牛奶中的主要蛋白质[J].分析化学,2009(11):1667-1670.
[34]JERZY D,DOROTA N,PIOTR M,et al.Identification and determination of milk and soybean protein preparations using enzymatic hydrolysis followed by chromatography and chemometrical data analysis[J].Analytica Chimica ACTA,2004,521(1):17-24.
[35]KRISTIAN H L,BJØRN-HELGE M,ELLING-OLAV R,et al. Quantitative whole spectrum analysis with MALDI-TOF ms,part i: measurement optimisation[J].Chemometrics and Intelligent Laboratory Systems,2009,96(2):210-218.
[36]CATINELLA S,SERAGLIA R,MARSILIO R.Evaluation of protein profile of human milk by matrix-assisted laser desorption,ionization mass spectrometry[J].Rapid Communications in Mass Spectrometry,1999,13(14):1546-1549.
[37]GIANLUCA D P,FERRANTI P,MAMONE G,et al.Identification of N-Linked Glycoproteins in Human Milk by Hydrophilic Interaction Liquid Chromatography and Mass Spectrometry[J].Proteomics,2008,8(18):3833-3847
[38]石磊,刘晓梅,程舸,等.人乳中蛋白质的组成分析[J].应用化学,2010,27(9):1099-1104.
[39]FROEHLICH J W,CHU C S,TANG NING,et al.Label-Free Liquid Chromatography–Tandem Mass Spectrometry Analysis with Automated Phosphopeptide Enrichment Reveals Dynamic Human Milk Protein Phosphorylation During Lactation[J].Analytical Biochemistry,2011,408(1):136-146.
[40]韩东海,鲁超,刘毅,等.生鲜乳中还原乳的近红外光谱法鉴别[J].光谱学与光谱分析,2007(3):465-468.
[41]李亮,王雷鸣,丁武.近红外光谱技术结合人工神经网络鉴别生鲜奶和蛋白掺假奶[J].食品工业,2009(6):67-70.
[42]MIRALLES B,BARTOLOMÉ B,AMIGO L,et al.Comparison of three methods to determine the WHEY protein to total protein ratio in milk[J].Journal of Dairy Science,2000,83(12):2759-2765.
[43]GONZÁLEZ-MARTÍN I,HERNÁNDEZ-HIERRO J M,MOR? N-SANCHO R,et al.Determination of the percentage of milk (cow's,ewe's and goat's)in cheeses with different ripening times using near infrared spectroscopy technology and a remote reflectance fibre-optic probe[J].Analytica Chimica ACTA,2007,604(2):191-196.
[44]NICOLAOU N,XU Y,GOODACRE R.Fourier transform infrared spectroscopy and multivariate analysis for the detection and quantification of different milk species[J].Journal of Dairy Science,2010,93 (12):5651-5660.
[45]GARCÍA T,MARTÍN R,RODR?GUEZ E,et al.Detection of bovine milk in ovine milk by an indirect Enzyme-Linked immunosorbent assay[J].Journal of Dairy Science,1990,73(6):1489-1493.
[46]RODRÍGUEZ E,MARTÍN R,GARCÍA T,et al.Detection of cows'milk in ewes'milk and cheese by a sandwich enzyme-linked immunosorbent assay(elisa)[J].Journal of the Science of Food and A-griculture,1993,61(2):175-180.
[47]RODRÍGUEZ E,MARTÍN R,GARCÍA T,et al.Indirect elisa for detection of goats'milk in ewes'milk and cheese[J].International Journal of Food Science&Technology,1991,26(5):457-465.
[48]BEER M,KRAUSE I,STAPF M,et al.Indirect competitive enzyme-linked immunosorbent assay for the detection of native and heat-denatured bovine β-lactoglobulin in ewes'and goats'milk cheese[J].Zeitschrift Für Lebensmitteluntersuchung UND-Fors, 1996,203(1):21-26.
[49]RICHTER W,KRAUSE I,GRAF C,et al.An indirect competitive elisa for the detection of cows’milk and caseinate in goats’and ewes’milk and cheese using polyclonal antibodies against bovine γcaseins[J].Zeitschrift Für Lebensmitteluntersuchung UND-Fors, 1997,204(1):21-26.
[50]HURLEY I P,COLEMAN R C,IRELAND H E,et al.Measurement of bovine IGG by indirect competitive elisa as a means of detecting milk adulteration[J].Journal of Dairy Science,2004,87(3): 543-549.
[51]ARANDA P,SÁNCHEZ L,P?REZ M D,et al.Rapid immunoenzymatic method for detecting adulteration in ewe's milk[J].Food Control,1993,4(2):101-104.
[52]HURLEY I P,COLEMAN R C,IRELAND H E,et al.Use of Sandwich IgG ELISA for the Detection and Quantification of Adulteration of Milk and Soft Cheese[J].International Dairy Journal,2006, 16(7):805-812
[53]BERTINO E,PRANDI G,FABRIS C,et al.Human milk proteins may interfere in elisa measurements of bovine β-lactoglobulin in human milk[J/OL].ACTA Paediatrica,1996,85(5):543-549.
[55]INDYK H E.Development and application of an optical biosensor immunoassay for α-lactalbumin in bovine milk[J].International Dairy Journal,2009,19(1):36-42.
Application of protein analysis technology for components identificating and purity detecting of bovine milk and human milk
LI Yun-fei,FU Xu-mei,PENG Ze-ping,MENG Jie,ZHOU Yi-lai,BU Lin
(Liuan Initial Human Milk Bank Co.Ltd.,Liuan 237000,China)
This paper briefly summarized the differences on the content and features of major proteins in human milk,bovine milk and soybean,overviewed literatures that reported application to the separation and identification of milk protein and purity detection to the milk samples with electrophoresis,chromatography,mass spectra,spectrum and immunohistochemistry technology,compared the advantages and disadvantages of all methods.We conclude that denaturing gel electrophoresis is more suitable for the purity testing of human milk in early industrialization because of its easy and low cost.
human milk;components identification;purity detection
TS252.1
B
1001-2230(2011)06-0040-06
2011-03-06
李运飞(1975-),男,工程师,从事乳品科学研究。通讯作者:卜林
