蔬菜发酵剂乳酸菌产生物胺的检测与评价
2010-03-24田丰伟丁俊荣刘小鸣
田丰伟,孟 甜,丁俊荣,刘小鸣,张 灏,陈 卫*
(江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
蔬菜发酵剂乳酸菌产生物胺的检测与评价
田丰伟,孟 甜,丁俊荣,刘小鸣,张 灏,陈 卫*
(江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
通过联合采用聚合酶链式反应(PCR)技术和高效液相色谱分析(HPLC)技术对本实验室筛选保藏的60余株拟准备用于蔬菜发酵的乳酸菌形成生物胺的能力和水平进行检测和评价。氨基酸脱羧酶基因的PCR检测结果表明,受检菌株中有3株组氨酸脱羧酶阳性菌和22株酪氨酸脱羧酶阳性菌;同时,利用HPLC法对受检乳酸菌在MRS培养基体系和模式蔬菜发酵体系中发酵形成生物胺的水平进行分析。受试乳酸菌在MRS培养基中组胺产生量在4.32~32.15mg/L之间,酪胺产生量在9.22~114.02mg/L之间。在发酵蔬菜体系中,组胺和酪胺的产生量均小于40mg/L。PCR检测结果与HPLC分析结果具有较好的一致性。
乳酸菌;发酵蔬菜;生物胺;组胺;酪胺;氨基酸脱羧酶;检测
生物胺是氨基酸在微生物脱羧酶作用下形成的一类碱性低分子质量有机物。食品中生物胺主要是由氨基酸经乳酸菌脱羧形成,而且高浓度的生物胺往往出现在发酵食品中[1]。适量生物胺在体内具有特定的生理活性,过量摄入时会损害健康[2]。Nout等[3]指出组胺和酪胺的最大摄入量应该为50~100mg/kg和100~800mg/kg,酪胺的摄入量超过1080mg/kg会引起严重中毒。除了组胺、酪胺本身的作用外,其他生物胺的存在会增强组胺和酪胺的不良作用。因此,很难确定一个标准来衡量生物胺的毒性[4]。目前各国都没有明确的最大摄入量规定[5]。生物胺是影响发酵和腌制蔬菜产品安全的一个主要风险因素。如何有效检测与评价乳酸菌产生物胺的能力是开发蔬菜发酵剂时所必须要考虑的一个问题。
目前生物胺的检测方法主要包括微生物学方法、化学法和分子生物学方法。传统微生物学方法检测生物胺产生菌是繁琐且不准确的,有报道称乳酸菌在长期保藏中或在合成培养基上生长可能会丧失产生生物胺的能力[6-7],可能导致使用化学法定量检测也有失偏颇,而分子生物学方法快速可靠且不依靠培养基,正弥补了其他方法的不足。因为生物胺是脱羧酶作用于氨基酸前体而最终形成的,所以分子生物学法以编码脱羧酶的基因为目标物进行检测与研究。聚合酶链式反应(PCR)法具有简便、快速、敏感和专一等特点,已经成为重要的氨基酸脱羧酶基因的检测方法[8]。以实验室保藏的60余株乳酸菌为检测对象,采用PCR技术对其基因组片段进行扩增,检测其氨基酸脱羧酶基因,并利用HPLC法对乳酸菌在MRS培养基中和蔬菜发酵模式体系中产生物胺的情况进行分析和评价,为蔬菜发酵剂乳酸菌的开发与应用提供必要的基础数据。
1 材料与方法
1.1 材料
1.1.1 菌种
乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)和双歧菌属(Bifidobacterium)等60余株乳酸菌,由江南大学中国工业微生物资源和信息中心、内蒙古农业大学、国立台湾大学和江南大学食品生物技术研究室提供;酪氨酸脱羧酶阳性对照菌短乳杆菌(L. brevis IOEB 9809) 南京农业大学;组氨酸脱羧酶阳性菌弯曲乳杆菌(L. curvatus GY2512)为本实验室保藏菌种。实验菌株来自不同发酵来源,种属分类、生化性质明确。
1.1.2 培养基与材料
MRS液体培养基 青岛海博生物技术有限公司;卷心菜 市售。
1.1.3 试剂
蛋白胨、胰蛋白胨、牛肉膏、酵母膏、葡萄糖、氯化钠、乙酸钠、柠檬酸氢二铵、柠檬酸铵、K2HPO4、MgSO4、MnSO4国药集团化学试剂有限公司。
PCR引物PHDC1/PHDC2(up:5′CCGTGCG GAAACAAAGAAT3′/down:5′CCA AACACCAGC ATCTTCA3′)[9],P2-for/P1-rev(up:5′GAYATIATI GGIATIGGIYTIGAYCARG3′/down:5′CCRTART CIGGIATIGCRAARTCIGTRTG3′)[9]上海博尚生物技术有限公司;Taq酶、dNTPs 上海皓嘉生物技术有限公司;DNA提取试剂盒(EZ-10 Spin Column Genomic DNA Isolation Kit) 上海生工生物工程有限公司。
1.2 方法
1.2.1 菌种活化
于超低温冰箱中将甘油保藏乳酸菌取出,以1%体积分数的接种量接种于10mL MRS液体培养基中,37℃培养,传代两次,活化乳酸菌备用。
1.2.2 模式蔬菜发酵体系
卷心菜是发酵蔬菜最常用的蔬菜品种,因此选择卷心菜作为模式蔬菜发酵体系,其具体制作方法如下,选择洁净无腐烂的新鲜卷心菜,经清洗、切分、打浆、取汁,离心去除不溶性固形物,然后经115℃杀菌20min,冷却后以体积分数2%比例接种待测乳酸菌,于37℃发酵12h,待测。
1.2.3 基因组DNA提取
按照基因组提取试剂盒操作说明书进行。
1.2.4PCR检测脱羧酶基因
据报道,酪胺和组胺是发酵蔬菜中主要的生物胺,因此选择酪氨酸脱羧酶基因和组氨酸脱羧酶基因作为检测目标。选择25μL扩增体系:10×buffer 2.5μL,引物(PHDC1/PHDC2,P2-for/P1-rev)1μL,dNTPs 2.5μL,Taq酶0.5μL,模板DNA1μL。将上述反应液按顺序加入0.2mL离心管中,以无菌ddH2O补足至25μL,充分混匀,扩增反应条件:组氨酸脱羧酶PCR扩增程序为:95℃预变性,5min;循环数:30;95℃变性,45s;50℃退火,1min;72℃延伸,35s;72℃终延伸,10min。酪氨酸脱羧酶PCR扩增程序:95℃预变性,5min;循环数:30;95℃变性,45s;55℃退火,1min;72℃延伸,56s;72℃终延伸,10min。
1.2.5PCR产物回收测序及同源性分析
扩增产物经柱式胶回收试剂盒纯化后送样到上海生工测序,测定结果使用NCBI上的Blast进行同源性比对分析。
1.2.6 生物胺的HPLC分析[10]
样品前处理:样品与0.06g/mL三氯乙酸等体积混合,静置提取1h,双层滤纸过滤,待衍生。
色谱条件:Waters symmetry C18色谱柱(4.6mm× 250mm,5μm),采用梯度洗脱,梯度洗脱程序(表1);流速:1.2mL/min;检测波长:254nm;进样量:20μL;柱温:35℃。
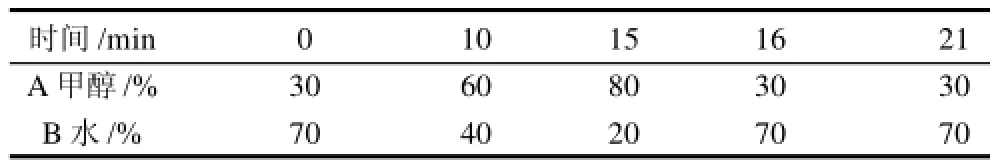
表1 HPLC法检测生物胺的改进梯度洗脱程序Table 1 HPLC gradient elution program for biological amine analysis
生物胺混合标样衍生[11]:取2mL标样加入1mL 2mol/L NaOH溶液调整pH值至碱性,加入10μL苯甲酰氯水浴30℃衍生处理40min,而后加入2mL饱和NaCl溶液 60℃水浴5min终止衍生化,加3mL乙醚振荡混合,萃取完全后移取上层有机相至干净试管,用氮气吹干后,加1mL甲醇溶解,每个样品5次平行,取20μL进样测定生物胺含量。
样品衍生:衍生步骤同上,衍生后取20μL进样测定生物胺含量。
2 结果与分析
2.1 标准曲线的绘制
分别从生物胺混合标准溶液中准确量取一定量的标准品,配制成0、1.00、5.00、10.0、25.0、50.0mg/L等一系列质量浓度混合标准溶液,采用上述方法衍生,测定,每个质量浓度重复测定5次。采用外标法,将5种生物胺峰面积与相应质量浓度进行线性回归,绘制校准曲线,各种生物胺的线性关系、相关系数见表2。分析结果表明,该HPLC法测定的4种生物胺标准品,在1.00~50.0mg/L的质量浓度范围内线性关系良好(R2>0.998),证明该方法对测定4种生物胺具有良好的可靠性。

表2 标准曲线的线性方程与相关系数Table 2 Regression equations and correlation coefficients
2.2 组氨酸和酪氨酸脱羧酶基因的PCR检测和生物胺的HPLC分析结果
再按照试剂盒操作要求进行,提取待检测乳酸菌菌的基因组,再进行电泳验证,60余株乳酸菌均得到大小约为2Mb的较清晰的基因组条带。
以PHDC1/PHDC2、P2-for/ P1-rev为引物,以乳酸菌基因组DNA为模板分别检测组氨酸和酪氨酸脱羧酶基因,图1为部分菌株目的脱羧酶基因扩增产物的电泳图,分别扩增出500bp和900bp左右的条带。
对组氨酸脱羧酶和酪氨酸脱羧酶基因扩增产物进行测序,测序结果提交到NCBI上进行Blast比对。表明L.helveticus T16、Lceuconostoc mesenteroides subsp. cremoris 12273、Bifidobacterium bifidum BCRC14615扩增出的序列与Lactobacillus reuteri JCM 1112、Lactobacillus reuteri DSM 20016、Lactobacillus sp. 30a的组氨酸脱羧酶基因序列高度同源,同源性分别高达98%、98%、97%,表明该扩增产物是组氨酸脱羧酶基因。Lactobacillus helveticus C1302、Lactobacillus helveticus D1401,Bifidobacerium bifidum BB-20等22个菌株扩增出的序列与Enterococcus faecium、Enterococcus faecium strain Ef1、Enterococcus faecium strain Ef2 的酪氨酸脱羧酶基因序列高度同源,同源性均高于97%,证明该扩增产物是酪氨酸脱羧酶基因。
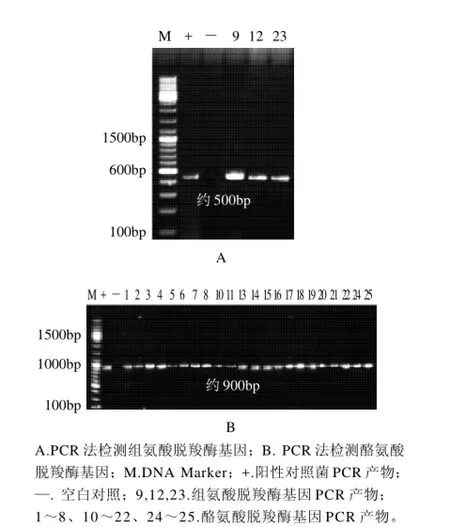
图1 PCR法检测组氨酸脱羧酶和酪氨酸脱羧酶基因Fig.1 PCR method to detect the genes of histidine decarboxylase and tyrosine decarboxylation enzyme
对待测乳酸菌在MRS培养基和发酵卷心菜中产生物胺的量进行分析测定,结果见表3。待测乳酸菌产生物胺的HPLC分离效果色谱图如图2所示。

图2 生物胺分离效果色谱图Fig.2 HPLC chromatogram for a standard mixture of biological amine
表3和图2结果表明,在受试菌中有3个菌株具有产组胺的能力,而具有产酪胺能力的菌株为22株,但是不同的菌株生成酪胺的能力差别较大,其原因可能在于酪胺的形成除了受本身基因的影响之外还受基质和环境条件的影响。因为产生生物胺必须包括以下3个条件:存在生成生物胺的前体氨基酸;存在含有氨基酸脱羧酶的微生物;有适宜的环境条件[12]。也就是说有些菌株虽然含有氨基酸脱羧酶基因,但不一定会产生生物胺,还要看是否存在利于产生生物胺的条件。发酵食品中生物胺除去外源性微生物污染外,自身发酵剂的使用不当或发酵环境的控制不好都会引起其在食品中的积累而达到或超过安全限[13]。
生物胺是通过底物和酶反应生成的,广泛存在于各类食品中,在富含蛋白质和氨基酸的食品中相对更多[14]。据报道,虽然可产生生物胺的微生物并不是广泛的分布在各个种属,但是几乎每个种属都存在产生物胺的菌株,并没有种属特异性。但其产生的量却千差万别[15]。此外,食品中生物胺的产生与不良的卫生环境和储藏条件有关,所以采取相应的措施就可以避免生物胺的产生[16]。未来需要进一步开展关于乳酸菌产生生物胺条件的研究。
通过对NCBI上已报道的乳酸菌组氨酸脱羧酶和酪氨酸脱羧酶的蛋白和基因序列进行比对,发现来自不同种属乳酸菌脱羧酶的基因序列高度保守。因此,通过设计合适引物来对乳酸菌脱羧酶基因进行PCR检测是检测乳酸菌产生物胺可能性的一种快速高效的检测方法[9]。PCR检测表征了乳酸菌是否具有产生物胺的潜在能力,HPLC分析结果直接定量表示发酵体系中有无生物胺的形成或高低,二种方法结合使用能很好的对乳酸菌产生物胺的能力和水平进行评价。在本研究中,对受试菌株而言,PCR结果与HPLC检测结果具有较好的一致性,因此可以综合采用两种方法对乳酸菌是否形成生物胺进行评价和检测。
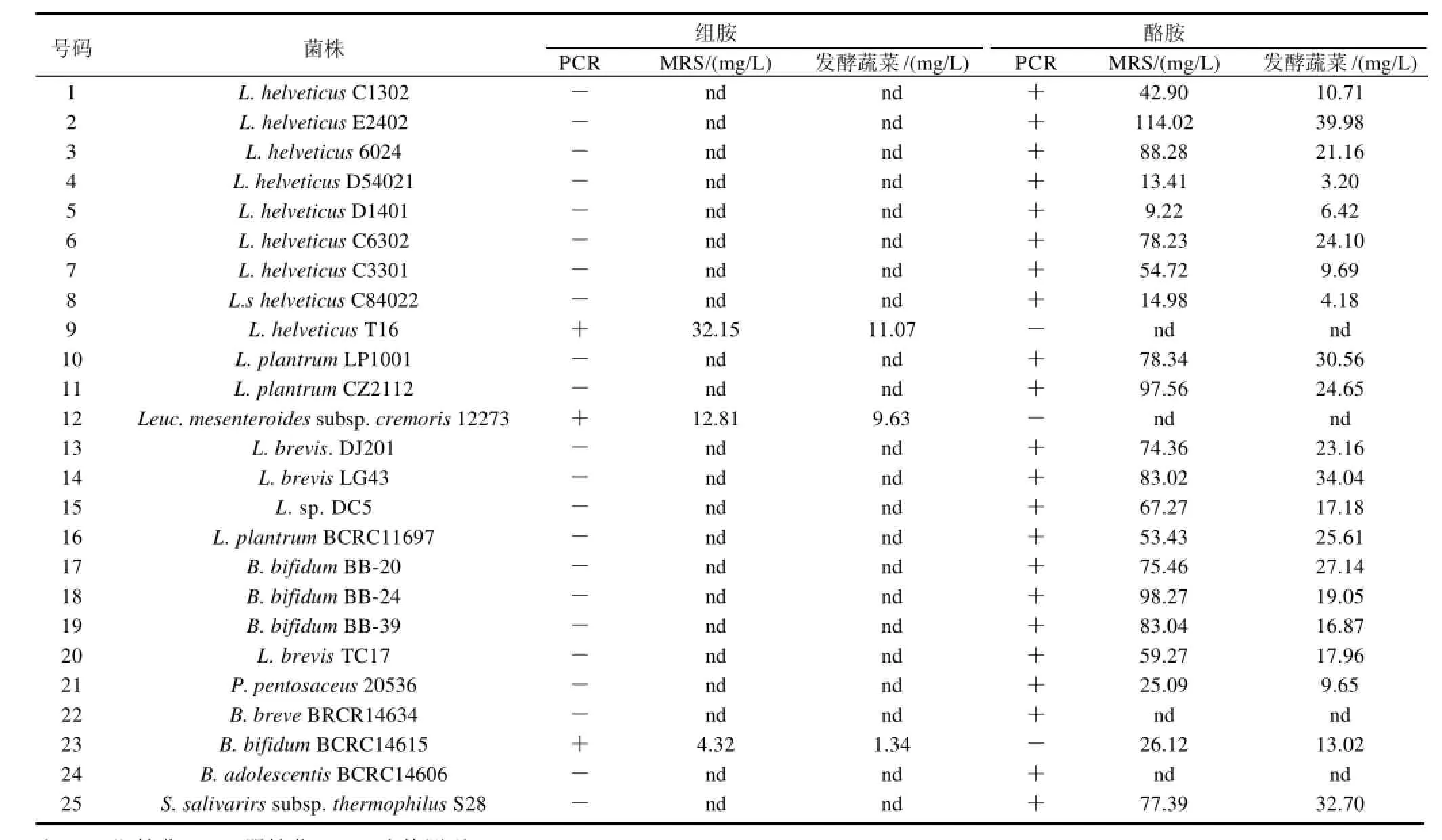
表3 部分乳酸菌产生物胺的PCR检测和HPLC分析结果Table 3 PCR and HPLC results of biological amines produced by different lactic acid bacterial strains
3 结 论
本研究对本实验室保藏的60余株乳酸菌的氨基酸脱羧酶基因进行PCR检测,对其产生物胺的潜在可能性做初步分析,筛查出酪氨酸脱羧酶和组氨酸脱羧酶阳性的菌株。利用HPLC法分析待测菌株在培养基体系和蔬菜发酵体系中产生物胺的情况,受试乳酸菌在MRS培养基中产生组胺的含量在4.32~32.15mg/L之间。酪胺产生量在9.22~114.02mg/L之间。而在发酵蔬菜体系中,组胺和酪胺的产生量均小于40mg/L。结果低于美国FDA规定的食品中组胺含量低于50mg/L和酪胺含量高于100mg/L的限量标准要求。
[1]何庆华, 吴永宁, 印遇龙. 食品中生物胺研究进展[J]. 中国食品卫生杂志, 2007, 19(5): 451-454.
[2]PARENTE E, MATUSCELLI M, GARDINI F, et al. Evolution ofmicrobial populations and biogenic amines production in dry sausages produced in southern Italy[J]. Journal of Applied Microbiology, 2001, 90: 882-891.
[3]NOUT M J R. Fermented foods and food safety[J]. Food Research International, 1994, 27: 291-298.
[4]刘辰麒, 丁卓平, 王锡昌. 生物胺的检测方法评价[J]. 现代科学仪器, 2006(4): 89-91.
[5]SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29: 675-690.
[6]LONVAUD-FUNEL A, JOYEUX A. Histamine production by wine lactic acid bacteria: isolation of a histamine-producing strain of Leuconostoc oenos[J]. J Appl Bacteriol, 1994, 77: 401-407.
[7]IZQUIERDO-PULIDO M, CARCELLER-ROSA J M, VIDALCARON M C, et al. Tyramine formation by Pediococcus spp. during beer fermentation[J]. J Food Protect, 1997, 60: 831-836.
[8]MARCOBAL A, de LAS RIVAS B, MORENO-ARRIBAS M V, et al. Multiplex PCR method for the simultaneous detection of histamine-, tyramine-, and putrescine -producing lactic acid bacte-ria in foods[J]. J Food Protect, 2005, 68: 874-878.
[9]LANDETE J M, DE LAS RIVAS B, MARCOBAL A, et al. Molecular methods for the detection of biogenic amine-producing bacteria on foods [J]. International Journal of Food Microbiology, 2007, 117(3): 258-269.
[10]孟甜, 田丰伟, 陈卫, 等. 一种利用RT-HPLC分析乳酸菌产生物胺的方法[J]. 微生物学通报, 2010, 37(1): 141-146.
[11]HWANG Dengfwu, CHANG Shenghsiung, SHIUA Chyuanyuan, et al. High-performance liquid chromatographic determination of biogenic amines in fish implicated in food poisoning[J]. Journal of Chromatography B, 1997, 693: 23-30.
[12]SILLA-SANTOS M H. Biogenic amines: their importance in foods[J]. International Journal of Food Microbiology, 1996, 29: 213-231.
[13]程三宝, 朱俊玲, 马俪珍. 微生物与发酵食品中的生物胺[J]. 食品工程, 2007(1): 11-13.
[14]蔡成岗, 张慧, 王智敏, 等. 食品中生物胺及其检测方法研究进展[J].食品研究与开发, 2009, 30(10): 153-156.
[15]MARCOBAL A, MARTI-ALVAREZl P J, MORENO-ARRIBAS M V, et al. A multifactorial design for studying factors influencing growth and tyramine production of the lactic acid bacteria Lactobacillus brevis CECT 4669 and Enterococcus faecium BIFI-58[J]. Research in Microbiology, 2006, 157: 417-424.
[16]HALASZ A, BARATH A, SIMON-SARKADI L, et al. Biogenic-amines and their production by microorganisms in food[J]. Trends in Food Science and Technology, 1994, 5: 42-49.
Detection and Evaluation of Biological Amine Produced by Lactic Acid Bacteria for Vegetable Fermentation
TIAN Feng-wei,MENG Tian,DING Jun-rong,LIU Xiao-ming,ZHANG Hao,CHEN Wei*
(State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
PCR and HPLC methods were used to detect and evaluate the capability of biological amine formation by more than 60 lactic acid bacterial strains. PCR detection of amino acid decarboxylase genes exhibited that 3 and 22 genes from tested strains were positive in histidine decarboxylase and tyrosine decarboxylase, respectively. At the same time, biological amine formation in tested strains was evaluated in MRS liquid media and vegetable fermentation model was determined by HPLC method. The production levels of histamine and tyramine produced by tested lactic acid bacteria in MRS media were 4.32-32.15 mg/L and 9.22-114.02 mg/L, respectively. In fermented cabbage system, production levels of both histamine and tyramine were less than 40 mg/L.
lactic acid bacteria;fermented vegetable; biological amine;histamine;tyramine;amino acid decarboxylase;detection
Q939.97
A
1002-6630(2010)24-0241-05
2010-04-23
国家“863”计划项目(2007AA10Z353);“十一五”国家科技支撑计划项目(2009BAD9B05);国家自然科学基金项目(20836003)
田丰伟(1976—),男,讲师,硕士,研究方向为食品微生物学。E-mail:fwtian@jiangnan.edu.cn
*通信作者:陈卫(1966—),男,教授,博士,研究方向为食品微生物学。E-mail:weichen@jiangnan.edu.cn
