激光解吸/激光后电离质谱法快速检测黄酒中酪胺
2018-01-18冷宜昕王彤彤殷志斌
冷宜昕,王彤彤,殷志斌,刘 蓉,杭 纬
(厦门大学化学化工学院,谱学分析与仪器教育部重点实验室,福建 厦门 361005)
黄酒是中国特有的酒类,由谷米低度酿造而成。酒曲中的菌种含有蛋白酶,可分解蛋白质产生多种人体必需的氨基酸,故被称为“液体面包”。在黄酒发酵过程中,酒曲中的微生物所产生的氨基酸脱羧酶可使氨基酸发生脱羧作用产生生物胺(biogenic amine, BA)[1]。生物胺是一类具有生物活性的含氮有机物,属于生命机体的生理物质,但生物胺含量过高会对人体的神经系统造成损伤[2]。酪胺是黄酒发酵过程中产生的一种重要生物胺,其前体多巴胺由酪氨酸脱羧酶和单胺羟化酶的催化作用产生。当人体摄入过量的酪胺时,会导致神经系统紊乱、亢奋、血压升高以及偏头痛,即产生所谓的“奶酪效应”[3]。中华人民共和国国家标准委员会制定了包含酒类、肉类等五大类食品中生物胺含量的分析方法[4]。
由于实际样品体系的复杂性与生物胺在样品体系中的低含量,对于酪胺、组胺等生物胺的检测常常需要预处理,将体系中的组分预先进行分离、提纯、富集再检测。最常见的分析手段是高效液相色谱法,其具有灵敏度高与准确性好的特点,但常常需要复杂的样品预处理和衍生化[5],而预处理过程使黄酒中生物胺的监控十分不便,因此本课题组提出了一种无需样品预处理即可对黄酒样品直接上样快速分析的质谱法。
激光解吸/激光后电离质谱法(laser desorption/laser postionization mass spectrometry, L2MS)是一种应用广泛的质谱分析手段,该方法使用两束激光对待测物进行分析,第一束激光使待测物在分解前迅速从样品表面解吸出来,第二束激光将气化的待测物分子电离形成分子离子进入质谱分析区。在实验过程中,使用第二束激光使气化分子电离服从双光子共振电离机理(resonant two-photon ionization, R2PI),其原理示于图1。待测物分子在吸收一个光子能量后到达驰豫时间较长的稳定激发态,再通过吸收第二个光子使其发生电离[6]。激光解吸/激光后电离质谱法对酪胺的研究可以追溯到19世纪80年代,Tembreull和Lubman课题组使用L2MS结合R2PI技术对儿茶酚胺类物质及其衍生物进行分析,在低能量的后电离激光下得到了清晰的酪胺纯样谱图[7]。对于实际样品体系,由于其复杂性,直接进行质谱分析十分困难,常常需要使用高效液相色谱-串联质谱法(HPLC-MS)进行分析,实验过程复杂、耗时长。
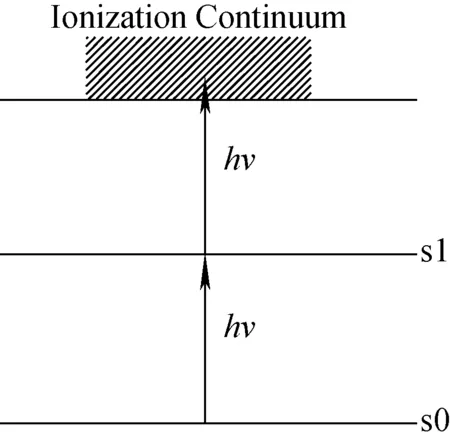
图1 双光子共振电离原理示意图Fig.1 Schematic diagram of resonant two-photon ionization
本研究将着眼于R2PI对芳香体系的选择性[8],以有效地减少黄酒体系中复杂基体对酪胺检测的干扰。使用自行搭建的质谱装置在不进行任何样品预处理的前提下,对黄酒实际样品进行直接快速的分析,希望通过使用简单的标准加入法即可测定实际样品中的酪胺含量。
1 实验部分
1.1 装置与仪器
本课题组自行组装了一台激光解吸/激光
后电离质谱仪,装置图示于图2。Nd:YAG纳秒激光器(Minilite-Ⅱ):美国Continuum公司产品,激光频率10 Hz,激光脉宽5 ns,解吸和后电离激光波长分别为532 nm和266 nm;WaveSurfer 44Xs示波器:美国LeCroy公司产品;microTOF-QⅡ四极杆串联飞行时间质谱仪:美国Bruker公司产品。
1.2 主要材料与试剂
酪胺纯样(纯度98%):上海源叶生物科技有限公司产品;黄酒样品:浙江绍兴县唐宋酒业有限公司产品;乙腈(分析纯):美国Sigma公司产品。
1.3 质谱条件
1.3.1纯样实验 解吸激光(532 nm)能量21 μJ,后电离激光(266 nm)能量400 μJ,延迟时间6 800 ns。
1.3.2激光解吸对比实验 激光解吸质谱(LDI-MS)解吸激光(532 nm)能量 120 μJ,延迟时间6 800 ns。
1.3.3黄酒样品实验 解吸激光(532 nm)能量117 μJ,后电离激光(266 nm)能量1.38 mJ,延迟时间6 800 ns。
1.3.4ESI-MS对比实验 电喷雾离子源正离子模式,流速180 μL/h,毛细管电压4 kV。
2 结果与讨论
2.1 酪胺纯样分析
酪胺属于生物样品,故选择乙腈-水溶液(1∶1,V/V)作为溶剂对酪胺纯样进行分析。

图2 自行搭建的激光解吸/激光后电离质谱仪示意图Fig.2 Schematic diagram of the in-house-built L2MS setup
将酪胺纯样溶于乙腈-水溶液中,配制成1 mL酪胺混合溶液,其浓度梯度为0.5、1、10、50、100 mg/L,取2 μL混合溶液滴于洁净的样品靶上(不锈钢靶),样品靶与进样杆上的二维移动平台直接相连,将样品置于高真空下。酪胺分子的电离能为(8.41±0.12) eV,本实验的后电离激光波长为266 nm(hν=4.67 eV),双光子能量(9.34 eV)大于酪胺分子的电离能,符合R2PI机理。在不开启后电离激光时,通过优化解吸激光(532 nm)至激光能量为21 μJ时,分子离子峰恰好不在质谱图中显示;此时再开启后电离激光(266 nm)并优化至激光能量为400 μJ时,可获得较强的分子离子峰信号,优化后的延迟时间为6 800 ns,通过谱图发现,在酪胺浓度很低时仍可以得到较好的分子离子峰及特征峰。

如果使用其他质谱分析手段对酪胺进行分析,所得的谱图远不如使用L2MS法得到的谱图清晰。如对高浓度(1 000 mg/L)酪胺纯样进行激光解吸质谱分析(LDI-MS,解吸激光波长为532 nm),酪胺分子几乎完全被击碎,得到的质谱图示于图3b。优化后的解吸激光(532 nm)能量为120 μJ,但无法通过调节激光能量获取酪胺分子的分子离子峰及特征碎片峰,且杂质峰增加。通过谱图对比发现,即使将酪胺纯样的浓度升高2个数量级也无法在直接解吸电离下获得明显的分子离子峰。
实验通过将不同浓度的酪胺纯样进行单点完全解吸,对所得谱图进行叠加,将酪胺分子的分子离子峰峰高与酪胺分子浓度的线性关系进行外推,计算L2MS法对酪胺纯样的检出限。将浓度梯度为0.5、1、10、50、100 mg/L的酪胺纯样进行L2MS分析,多次重复实验后所得的谱图示于图4。可以看出,即使浓度降至0.5 mg/L,谱图依然清晰简洁,便于解析。其中,为了更好地进行浓度梯度比较,0.5 mg/L和1 mg/L谱图放大了20倍,将谱图中分子离子峰(m/z137)峰高与酪胺浓度进行线性回归,得到的线性关系示于图5。对谱图空白处信号进行统计,获得背景噪音的相对标准偏差,结合线性关系斜率,并根据公式LOD=3σ/k,得到L2MS法检测酪胺纯样的检出限为32 μg/L。

图3 解吸激光能量为21 μJ,后电离激光能量为400 μJ时,酪胺浓度为10 mg/L的L2MS图(a);解吸激光能量为120 μJ时,酪胺浓度为1 000 mg/L的LDI-MS图(b)Fig.3 L2MS of tyramine at the concentration of 10 mg/L obtained as the function of laser energy: Edesorption=21 μJ and Eionization= 400 μJ (a); LDI-MS of tyramine at the concentration of 1 000 mg/L obtained at the desorption laser energy of 120 μJ (b)

注:为清晰的表示酪胺浓度为1 mg/L与0.5 mg/L时谱图,将其信号放大了20倍图4 解吸激光能量为21 μJ,后电离激光能量为400 μJ时,梯度浓度的酪胺纯样L2MS图Fig.4 L2MS of gradient concentrations of tyramine solutions obtained as the function of Edesorption=21 μJ and Eionization=400 μJ
公式中σ为谱图中背景噪音的标准偏差,k为标准曲线的拟合斜率。

图5 L2MS法获得的酪胺纯样中酪胺分子离子峰信号强度与浓度的线性关系Fig.5 Intensity-concentration curve of pure tyramine sample by L2MS
2.2 黄酒实际样品分析
取2 μL黄酒实际样品滴在洁净的不锈钢靶上,进行质谱分析。当解吸激光(532 nm)能量为117 μJ,后电离激光(266 nm)能量为1.38 mJ时,信噪比最高,分子离子峰较强且碎片较少,便于谱图解析,得到的L2MS图示于图6a。可以发现,酪胺分子的分子离子峰(m/z137)与特征峰(m/z107)信号较强。黄酒的主要成分是乙醇、水及糖类,并含有少量的有机酸、蛋白质、维生素以及矿物质。在实验过程中,糖类、有机酸等分子质量较大的有机物无法被R2PI电离。食品中的生物胺包括酪胺、组胺、色胺、尸胺、精胺、亚精胺、腐胺、苯乙胺[10-11]。在谱图中只有酪胺有较强的信号产生,这是因为酪胺的芳香性结构使其能够通过R2PI方法进行电离,266 nm激光的后电离可以对其高效电离。由于实际样品分析中的激光功率较高,在谱图上可以发现较多的有机物碎片,这是由部分小分子的糖类和有机酸裂解造成的,同时还有环境中的钠钾污染,以及不锈钢靶所含有的金属元素,质谱图示于图6b。从整张谱图上看,酪胺分子的信号强度较强,说明该方法对酪胺的检测具有较高的选择性。
如果不进行预处理,直接使用电喷雾飞行时间质谱(ESI-MS)对黄酒实际样品进行分析,由于ESI-MS的质量歧视问题,在谱图中无法获得小分子质量的碎片峰,同时,由于黄酒体系的复杂性,酪胺分子无法在基体中获得竞争电离,谱图解析困难。与之相比,L2MS法体现了高选择性检测的优势,酪胺可以在复杂基体中通过R2PI电离机理被选择性电离,产生较强的信号,使检测过程简单便捷。

图6 解吸激光能量为117 μJ,后电离激光能量为1.38 mJ时,黄酒实际样品的L2MS图(a);黄酒实际样品L2MS局部放大谱图(m/z 0~100)(b)Fig.6 L2MS of yellow rice wine obtained at Edesorption=117 μJ and Eionization=1.38 mJ (a); the enlarged mass spectrum of (a) at m/z 0-100 (b)
2.3 标准加入法测定黄酒中酪胺含量
黄酒中生物胺的含量与其原料产地、酿造工艺、原材料品种及添加剂有较大关系。不同的米种本身所含的生物胺差异较大,同时在酿造过程中使用不同的发酵剂也会使生物胺含量发生变化[12-13]。除此之外,黄酒中酪胺含量测定也与使用的分析手段有关,从文献[2,13-16]报道可知,黄酒中酪胺含量最低处于100 μg/L量级,最高约100 mg/L。
实验采用标准加入法测定黄酒样品中酪胺含量,向100 μL黄酒样品中分别加入900 μL的10、20、50、80、100 mg/L酪胺的乙腈-水溶液(1∶1,V/V),制备5组平行溶液,混匀后分别取2 μL不同浓度的混合液进行L2MS分析。为了保证在样品中仍能获得最优化的酪胺分子离子峰,实验延续使用对于黄酒样品的优化实验参数。在进行多组重复实验后,通过酪胺分子离子峰信号强度与加入不同酪胺浓度的线性关系对黄酒中的酪胺含量进行估算,示于图7。得到的黄酒实际样品中含有约68 mg/L酪胺,处于文献值[2]范围内,符合实际情况,可知该黄酒中的酪胺未达到对人体产生危害的含量(100 mg/L)。

图7 黄酒样品中酪胺分子离子峰信号强度与浓度的线性关系Fig.7 Intensity-concentration curve of tyramine in yellow rice wine sample
3 结论
建立了一种黄酒中酪胺的快速、高灵敏度的质谱检测方法,采用激光解吸/激光后电离质谱法结合标准加入法选择性检测复杂黄酒体系中的酪胺成分,该方法对酪胺的检出限可达32 μg/L,酪胺的分子离子峰信号强度与浓度具有良好的线性关系。结合标准加入法可以估算黄酒样品中酪胺含量约为68 mg/L,在安全食用范围内,不会对人体造成危害。
L2MS法具有高效、便捷的特点,在无需任何样品前处理的情况下,仍能对复杂体系中的关键组分进行高选择性检测,提高了分析效率,同时具备取样量少的特点。L2MS法也可以快速分析白酒、葡萄酒、酱油等含有生物胺的食品中酪胺含量,还可以用于食品中酪胺形成规律的探索,在食品安全领域有着广泛的应用前景。
[1] 汪建国. 黄酒中色、香、味、体的构成和来源浅析[J]. 中国酿造,2004,(4):6-10.
WANG Jianguo. Analysis of composition and source of color, aroma, taste, type in rice wine[J]. China Brewing, 2004, (4): 6-10(in Chinese).
[2] 宋颖,董全. 黄酒中生物胺的形成与控制研究进展[J]. 食品工业科技,2016,37(8):387-391.
SONG Ying, DONG Quan. Research progress in formation and control of the biogenic amine in Chinese rice wine[J]. Science and Technology of Food Industry, 2016, 37(8): 387-391(in Chinese).
[3] RIO B D, REDRUELLO B, LINARES D M, et al. The dietary biogenic amines tyramine and histamine show synergistic toxicity towards intestinal cells in culture[J]. Food Chemistry, 2017, (218): 249-255.
[4] 中华人民共和国卫生部,中国国家标准化管理委员会. GB/T 5009208—2008 食品中生物胺含量的测定[S]. 北京:中国标准出版社,2008.
[5] 曹利瑞,朱松,俞剑燊,等. 黄酒中9种生物胺的高效液相色谱分析法[J]. 食品科学,2016,37(4):103-107.
CAO Lirui, ZHU Song, YU Jianshen, et al. Development of an analytical method for nine biogenic amines in Chinese yellow wine by HPLC[J]. Food Science, 2016, 37(4): 103-107(in Chinese).
[6] JAMES W H, WALLACE S C. Two-laser photoionization supersonic jet mass spectrometry of aromatic molecules[J]. Anal Chem, 1988, (60): 5-10.
[7] TEMBREULL R, LUBMAN D M. Pulsed laser desorption of biological molecules in supersonic beam mass spectrometry with resonant two-photon ionization detection[J]. Anal Chem, 1987, 59(8): 1 082-1 088.
[8] REILLY J P, KOMPA K L. Laser induced multiphoton ionization mass spectrum of benzene[J]. The Journal of Chemical Physics, 1980, 73(11): 5 468-5 476.
[9] NING Y C. Interpretation of organic spectra[M]. Singapore: John Wiley & Sons (Asia) Pte Ltd, 2011: 105-106.
[10] GOSETTI F, MAZZUCCO E, GIANOTTI V, et al. High performance liquid chromatography/tandem mass spectrometry determination of biogenic amines in typical Piedmont cheeses[J]. Journal of Chromatography A, 2007, 1 149(2): 151-157.
[11] 胡鹏,罗凯,陈光静,等. 食品中生物胺的研究进展[J]. 食品与发酵工业,2012,38(12):124-128.
HU Peng, LUO Kai, CHEN Guangjing, et al. Progress in research on biogenic amines in foods[J]. Food and Fermentation Industries, 2012, 38(12): 124-128(in Chinese).
[12] 张凤杰,薛洁,王异静,等. 黄酒中生物胺的形成及其影响因素[J]. 食品与发酵工业,2013,39(2):62-68.
ZHANG Fengjie, XUE Jie, WANG Yijing, et al. The formation of biogenic amines in yellow rice wine and its influencing factors[J]. Food and Fermentation Industries, 2013, 39(2): 62-68(in Chinese).
[13] 张无疾,夏小乐,张斌,等. 黄酒前酵中生物胺生成规律的研究[J]. 现代食品科技,2015,(10):269-274.
ZHANG Wuji, XIA Xiaole, ZHANG Bin, et al. Patterns in the formation of biogenic amines in Chinese rice wine during primary fermentation process[J]. Modern Food Science and Technology, 2015, (10): 269-274(in Chinese).
[14] 彭金龙,胡健,张凤杰,等. 黄酒中生物胺的检测方法改进[J].中国酿造,2015,34(3):141-144.
PENG Jinlong, HU Jian, ZHANG Fengjie, et al. Improvement of biogenic amine detection method in Chinese rice wine[J]. China Brewing, 2015, 34(3): 141-144(in Chinese).
[15] 陆永梅,董明盛,吕欣,等. 高效液相色谱法测定黄酒中生物胺的含量[J]. 食品科学,2006,27(1):196-199.
LU Yongmei, DONG Mingsheng, LV Xin, et al. Biogenic amines contents in rice wine by HPLC[J]. Food Science, 2006, 27(1): 196-199(in Chinese).
[16] 华永有,周芬霞,林宏琳,等. HPLC-FLD法检测黄酒中9种生物胺[J]. 中国卫生检验杂志,2014,(6):761-764.
HUA Yongyou, ZHOU Fenxia, LIN Honglin, et al. HPLC-FLD method for determination of 9 biogenic amines in rice wine[J]. Chinese Journal of Health Laboratory Technology, 2014, (6): 761-764(in Chinese).
