人Izumo蛋白的二级结构及B细胞抗原表位预测①
2010-02-06刘凯军申子刚何海洋张巧玉吴玉章李晋涛
杨 霞 刘凯军 申子刚 何海洋 张 记 张巧玉 吴玉章 李晋涛
(第三军医大学全军免疫学研究所,重庆 400038)
人Izumo蛋白的二级结构及B细胞抗原表位预测①
杨 霞 刘凯军②申子刚 何海洋 张 记 张巧玉③吴玉章 李晋涛
(第三军医大学全军免疫学研究所,重庆 400038)
目的:预测人Izumo蛋白的二级结构及B细胞抗原表位。方法:以人Izumo基因序列为基础,按Chou-Fasman和Gamier-Robson方法预测其编码蛋白的二级结构,采用Karplus-Schulz方法预测Izumo蛋白骨架区的柔韧性;按Kyte-Doolittle方法预测其亲水性、Emini方法预测蛋白质表面可能性及Jameson-Wolf方法预测抗原性指数。结果:Chou-Fasman及Gamier-Robson两种方法预测的结果均表明,Izumo蛋白含较多的α螺旋,蛋白第 6~ 17、30~ 40、88~ 99、103~ 120、153~ 160、173~ 188、249~ 260、283~297、334~338和339~346区段可能是α螺旋中心,第21~25、198~200、245~248和320~323区段可能是β折叠中心。用Kyte-Doolittle、Emini和Jameson-Wolf方法分别对Izumo蛋白B细胞抗原表位进行预测结果表明,蛋白质第36~42、62~66、94~99、118~ 122、129~ 132、151~ 154、161~ 164、173~ 177、205~ 208、212~ 216、256~ 265、271~ 276、283~ 288、314~ 318 和 336~ 350区段附近很可能为B细胞表位优势区域。结论:该研究结果有助于确定Izumo蛋白的B细胞优势表位及发挥免疫避孕的活性部位。
人Izumo蛋白;二级结构;B细胞优势表位
Izumo蛋白特异表达于精子表面,定位于精子头部[1]。在新鲜精子的表面检测不到Izumo蛋白的表达,发生顶体反应以后在小鼠和人类精子的表面能检测到Izumo蛋白的表达并且精子可育[2]。正常情况下,只有发生了顶体反应的精子才能被Izumo抗体着色[3]。推测Izumo蛋白可能不是定位在新鲜精子质膜上而是隐藏在质膜下,顶体反应发生以后才暴露出来。同源重组技术敲除的Izumo-/-雌鼠生育正常;Izumo-/-雄鼠生长健康,交配、射精行为正常;精子发育正常,运动力及迁移能力没有影响,但精子不育。进一步的研究表明Izumo-/-雄鼠精子能与去除卵透明带的卵子质膜结合,但不能和卵子融合[2]。
目前的研究结果表明,Izumo蛋白可望成为新型男性免疫避孕的靶抗原。本研究在已获得Izumo氨基酸序列的基础上,运用计算机技术和分子生物学软件对Izumo蛋白质二级结构和B细胞抗原表位进行分析和预测,为确定Izumo蛋白B细胞优势表位及发挥免疫避孕的活性部位和制备Izumo蛋白单克隆抗体提供参考资料。
1 材料与方法
1.1 Izumo氨基酸序列选择 选取来自人源睾丸组织的Izumo蛋白(由基因序列推导)共有350个氨基酸残基,相对分子质量为39 kD,等电点为6.35。检索自NCBI数据库,基因登录号为BC034769,具体序列见图1。
1.2 Izumo蛋白的二级结构及柔性区域的预测 应用DNAStar Protean软件提供的模块进行,采用Chou-Fasman方法通过序列氨基酸残基的晶体结构来预测二级结构;采用Gamier-Robson方法通过计算特定氨基酸残基在特定结构内部的可能性来分析预测Izumo蛋白的二级结构。采用Karplus-Schulz方法对Izumo蛋白骨架区的柔韧性进行分析。
1.3 Izumo蛋白的B细胞表位预测 应用DNAStar Protean软件进行,采用Kyte-Doolittle方法的氨基酸亲水性标准,预测其亲水性;采用Emini方法预测蛋白质的表面可能性;以及采用Jameson-Wolf方法预测抗原性指数。
2 结果
2.1 Izumo蛋白二级结构预测 用Chou-Fasman方法预测Izumo蛋白二级结构,发现其形成许多α螺旋,位置分别在第 6~17、30~ 40、44~ 73、79~ 83、88~ 99、103~120、131~ 134、153~ 161、173~ 188、215~221、254~262、283~298、334~338和 339~ 346区段。预测结果也显示在分布区段上α螺旋与β折叠交叉分布,在各β折叠单元之间存在丰富的转角结构(图2)。采用Gamier-Robson法预测Izumo蛋白二级结构,同样发现其形成大量α螺旋,位置分别在第3~21、25~ 85、87~ 100、101~ 132、141~ 150、153~160、169~190、207~ 219、225 ~ 228、230 ~ 233、249~260、271~276、283~297、299~320和 332~ 350区段。用该方法预测的β折叠结构较Chou-Fasman方法预测的数量要少。在各α螺旋单元之间存在长短不一的转角和无规则卷曲结构(图3)。
综合Chou-Fasman和Gamier-Robson两种方法预测的结果,Izumo蛋白含较多的α螺旋,该蛋白第6~17、30~ 40、88 ~ 99、103~ 120、153 ~ 160、173~188、249~260、283~ 297、334~338和339~ 346区段可能是α螺旋中心。Izumo蛋白第21~25、198~200、245~248和320~323区段可能是β折叠中心。

图1 人Izumo氨基酸序列Fig.1 Am ino acid sequence of Izumo in Homosapiens

图2 Chou-Fasman方法预测Izumo蛋白二级结构Fig.2 The secondary structure of Izumo protein predicted by Chou-Fasmanmethods

图3 Gamier-Robson方法预测Izumo蛋白二级结构Fig.3 The secondary structure of Izumo protein predicted by Gam ier-Robson methods
2.2 Izumo蛋白骨架区的柔性分析 Izumo蛋白骨架区含有较多的柔性区域,主要集中在蛋白第33~42、62~ 66、79 ~ 87、92~ 105、118~ 122、136 ~ 138、152~ 155、166~ 169、173 ~175、189~ 195、203~ 221、223~ 230、236~ 243、258 ~266、268~ 280、281~ 287、322~326和330~348区域(图4)。这些区域可能具有一定的柔韧性,发生扭曲、折叠的几率较高,形成表位的可能性较大,容易与抗体进行嵌合。由于Izumo是一种具有组织特异性表达的分子,在精卵结合发生顶体反应的时候特异表达,抗Izumo抗体可直接阻断精卵融合,从而发挥免疫避孕功能。
2.3 Izumo的亲水性分析 按Kyte-Doolittle的氨基酸亲水性标准分析Izumo的亲水性,预测结果表明Izumo蛋白分子Izumo亲水性区域的分布不均匀,主要密集在中部和C末端,尤其以中部亲水性最高,亲水性较高区域为第 36~77、82~108、116~124、128~ 139、149~176、184~220、223 ~239、257~ 270、272~276、278~290、313~320和334~350区段(图5)。这些亲水性区域暴露于蛋白表面的几率较大,成为抗原表位的几率也较大。
2.4 Izumo蛋白的表面可能性分析 采用Emini方法对Izumo蛋白的表面可能性进行了分析。结果显示Izumo蛋白的氨基酸表面可能性较大的区域主要是第36~40、48~ 52、93~ 99、117~ 124、129~ 133、204~ 208、212~ 219、227 ~ 231、257~ 264、271 ~ 276、283~289、313~318和 335~350区段,其它区段展示的表面可能性较小或表现为负值(图6)。表明表面可能性较高区域呈现在Izumo分子表面,而表面可能性较低区域,即埋藏于分子内部的区域。
2.5 Izumo抗原指数分析 采用Jameson-Wolf方法分析 Izumo蛋白潜在的抗原表位位点,结果显示Izumo蛋白质分子第 35~42、45~67、69~75、79~89、92~108、117 ~ 123、129 ~ 141、149 ~ 182、189~198、203~209、210 ~ 220、223~ 244、256~280、283 ~292、313~322和 330~350区段抗原指数较高(图7),提示这些区段含有潜在优势抗原表位。

图4 Izumo的柔性区域Fig.4 Flexib le regions of Izumo protein

图5 Izumo蛋白的亲水性分析Fig.5 Hyd rophilicity analysis of Izumo protein
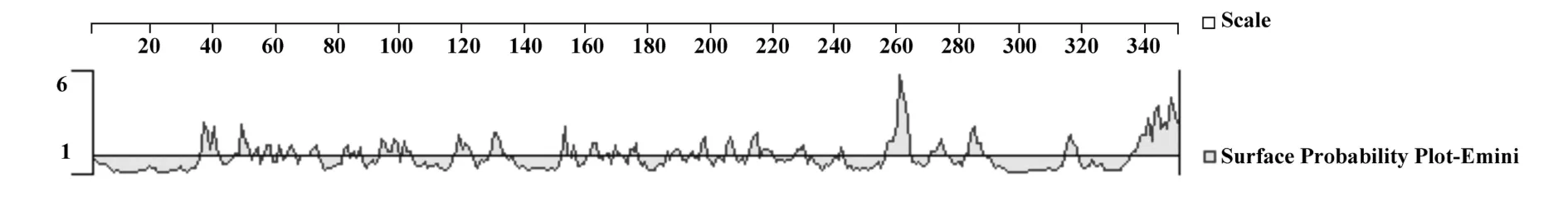
图6 Izumo蛋白表面可能性区域Fig.6 Surface probability regions of Izumo protein
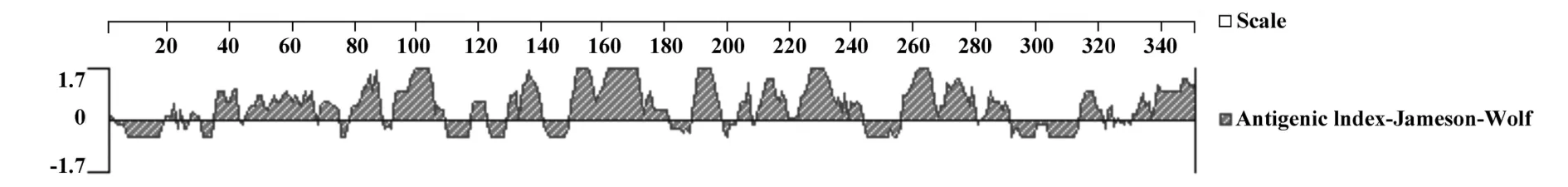
图7 Izumo蛋白抗原指数分析Fig.7 Antigenic index of Izumo protein
3 讨论
当前研发男性免疫避孕疫苗,进行抗生育研究的靶标分子主要有两方面:①精子表面在受精过程中发挥作用的蛋白;②参与精子与卵细胞表面卵透明带结合的蛋白。目前针对精子特异表达分子的研究主要有 LDH-C4 、FA-1、SP10、SP17、PH-20、PH-30、(SAMP)32、ADAM、CD9、YLP12等[4],但它们大部分抗生育效率不高。其中睾丸特异表达分子Eppin的研究成果向生育学家展示出诱人的魅力,重组Eppin免疫雄猴使78%的雄猴产生高滴度的特异抗体并出现不育症,免疫停止后能恢复育性[5,6]。目前的研究都还仅仅只停留在动物模型研究上,尚没有一种真正可用于临床的安全、长效、可逆的男性避孕抗原问世。
Izumo是目前唯一报道的精子膜蛋白,为免疫球蛋白超家族Ⅰ型膜蛋白新成员,含一个糖基化位点的胞外免疫球蛋白域,在2005年由日本学者Inoue等命名并首次报道。研究表明Izumo蛋白的糖基化位点对于Izumo蛋白发挥功能不是必需的[7]。在动物受精过程中,精子与卵子相遇、识别对方,并融合形成一个新的生命体。Izumo蛋白在发生顶体反应后,精子和卵子融合过程中发挥重要作用[8],可见Izumo蛋白为控制生育提供了理想的靶标,成为人类避孕领域关注的新焦点。研究者预言,运用RNAi技术可以开发出Izumo长效避孕的方法,在睾丸中注射Izumo双链RNA(从睾丸中分离获得IzumomRNA而来),抑制睾丸中Izumo蛋白的表达量从而可以达到男性长效避孕。此外,通过注射Izumo单抗,抗原与抗体结合抑制精卵结合从而达到短期避孕。体外研究的结果表明鼠Izumo抗体能阻止精卵融合,但体内研究显示鼠Izumo抗体并不影响小鼠生育[9]。进一步的研究表明,Izumo抑制小鼠试管受精生育率及交配率是依赖于剂量效应[10]。Izumo蛋白真正成为高效的免疫避孕靶抗原尚需进一步研究。
抗原的特异性主要由其特定的表位来体现,抗原的研究也正在由天然大分子向亚单位、表位多肽过渡。一个理想的疫苗应该是屏蔽病理、劣势、非中和的表位,多个优势、中和性表位的组合。研究蛋白的二级结构并预测B细胞优势抗原表位,对于进一步探索蛋白的活性功能具有重要作用。2008年本课题组预测出Eppin优势中和性B细胞表位,体外动物实验表明75%所预测的潜在表位位点能与抗血清结合[11]。进一步的研究表明,动物实验筛选出优势表位抗原肽均能使雄性小鼠体内产生高滴度抗体,但并非所有筛选出的优势表位抗原肽均能产生较好的抗生育效能[12]。由此可见,蛋白二级结构及B细胞抗原表位预测的结果为蛋白活性部位发挥功能提供研究靶标位点,但是抗原发挥活性的表位尚需与深入的蛋白功能验证相结合才能确定。目前全世界Izumo蛋白抗生育的研究正如火如荼地进行,但尚少见Izumo表位成功预测及鉴定的报道。
本研究运用目前发展成熟的分子生物学软件对Izumo的二级结构和表位特性,如亲水性、柔韧性、表面可能性及抗原指数等方面进行分析,成功预测其B细胞抗原表位。结果表明Izumo存在多个潜在的抗原表位位点,蛋白第 36~42、62~66、94~99、118~ 122、129~132、151 ~154、161~ 164、173~ 177、205~ 208、212~216、256 ~265、271~ 276、283~ 288、314~318和336~350区段附近可能为B细胞表位优势区域。其优势表位的确证在进一步研究中。
1 Yamashita M,Yamagata K,Tsumura Ketal.Acrosome reaction ofmouse epididymal sperm on oocyte zona pellucida[J].JReprod Dev,2007;53:255-262.
2 Inoue N,Ikawa M,Isotani Aetal.The immunoglobulin superfam ily protein Izumo is required for sperm to fusewith eggs[J].Nature,2005;434:234-238
3 Sun X,Wang H,Okabe Metal.Genetic loss of faah comprom isesmale fertility inm ice[J].Biol Reprod,2008;5:1-21.
4 Naz RK.Antisperm immunity for contraception[J].Journal of Andrology,2006;27(2):153-159.
5 Richardson R T,Sivashanmugam P,Hall Setal.Cloning and sequencing of human Eppin:a novel fam ilyofprotease inhibitorsexpressed in theepididym isand testis[J].Gene,2001;270:93-102.
6 O'Rand M G,Widgren E E,Sivashanmugam Petal.Reversible immunocontraception inmalemonkeys immunized with eppin[J].Science,2004;306(5699):1189-1190.
7 Inoue N,Ikawa M,Okabe M.Putative sperm fusion protein IZUMO and the role of N-glycosylation[J].Biochem Biophys Res Commun,2008;377:910-914.
8 Yamashita M,Honda A,Ogura Aetal.Reduced fertility ofmouse epididymal sperm lacking Prss21/Tesp5 is rescued by sperm exposure to uterinem icroenvironment[J].Genes to Cells,2008;13:1001-1013.
9 Wang D,Huang T,Xie Qetal.Investigation of recombinantmouse sperm protein izumo as a potential immunocontraceptive antigen[J].Am J Reprod Immunol,2008;59:225-234.
10 Wang M,Lv Z,Shi Jetal.Immunocontraceptive potential of the Ig-like domain of Izumo[J].Mol Reprod Dev,2009;76(8):794-801.
11 李晋涛,陈正琼,梁志清etal.Eppin抗原的二级结构分析B细胞表位预测[J].第三军医大学学报,2008;30(24):2254-2257.
12 Chen Z,HeW,Liang Zetal.Protein prime-peptideboostasanew strategy induced an Eppin dominant B-cell epitope specific immune response and suppressed fertility[J].Vaccine,2009;27(5):733-740.
[收稿2009-05-10 修回2009-07-16]
(编辑 倪 鹏)
Prediction of the secondary structure and B cell epitopes for the Izumo p rotein of Homo Sapiens
YANGXia,LIUKai-Jun,SHENZi-Gang,HEHai-Yang,ZHANGJi,ZHANGQiao-Yu,WUYu-Zhang,LIJin-Tao.InstituteofImmunology,theThirdMilitaryMedicalUniversity,Chongqing400038,China
Objective:To predictand analyze the secondary structure and B cell epitopes of Izumo protein.Methods:The secondary structure and flexible regions of Izumo protein were predicted by themethods of Chou-Fasman,Gam ier-Robson and Karplus-Schulz.Moreover,hydrophilicity plot,surface probability plot and antigenic index of Izumo protein were predicted by themethods of Kyte-Doolittle,Emini and Jameson-Wolf,respectively.Results:Izumo protein containedmoreαhelix regions.Therewere several centersofαhelix in the regions of6-17,30-40,88-99,103-120,153-160,173-188,249-260,283-297,334-338 and 339-346 of Izumo p rotein,and several centers ofβsheet in the regions of21-25,198-200,245-248 and 320-323.Moreover,many distinct B cell epitopesin Izumo protein possibly localized in the regionsof 36-42,62-66,94-99,118-122,129-132,151-154,161-164,173-177,205-208,212-216,256-265,271-276,283-288,314-318 and 336-350.Conclusion:These results are helpful for identification of the dominant B cellepitopes and the functional domains of Izumo protein.
Izumo protein;Secondary structure;B cell epitopes
R392.11
A
1000-484X(2010)01-0037-04
①本文受国家自然科学基金(30571708)、“十一五”国家科技支撑计划(2006BAI03B12)资助
②为共同第一作者
③解放军总医院第二附属医院妇产科,北京100091
杨 霞(1979年-),女,博士,讲师,E-mail:oceanyx@126.com;
及指导教师:李晋涛(1970年-),女,博士,副教授,主要从事病毒免疫学研究,E-mail:ljtqms@yahoo.com.cn。