H1N1亚型流感病毒血凝素Th和B细胞表位预测及抗原性分析①
2010-02-06王开艳李太元鲁会军南文龙田明尧张金双金宁一
王开艳 李太元 鲁会军 谭 磊③ 南文龙③ 田明尧③ 张金双③ 刘 昊 金宁一⑤
(延边大学农学院,龙井 133400)
H1N1亚型流感病毒血凝素Th和B细胞表位预测及抗原性分析①
王开艳 李太元 鲁会军②谭 磊②③南文龙②③田明尧②③张金双②③刘 昊④金宁一②⑤
(延边大学农学院,龙井 133400)
目的:应用生物信息学方法预测H1N1亚型流感病毒血凝素Th和B细胞相关抗原表位,并初步分析其抗原性,为研制H1N1亚型流感病毒的表位疫苗奠定基础。方法:依据近年流感病毒流行趋势,从GenBank下载具有代表性的H 1N1亚型流感病毒HA蛋白氨基酸序列。进行生物信息学综合分析预测,获得Th和B细胞相关抗原表位,并比较其保守性和特异性。通过Balb/c小鼠H 1N1亚型流感病毒阳性血清与表位肽的结合试验,初步鉴定候选表位抗原性。结果:综合多项预测及空间构像模拟结果,我们获得了三条候选Th和B细胞表位,分别为HA73~87、HA125~139、HA188~205。候选表位处于H 1N1亚型流感HA1蛋白序列上相对保守的区域内,且与目前流行的H 1N1亚型流感病毒HA相应区域具有较好的一致性。而不同候选表位在BALB/c小鼠H 1N1亚型流感病毒阳性血清反应中显示了不同抗体结合能力,预示了其成为功能表位的可能。结论:所筛选的表位具有成为H1N1亚型流感病毒HA Th和B细胞相关抗原表位的可能。此研究为深入揭示流感病毒感染与免疫机制,H1N1亚型流感功能表位认知及表位疫苗研究奠定了基础。
流感;血凝素;H 1N1;抗原表位
①本文受“863”重大项目(2006AA10A 205)和科技支撑项目(2006BAD06A05)资助
②军事医学科学院军事兽医研究所,长春130062
③吉林大学畜牧兽医学院,长春130062
④云南农业大学动物科技学院,昆明650201
⑤通讯作者,E-mail:ningyik@126.com
流感是由流感病毒引起的急性呼吸道传染病,也是第一个实行全球性监控的疾病,甲型流感病毒曾引起了多次大范围的流行,包括1918~1919年的西班牙流感(H1N1),1957年的亚洲流感(H2N2),1968年的香港流感(H 3N2)和1977年的俄国流感(H1N1),每次大流行都造成了巨大的人力资源和物力资源的损失[1]。2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感疫情,截至北京时间7月1日22时,世界卫生组织确认全球117个国家和地区共有70893例甲型H1N1流感确诊病例,其中包括死亡病例311例。由于流感病毒抗原型的不断改变,研究者迫切希望能找到一种可提供交叉保护性的通用疫苗,以达到“one dose for all”的免疫效果。解决这一问题的途径之一是研制表位疫苗,由于表位基因易于改造和操作,对于如流感病毒等易发生抗原漂移和变异的病原体则可通过随时监视和及时改构来实现对变异毒株传播的控制。表位疫苗的另一优势还在于通过选择最佳和最具免疫保护潜力的表位以诱生特异性免疫应答,减少了无关、干扰和抑制序列可能产生的副作用。
表位(epitope)又称抗原决定簇(antigenic determinant),是抗原特异性的特殊化学基团,即抗原分子表面与抗体及T、B淋巴细胞特异性结合的部位。B细胞表位可以诱导机体产生保护性抗体并介导体液免疫应答反应。Th细胞表位可以激活CD4+效应T细胞执行重要的免疫调节功能。上述两种类型的表位既是流感功能表位研究,也是流感表位疫苗开发的基础[2]。筛选和鉴定出相应的流感功能表位对于深入揭示流感病毒感染与免疫机制,流感功能表位的认知、表位疫苗的研究具有重要的理论和实践价值。因此,本研究采用生物信息学方法对H1N1亚型流感病毒的主要抗原—血凝素(hemagglutinin,HA)的氨基酸序列进行了分析,预测了其HA的Th和B细胞抗原表位,并初步分析了其抗原性。
1 材料与方法
1.1 材料
1.1.1 基因序列的选择 选取近年来流行且具有代表性的H1N1亚型流感病毒株,从NCBI(http://www.ncbi.nlm.nih.gov)上下载获得相关毒株的HA基因序列。
1.1.2 序列分析软件 生物信息学MHCII类分子预测软件:采用网络服务器SYFPEITHI(http://syfpeithi.bmi-heidelberg.com)和Multipre(http://antigen.i2r.a-star.Edu.sg)。生物信息学B细胞表位预测软件:采用网络服务器 PREDICTED ANTIGENIC PEPTIDES,Bcep red(http://www.intech.res.in/raghava/bcepred)和生物分子模拟软件InsightII(Accelrys,2005)。
1.1.3 主要试剂、病毒及血清 辣根过氧化物酶(HRP)标记羊抗鼠IgG购自中杉金桥生物技术有限公司。表位多肽由上海华大天源生物技术有限公司合成,纯度大于90%,并与BSA偶联。流感病毒A/NewCaledonia/20/99(H1N1)由本室保存。6周龄Balb/c小鼠,雌性若干,体重16~18克,购自长春生物制品研究所。
1.2 方法
1.2.1 HA序列 下载近年流行且具有代表性的H1N1亚型流感病毒HA蛋白氨基酸序列。参考序列Genbank登录号包括BAH79801.1,BAH79799.1,BAH79802.1,BAH79798.1,ACS71633.1,ACS716311,ACR83596.1,BAH79796.1,ACI32737.1,ACS71627.1等。
1.2.2 表位预测 Th表位预测采用网络服务器SYFPEITHI和MULTIPRED。主要对人类白细胞抗原DRB1(HLA-DRB1)等位基因 *04、HLA-DRB1*07、HLA-DRB1*08、HLA-DRB1*11、HLA-DRB1*13、HLA-DRB1*15限制性Th细胞表位进行预测,并综合参考其他HLA-DR亲和力评分。B细胞表位预测采用网络服务器Bcepred和PREDICTED ANTIGENIC PEPTIDES对线性B细胞表位进行预测。所有预测优先筛选位于HA主要抗原区HA1上的表位。之后,汇总各项表位预测结果,以Th表位预测为基础,使预测表位区尽量覆盖与B细胞表位预测交集区,以获得兼有Th与B细胞表位功能的预测表位。
1.2.3 确定细胞表位 通过PDB(http://www.rcsb.org/pdb/home/home.do)下载H1亚型流感HA蛋白分子构像,应用InsightII软件进行分子建模,分析候选表位空间构像。排除位于α-螺旋和β-片层不易形成表位的序列,将位于转角、无规则卷曲处且表面暴露好的序列确定为候选细胞表位。将候选表位序列与已发表的HA蛋白序列比较,分析其保守性和特异性(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。最后,综合各项结果确定细胞表位。
1.2.4 H 1N1亚型流感阳性和阴性血清的检测 采用本室保存的A/NewCaledonia/20/99(H1N1)流感病毒以5×104TCID50肌肉注射BALB/c小鼠15只,7天后处死,眼眶放血收集血清。并收集10只未攻毒健康BALB/c小鼠血清作为阴性对照。所获得的BALB/c小鼠血清,以HI方法判定效价。
1.2.5 候选表位抗原性分析 BSA偶联多肽(20 μg/ml)4℃过夜包被ELISA板,次日置于含5%脱脂乳的Tris盐缓冲液中封闭1小时。每孔加入各实验BALB/c小鼠(1∶40倍稀释),37℃温育1.5小时。PBS洗涤5次后,加入HRP标记羊抗鼠IgG(1∶2 000倍稀释),37℃温育1.5小时。PBS洗涤5次后,加入OPD显色液,37℃避光显色15分钟后终止,492 nm处测定各孔吸光值。计算阳性血清与阴性血清OD比值,组间差异统计用SPSS15.0软件进行单向方差分析。
2 结果
2.1 Th和B细胞表位综合分析 综合各项分析结果,本研究获得了三条候选Th和B细胞表位,分别为H1HA73~87TESWSYIVETPNPEN 、H1HA125~139NHT VTGVSASCSHNG 、H1HA188~205RALYHTENAYVSVVSSHY。SYFPEITHI软件是根据特定肽的锚定残基和辅助残基位置的氨基酸类型来评分的。根据SYPEITHI对亲和能力打分,所筛选的表位分值与排名均靠前,符合成为潜在Th表位的标准。而所筛选的表位MHC限制性主要参考了中国人群中多数人所具有MHC类型,以使预测的表位具有更好的人群覆盖能力。SYFPEITHI结果显示(如表1),候选表位可与多种HLA-DR限制性分子具有较好的结合能力。
通过Multipre方法对Th表位进行了预测,分值范围为从1~9分,其中8~9表示预测表位与相应MHC具有较高亲和力,6~7表示中等亲和力,4~5表示亲和力较低。综合MULTIPRED方法预测结果显示(如表2),候选表位得分靠前,其大部分与相应MHC类型具有中等及以上亲和力,处于能与多种HLA-DR限制性分子结合的“热区”。两者综合说明所选表位可为多种HLA-DR限制性分子递呈,具有成为Th细胞表位的可能。
PREDICTED ANTIGENIC PEPTIDES预测结果显示(见图1),序列中共有23个抗原决定簇,而预测的表位H1HA73~87TESWSYIVETPNPEN 、H1HA125~139NHTVTGVSASCSHNG 、H 1HA188~ 205 RALYHTENAYVSVVSSHY均处于或包含抗原决定簇区域。
Bcepred预测时参数Hydrophilicity、Accessibility、Flexibility 、Antigenicity 、Polarity 、Exposed surface 、Turns的临界值分别设定为 1.9、2.0、1.9、2.4、2.3、1.8、1.9。表中着重标出了预测表位覆盖的参数区域(如表3)。综合分析结果显示,所筛选的表位综合评价靠前,具有成为B细胞表位的可能。
2.2 分子构象模拟及序列比较分析 通过InsightII软件模拟HA分子于病毒表面形成的三聚体形式,黄色区域为候选表位区,见图2,分析显示,候选表位区结构主要为无规则卷曲和转角,含少量β-片层结构,无α-螺旋结构,表面暴露性较好。结果说明候选表位在蛋白分子构象上符合表位设计要求,易于形成功能表位。保守性比较发现,预测获得的表位均处于H1N1亚型流感HA1蛋白序列上相对保守的区域内。特异性分析表明,Genbank中已登录的2006~2009年H1N1亚型流感分离株尤其是亚洲地区分离株均含有该表位序列。
2.3 H1亚型流感阳性和阴性血清的检测 经HI方法判定,所获得BALB/c小鼠H1N1亚型流感病毒阳性血清效价为 27.33±1.62,而阴性血清未见 HI效价。
2.4 候选表位抗原性分析 通过间接ELISA的方法,以预测的H1亚型流感ThB候选表位多肽包被ELISA板,再分别用Balb/c小鼠源的H1亚型流感阳性和阴性血清进行其反应性分析(表4)。结果显示,各候选表位均阳性血清表现了显著的反应性,其中表位HA188~205与阴性对照反应性差异显著(P<0.05),HA125~139和 HA73~87与阴性对照反应性差异极显著(P<0.01)。从P/N比值分析,其血清结合能力 HA73~87(1.52)和 HA125~139(1.52)>HA188~205(1.45)。结果证实,H1亚型流感阳性血清中存在着可与表位多肽结合的抗体组分,可推断所筛选的表位具有成为功能表位的潜能。

表1 候选表位SYFPEITHI分析结果Tab.1 Analysis of the candidate epitopes with SYFPEITHI
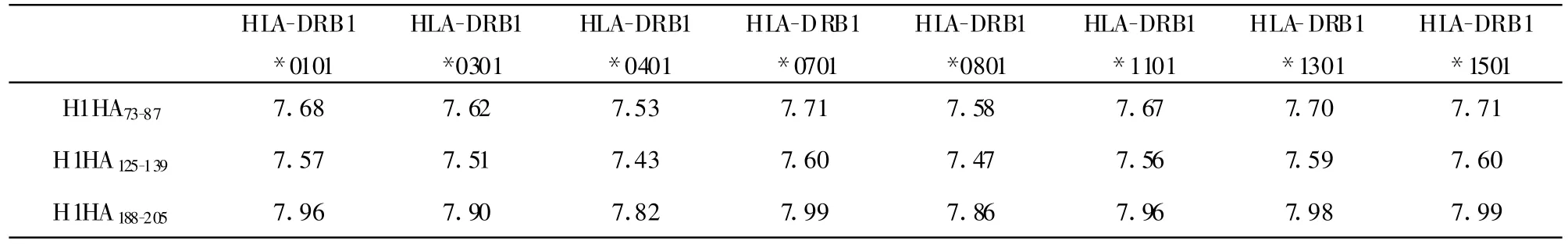
表2 候选表位MULTIPRED(HMM)分析结果Tab.2 Analysis of the candidate epitopes with MULTIPRED(HMM)
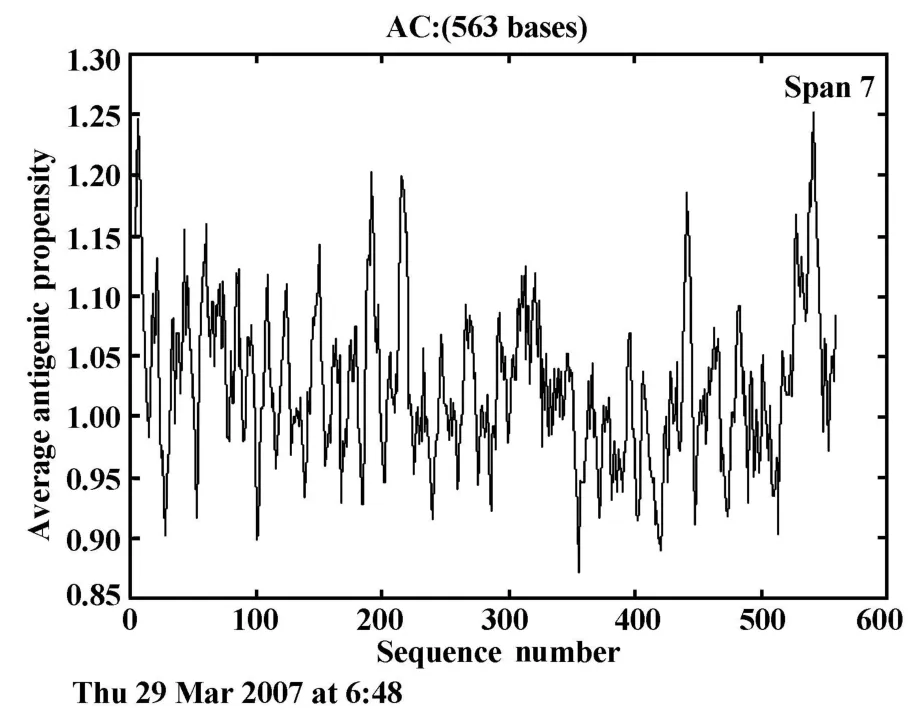
图1 H1HA抗原肽分析Fig.1 Analysis of antigenic peptides

图2 H1HA候选表位空间的构像模拟Fig.2 Conformation stimulation of H1HA candidate epitopes
3 讨论
流感是一种严重的呼吸道疾病,目前临床使用的大部分疫苗是灭活疫苗,这类疫苗无法有效克服流感病毒表面蛋白的频繁变异给疫苗研制带来的困难。在以使用灭活疫苗为主的大背景下,各大疫苗公司及研究单位纷纷进行着种种新型疫苗的探索,尤其是表位疫苗和DNA疫苗,由于具有常规流感疫苗无法比拟的巨大优势,它弥补了传统疫苗的一些不足,尤其在诱导细胞免疫方面,通过选择正反应表位避免副反应表位,减少了疫苗毒副作用,提高了安全性,增强了免疫针对性。在流感表位疫苗的研究中,以表位为基础的疫苗研究主要包括:合成肽疫苗、重组抗原表位亚单位疫苗、多表位串联DNA疫苗等形式。目前,表位疫苗已得到应用,国外已经有以A型流感病毒HA蛋白的T和B细胞识别表位联和制成的合成肽疫苗可以保护鼠的致死性感染的报道[3]。Hua等人以E.coli表达H3HA三个中和表位HA183~195、HA127~133、HA92~105的重组多表位肽免疫了兔和小鼠,并产生了高滴度的中和抗体[4]。Thomson等以一个真核质粒表达了10个CTL抗原表位,采用这样的质粒免疫鼠后,发现这些表位诱导了较强的CTL应答并可清除感染的病毒[5]。H3亚型流感病毒血凝(Hemagglutinin,HA)基因127~133高度保守,且HA晶体结构显示HA 127~133表面是环状的,对宿主结合位点是关闭的。研究发现流感病毒A/Aichi/2/68(H3N2)的HA 127~133可被引入到46位携带苯丙氨酸(F),54位携带丙氨酸(A)的p43~58中,其43~46及54~58位残基仍具结合MHC-Ⅱ能力。因此推测抗此位点的抗体很容易产生且能中和病毒的传染性,可作为制作多肽疫苗的潜在表位。Ogasawara等[6,7]检测了46F/HA 127~133/K54A对T细胞的免疫原性,滴鼻接种2周后可保护小鼠免受H3N2流感病毒的感染。南文龙等[8]对禽流感H5N1亚型的Th和B表位进行了共预测及抗原性分析,获得了三条候选Th和B细胞表位,分别为HA141-155、HA206-223、HA302-316,且具有良好的抗原性 。
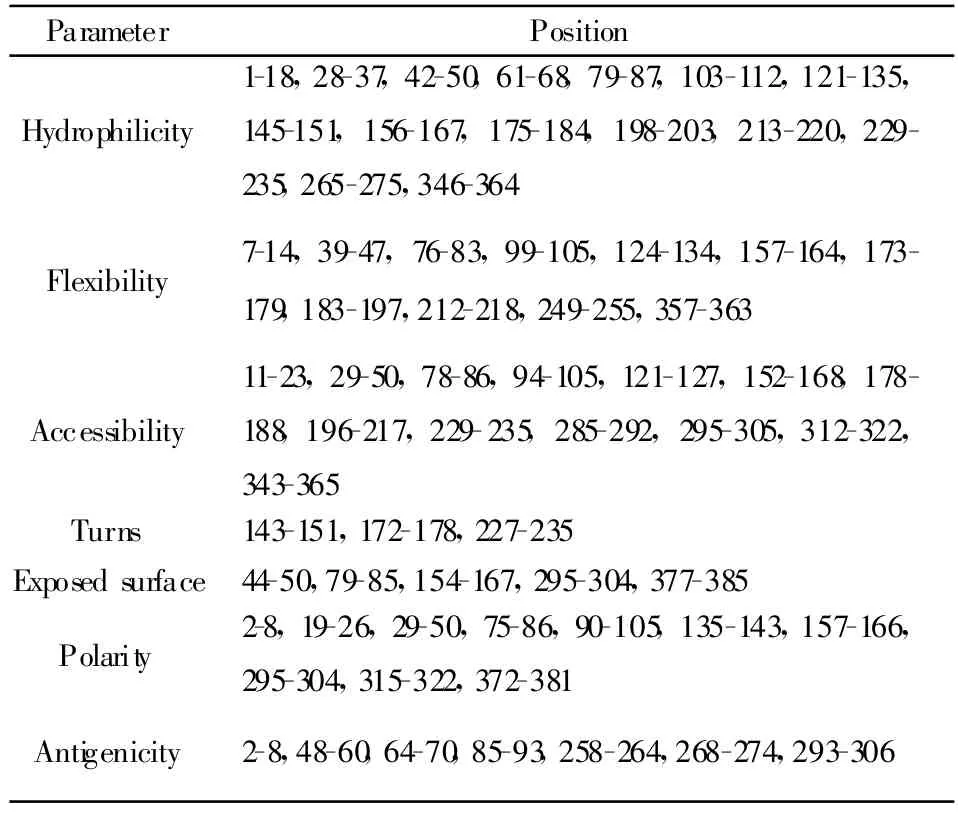
表3 候选表位Bcepred分析结果Tab.3 Analysis of the candidate epitopeswith Bcepred

表4 H1N1亚型流感Th/B候选表位血清反应分析Tab.4 Serum reaction analysis of H1N1 HA Th/B epitopes
研究表明,采用免疫信息学辅助方法,可以使发现新表位的效率提高10~20倍,减少95%的实验工作量,可节约大量研究经费并大大地加快新表位的发现[9]。T细胞表位预测对于研究细胞免疫机理、过程以及研制多肽疫苗和基因疫苗等具有重要的意义。SYFPEITHI是基于已知的能和MHCⅡ类分子结合槽结合的Th细胞表位所建立的网络平台,实验证明应用此平台预测的特定蛋白Th细胞表位所合成的肽段在体内和体外实验都能产生预期的结果,说明该平台对Th细胞表位的预测具有一定的可信度[10,11]。Multipre主要采用支持向量机法(Support Vector Machine,SVM)、人工神经网络法(Artificial neural networks,ANNs)、因子隐Markov模型法(Hidden Markov ModelMethod,HMM)进行CTL表位的预测。PREDICTED ANTIGENIC PEPTIDES主要对针对蛋白抗原性进行分析,采用Kolaskar建立的预测方法,预测可能刺激机体产生抗体反应的抗原肽,准确率达75%。B细胞表位预测,不仅有助于基础免疫学研究,而且也有助于疫苗和抗体的研究与开发,代表软件有PEOPLE、BEPITOPE、Bcepred等[12,13],但是基于上述度量性质的表位预测,预测准确度一般低于60%,难以令人满意。因此,如何提高预测的准确度和预测方法的普遍性是未来研究的方向。在本实验中,我们应用多款不同网络服务器的不同算法进行了表位的筛选,尽可能使获得表位在各种预测软件中都能得到“认可”。此外,我们在Th和B细胞表位预测的过程中,基于其实现功能的机制,引入了两种表位共预测的设想,也可以从另一个角度来提高表位的预测准确率。
本研究以H1N1亚型禽流感HA为模型尝试对Th和B细胞相关表位共预测。研究获得了三条Th和 B 细 胞 相 关 表 位 ——HA73~87、HA125~139、HA188~205,并以BALB/c小鼠H1N1亚型流感阳性血清进行了候选表位抗原性分析。为了使预测的表位具有较好的人群通用性,Th表位预测的HLA限制性类型上,选择了以中国人群抗原频率较高的HLADRB1*08、HLA-DRB1*11、HLA-DRB1*04、HLADRB1*07、HLA-DRB1*13、HLA-DRB1*15 为主[14]。B细胞表位的选择上,我们综合了各项单参数预测结果并结合了蛋白三级结构模拟分析,来提高预测准确性。虽然候选表位在某些单参数预测结果中分数相对较低,但综合评价均靠前。
体液免疫主要通过B细胞产生抗体发挥效应,而其功能受Th细胞的调节。B细胞本身又可以通过BCR捕获抗原,并行使APC细胞作用向Th细胞递呈抗原多肽而活化Th细胞。根据流感病毒免疫应答的特点及免疫保护机制,我们对多亚型(H1)流感病毒HA 1上的B和Th细胞表位进行了共筛选。我们期望通过筛选获得特异性诱导良好体液免疫功能的抗原表位,最好能兼有Th和B细胞表位功能,对于细胞免疫水平有待进一步研究。因此,本研究以BALB/c小鼠为哺乳动物模型,分析了候选表位抗原性。结果初步验证了候选表位的抗原性,预示了其成为 功 能 表 位 的 可 能,提 示 HA73~87、HA125~139、HA188~205可能为小鼠H1N1亚型流感功能表位。其结果为进一步H1N1亚型流感HA功能表位的鉴定及新型表位疫苗的设计和应用打下了基础。
1 Steiohauer D A,JSkehel.Genetics of infiuenza viruses[J].Annu Rev Genet,2002;36:305-32.
2 Tamura S,Tanimoto T,Kurata T.Mechanisms of broad cross-Protection provided by influenzavirus infection and theirapplication to vaccines[J].J Infect Dis,2005;58:195-207.
3 Jana SR,Zhong Yun,Philip R et al.Protection ofm ice against lethalviral infection by synthetic peptides corresponding to B-and T-cell recognibon sites of immuenza A hemagglutinin[J].Vaccine,1995;13:927-932.
4 Li H,Ding J,Chen Y H.Recombinant protein comprisingmulti-neutralizing epitopes induced high titer of antibodies against influenza A virus[J].Immunobiol,2003;207(5):305-313.
5 Thomson S A,Sherritt M A,Medveczky J et al.Delivery ofmultiple CD8 cytotoxicT cell epitopes by DNA vaccination[J].Immuno,1998;160:1717-1723.
6 Ogasawara K,Naruse H,Itoh Y.A strategy formaking synthetic peptide vaccines[J].Proc NatlAcad SciUSA,1992;89(19):8995-8999.
7 Ninomiya A,Ogasawara K,Kajino K et al.Intranasal adm inistration of a synthetic peptide vaccine encapsulated in liposome togetherwith an anti-CD40 antibody induces protective immunity against influenza A virus in mice[J].Vaccine,2002;20(25-26):3123-3129.
8 南文龙,金宁一,鲁会军 et al.H5N1亚型禽流感病毒血凝素Th和B细胞表位预测及抗原性分析[J].中国免疫学杂志,2009;25(7):630-634.
9 De GrootA S,SbeiH,Aubin CS et al.Immuninformatic:mining genomes for vaccine components[J].ImmunolCellBiol,2002;80:255-269.
10 Consogno G,ManiciS,FacchinettiV et al.Identification of immunodominant regions among promiscuous HLA-DR restricted CD4+T cell epitopeson the tumor antigen MAGE-3[J].Blood,2003;101(3):1038-1044.
11 Decroix N,Quan CP,Pamonsinlapatham P etal.Mucosal immunity induced by intramuscular administration of free peptides in-line with PADRE:IgA antibodies to the ELDKWA epitopeofHIV gp41[J].Scand J Immunol,2002;56(1):59-65.
12 Alix A J.Predictive estimation and protein Linear epitopesby using the program PEOPLE[J].Vaccine,1999;18(324):311-314.
13 Odorico M,Pellequer J.BEPITOPE:predicting the location of continuous epitopes and patterns in proteins[J].JMol Recognit,2003;16:20-22.
14 张伯伟,赵 磊,郭如华 etal.DNA基因芯片在中华骨髓库HLA组织配型检测中的应用价值[J].中国卫生工程学,2006;5(4):231-232.
[收稿2009-06-03 修回2009-07-27]
(编辑 许四平)
Prediction of the Th/B cellepitopes on HA of influenza virus(H 1N1)and antigenicity analysis
WANGKai-Yan,LITai-Yuan,LUHui-Jun,TANLei,NANWen-Long,TIANMing-Yao,ZHANGJin-Shuang,LIUHao,JINNing-Yi.YanbianUniversity,Longjing133400,China
Objective:To predict Th/B cellepitopes in HA of influenza virus(H1N1)and analyze antigenicity of the candidate epitopes in order to develop epitope-bacterin by theway ofbioinformatics.Methods:The HA amino acid sequences of influenza virus(H 1N1),which the viral infection was prevalent recently,were down loaded from Genbank.The Th/B cell epitopeswere predicted and analyzed by bioinformatics methods.Then,specificity and conservation of the candidate epitopeswere estimated.Finally,antigenicity of the candidate epitopeswas identified by influenza virus(H 1N1)positive serum samp lesofmice.Results:Three Th/B cellepitopes containing HA73-87,HA125-139,HA188-205were acquired.Two of the candidateepitopeswere in a relatively conserved domainof HA1,and a deal of 2006-2009 influenza virus(H1N1)isolates contained the sequences.Moreover,the candidate epitopes were showedin a distinct antibody combining reactivity with the influenza virus(H1N1)positive serum ofmice,which inferred the predicted epitopes to be functional ones.Conclusion:The selected epitopes are able to be functional HA Th/B cell epitopes of influenza virus(H 1N1).Our study also estab lish the foundations for the further research of influenza virus infection and immunitymechanism,the recognition of influenza virus(H1N1)functionalepitope and the developmentofepitope vaccines.
Influenza virus;HA;H 1N1;Epitope
S855.3
A
1000-484X(2010)01-0008-05
王开艳(1984年-),女,在读硕士,主要从事流感基因工程疫苗的研究,E-mail:cindykaiyan@hotmail.com;
及指导教师:李太元(1962年-),男,教授,硕士生导师,主要从事动物免疫学和微生物学方面的研究,E-mail:tyli@ybu.edu.cn。