卵巢癌患者一线化疗后CD8+T细胞和NK细胞数量及功能动态变化的研究①
2010-02-06冯勤梅
冯勤梅 狄 文 吴 霞
(上海交通大学医学院附属仁济医院妇产科上海市教委重点学科上海妇科肿瘤重点实验室,上海 200127)
卵巢癌患者一线化疗后CD8+T细胞和NK细胞数量及功能动态变化的研究①
冯勤梅 狄 文 吴 霞②
(上海交通大学医学院附属仁济医院妇产科上海市教委重点学科上海妇科肿瘤重点实验室,上海 200127)
目的:研究晚期卵巢癌患者经一线化疗后体内CD8+T细胞和NK细胞数量及功能的动态变化。方法:选取术后行紫杉醇联合卡铂化疗的晚期卵巢上皮癌患者共13例,采集化疗前(S0)、化疗后5~7天(S1)、化疗后12~14天(S2)和化疗后25~28天(S3)外周血,流式细胞术检测患者外周血中CD3+、CD4+、CD8+和NK细胞的百分比及绝对数量。采用体外自体肿瘤细胞裂解物脉冲淋巴细胞共培养的方法检测不同时间点CD8+T细胞IFN-γ的分泌功能,并以LDH释放法测定NK细胞对K562细胞的杀伤活性。结果:在一个完整的化疗周期中,CD3+、CD4+、CD8+细胞的绝对数目均于S1期降至最低点,且与 S0期分别都有显著性差异。与对照组相比,当体外给予自身肿瘤细胞裂解物刺激诱导培养后,在S1、S2和S3期产生IFN-γ的CD8+细胞比例均较对照组显著增加,且CD8+IFN-γ+细胞比例在S2期达到最高。NK细胞的绝对数目于S1期降至最低点,且与S0期有显著性差异,NK细胞的比例及杀伤活性在化疗前、后均无显著性差异。结论:卵巢癌患者于一线化疗后机体经历免疫重建的过程,该过程中CD8+T细胞介导的免疫应答一过性增高,而NK细胞的杀伤活性无明显变化。化疗后免疫重建期可能是免疫治疗实施的最佳窗口期。
卵巢癌;化疗;CD8+T细胞;NK细胞
有关肿瘤免疫治疗的动物研究结果给人们带来了巨大的希望,但其临床效果却不尽如人意。导致免疫治疗疗效不佳的重要原因是晚期肿瘤患者体内巨大的肿瘤负荷使免疫功能处于严重抑制状态,如抗原递呈细胞(APCs)功能显著低下、效应T细胞减少而CD4+CD25+调节性T(Treg)细胞增加、协同刺激及协同抑制分子表达异常[1]。Rosenberg等回顾分析440例应用肿瘤疫苗治疗恶性肿瘤的临床试验,发现总体客观临床有效率只有2.6%。因此有必要应用其他方法来打破免疫耐受,以促进免疫治疗的效果[2]。
化疗能有效减少肿瘤负荷,但也有致淋巴细胞减少的副作用,因此传统观念认为化疗会抑制免疫系统,并干扰随后的免疫治疗。然而最近的一些研究表明系统化疗虽然可以导致淋巴细胞数量减少,但机体也可能启动免疫自稳机制使体内残余的淋巴细胞发生活跃增生[3];此外化疗药物诱导体内大量肿瘤细胞凋亡,促使肿瘤抗原的交叉递呈率显著增强[4,5]。迄今一些荷瘤动物模型和零星的Ⅱ、Ⅲ期临床实验也证实化疗不仅不会削弱免疫治疗的疗效,且与免疫治疗存在协同作用[6]。
鉴于上述研究背景,本研究检测了晚期卵巢癌患者经一线化疗后体内T细胞亚群、NK细胞数量及其在淋巴细胞中所占比例的动态变化,并进一步检测了CD8+T细胞和NK细胞功能的动态变化,从而探索化疗后获得性和天然免疫应答的变化,以期明确化疗后机体是否存在免疫抑制暂时逆转之“窗口期”。本研究将为卵巢癌化疗联合免疫治疗的合理应用提供不可缺少的信息。
1 材料与方法
1.1 临床资料和样本采集 病例选自2007年6月至2008年8月间在仁济医院住院手术及化疗的原发性卵巢上皮癌患者(Ⅲ、Ⅳ期)共13例,年龄范围46~63岁,平均年龄54.6岁。全部患者均无免疫系统疾患,经筛选除外高血压、糖尿病、肝肾疾病患者。所有患者均行经腹全子宫+双附件+大网膜+阑尾切除+肿瘤减灭术,术后1月给予紫杉醇+卡铂化疗,具体方案为紫杉醇175mg/m2(输注>3小时)、卡铂AUC 5.0,静注。化疗期间无急性感染发生。所有实验对象于术中无菌切除肿瘤组织、化疗前后无菌抽取空腹静脉血标本作血常规检测,部分血经肝素抗凝后作它用。以年龄为匹配条件,同期选择13名健康女性作为对照组。
1.2 实验材料 淋巴细胞分离液(密度1.077,购自国药集团化学试剂有限公司,上海);小鼠抗人CD3(PerCP标记)、CD4(PE标记)、CD8(FITC标记)、CD16/CD56(PE 标记)、CD69(FITC 标记)、IFN-γ(APC标记)、IgG1(APC标记)单克隆抗体(购自BD公司);PMA(佛波酯)、Ionomycin(离子霉素)(购自Gibco公司);Cytofix/CytoPerm 试 剂 盒、GolgistoP (BD Pharminge,CA,USA);RPM I1640培养液、胎牛血清(购自Gibco公司);红细胞裂解液(购自北京元和生物公司)。
1.3 外周血T细胞亚群、NK细胞检测 抗凝管无菌采集每位卵巢癌患者即刻化疗前(S0)、化疗后5~7天(S1)、化疗后12~14天(S2)和化疗后25~28天(S3)外周血5 ml(体积),根据检测的目的分别加入各种抗体,4℃避光孵育30分钟,加入红细胞裂解液避光10分钟,离心弃上清,PBS洗涤细胞2次,加入4%多聚甲醛200μl固定后,流式细胞仪检测。CD3为T细胞表面标志;CD4和CD8为T细胞亚群标志;CD3-CD16+CD56+为NK细胞表面标志。
1.4 肿瘤细胞裂解液制备 无菌取手术切除的肿瘤组织,剔除结缔组织和坏死组织,用含青霉素(100 U/m l)、链霉素(100U/ml)、不含血清的RPMI1640培养液充分冲洗,剪成肉泥状。加入0.25%的胰蛋白酶4℃消化过夜。血清终止消化,用200目钢筛过滤,用玻璃注射器针芯轻轻研磨钢筛上未滤过的组织块,同时加入1640培养液,收集滤过液充分吹打成单细胞悬液,洗涤2次,用1640培养液重悬细胞。于10m l离心管中缓慢依次加入100%Ficoll、75%(体积分数)Ficoll及单细胞悬液各3ml,3 000 r/m in离心30分钟,吸出上层细胞,PBS洗涤细胞,计数,调整细胞1×107ml-1。置人液氮内10分钟,取出后速投入37℃水浴溶解,反复5次。3 000 r/min,离心10分钟,收集上清,-80℃保存备用。
1.5 CD8+T细胞IFN-γ产生功能检测 采用密度梯度离心法分离外周血单个核细胞,并用10%FBS的RPMI1640培养液调整上述淋巴细胞浓度为1×106m l-1,分为 2组:空白组,加 IL-2 10 ng/ml;实验组:按1∶10自体肿瘤细胞裂解液加入淋巴细胞中,同时加入IL-2 10 ng/ml,每3天半量换液,7天后收集细胞,分别加人刺激剂PMA、Ionomycin,同时加人Golgistop阻断胞内因子向胞外转运,5%CO2、37℃孵育 5小时,CD3、CD8抗体进行表面标记;加入Cytofix/Cytoperm破坏细胞膜完整性,之后加入胞内抗体IFN-γ,对照管加入IgG1。四色流式细胞仪检测,每管获取CD3+T细胞10 000个。以T细胞CD69表达率>95%为质控标准。
1.6 NK细胞杀伤活性检测 采用密度梯度离心法分离外周血淋巴细胞,5%BSA RPMI1640重悬上述细胞为效应细胞,调整浓度为4×106m l-1。对数生长期K562细胞为靶细胞,5%BSA RPMI1640调整细胞浓度为1×105m l-1,以效靶比为40∶1各100μl加入96孔圆底板混合培养。设置自然释放孔(100μl靶细胞+100μl5%BSA RPMI1640培养基),最大释放孔(100 μl靶细胞+0.8%Triton X-100 100μl),均设3复孔。将培养板移至37℃、5%CO2培养箱4小时后取出,800 r/min离心3分钟。每孔吸上清50μl转移至96孔平底板,加入50μl LDH底物反应液,常温避光孵育30分钟,加入50μl终止液终止反应,酶标仪测492 nm处OD值。NK细胞活性计算公式如

1.7 统计学方法 采用SPSS11.5软件进行统计分析。计量资料以±s表示。患者不同时间点均数的比较采用配对t检验,P<0.05为差异有显著性。
2 结果
2.1 流式细胞术检测 CD3+、CD4+、CD8+、IFN-γ+CD8+和NK细胞比例 图1为代表性的流式细胞原始图。
2.2 T淋巴细胞群的变化 患者化疗前后外周血中CD3+、CD4+、CD8+细胞均呈先下降后恢复的趋势。CD3+细胞的绝对数量在S1、S2期明显降低,较S0期有显著性差异(P<0.05);至S3期,其数量较S0期显著增多(P<0.05);CD3+细胞在淋巴细胞中所占比例则S1、S2、S3期与S0期均无显著差异。CD4+细胞的绝对数量在S1、S2期明显降低,较S0期有显著性差异(P<0.05);其在淋巴细胞中所占比例则S1、S2、S3期与S0期均无显著差异(图 2)。CD8+细胞绝对数量、其在淋巴细胞中所占比例均在S1期明显降低,较S0期有显著性差异(P<0.05);两者在S2、S3期均与S0期无差异(图2)。
2.3 晚期卵巢癌患者化疗后CD8+T细胞免疫应答功能的动态变化 采集化疗前、化疗后3个时间点的外周血淋巴细胞进行培养,对照组中淋巴细胞培养液中仅加入IL-2,而在实验组中则加入IL-2和自体肿瘤细胞裂解液。结果发现,两组化疗后产生IFN-γ的CD8+细胞比例于S2期显著增加(P<0.05),至S3期又明显下降,与S0期无明显差异;进一步的分析发现无论是 S1、S2、S3期实验组 IFN-γ+CD8+细胞比例较对照组均显著增加(P<0.05),这表明自体肿瘤抗原可能促进了CD8+细胞的杀伤功能,且在S2期抗原刺激后CD8+细胞反应效应最高(图3)。
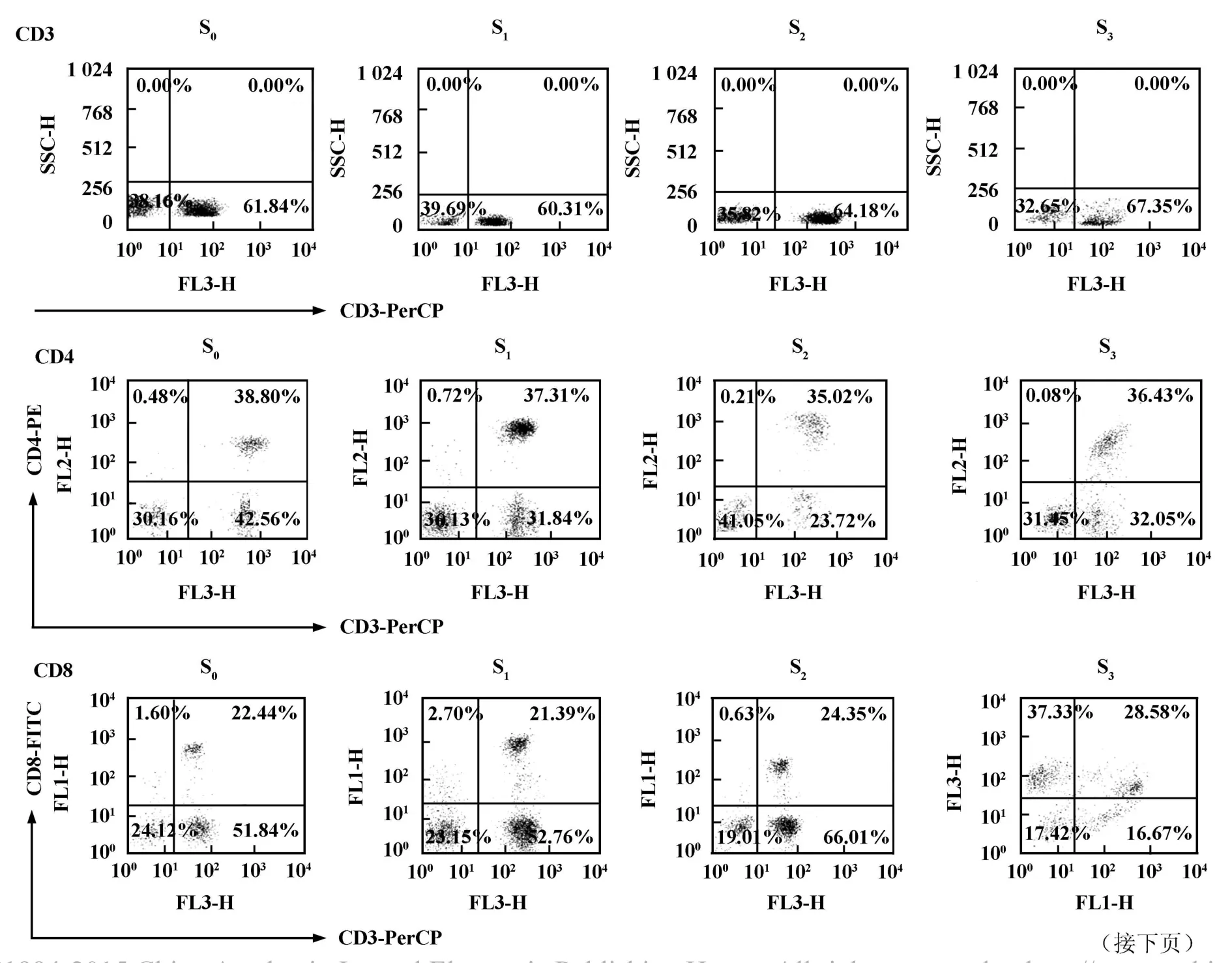
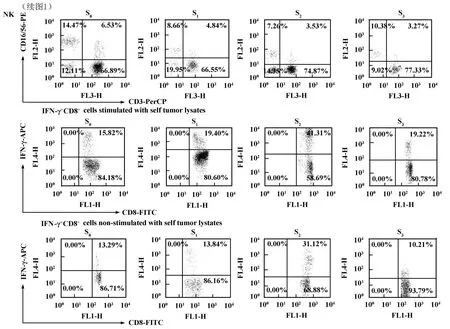
图1 代表性的流式细胞原始图Fig.1 Representative results of flow cytometry analysis
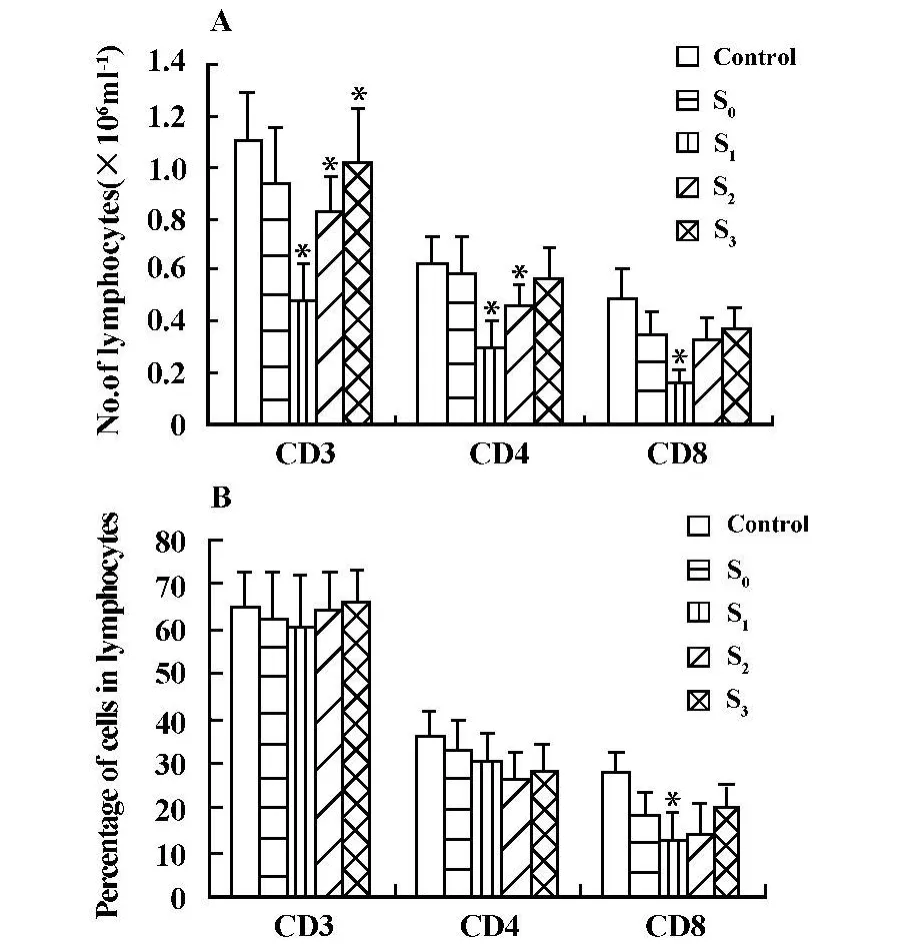
图2 卵巢癌患者化疗后淋巴细胞亚群绝对数量和比例的动态变化Fig.2 The dynam ic changes of the number and percentage of lymphocyte subsets in ovarian cancer patients after chemotherapy
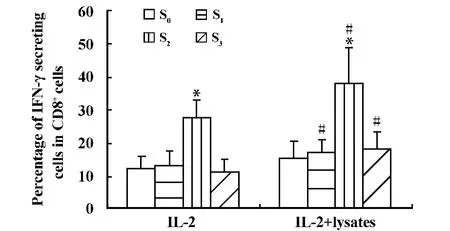
图3 卵巢癌患者化疗前、后CD8+T细胞免疫应答功能的动态变化Fig.3 The dynam ic changes of CD8+T cell responses in ovarian cancer patients undergoing chemotherapy
2.4 NK细胞绝对数及百分比例的动态变化 NK细胞的绝对数量在S1期降至最低,且S1、S2期均较S0期显著降低(P<0.05),至S3期其绝对数量与S1期无明显差异。NK细胞在淋巴细胞中所占的比例在化疗前、化疗后各个时间点均无显著性差异(图4)。
2.5 NK细胞杀伤活性的动态变化 LDH释放实验的结果显示:NK细胞对K562细胞的杀伤活性在S1期较S0期略有下降,至S2期则较S0期略有上升,但其杀伤活性在S1、S2、S3期与S0期相比均无显著性差异(图5)。
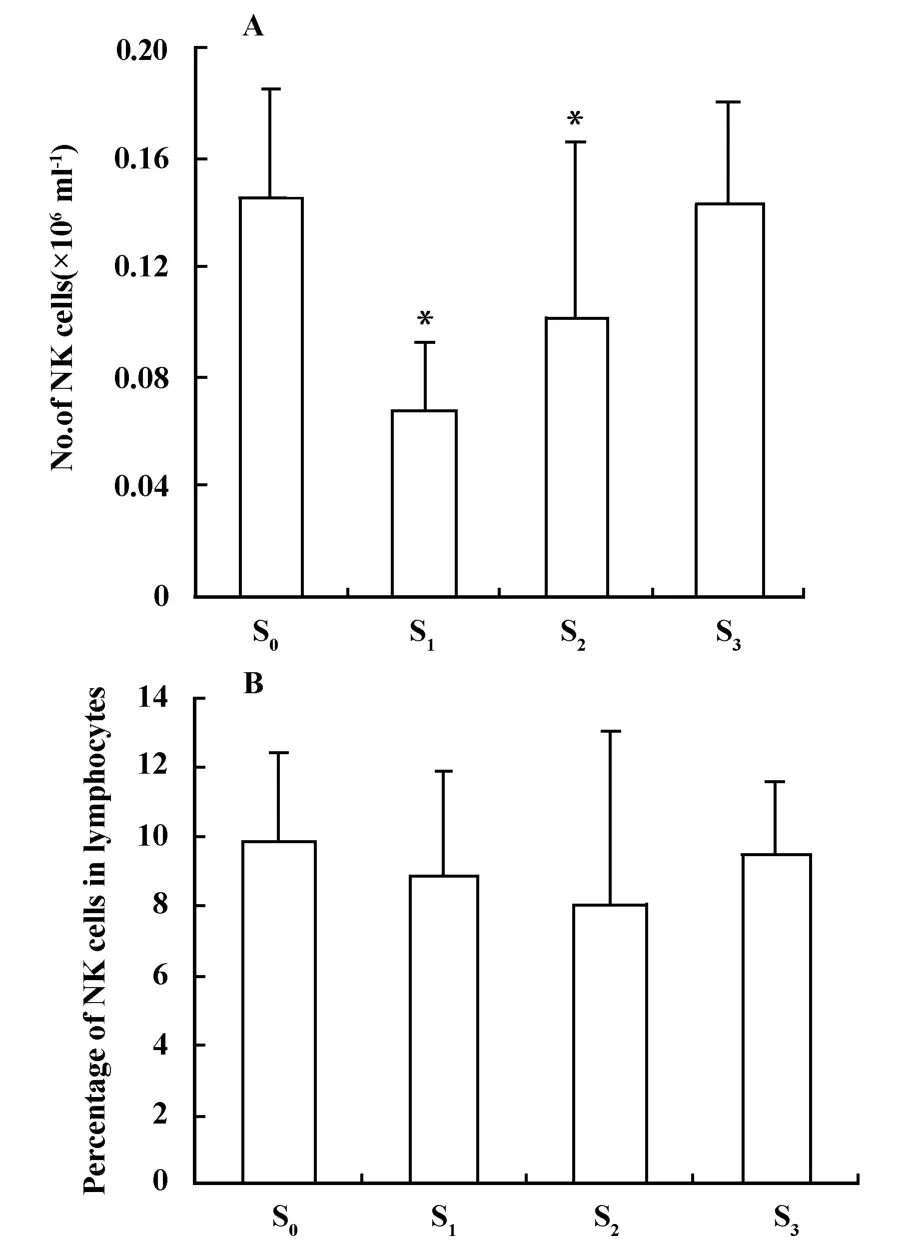
图4 卵巢癌患者化疗后NK细胞绝对数量的动态变化Fig.4 The dynam ic changes of the number and percentage of NK cells in ovarian cancer patients after chemotherapy
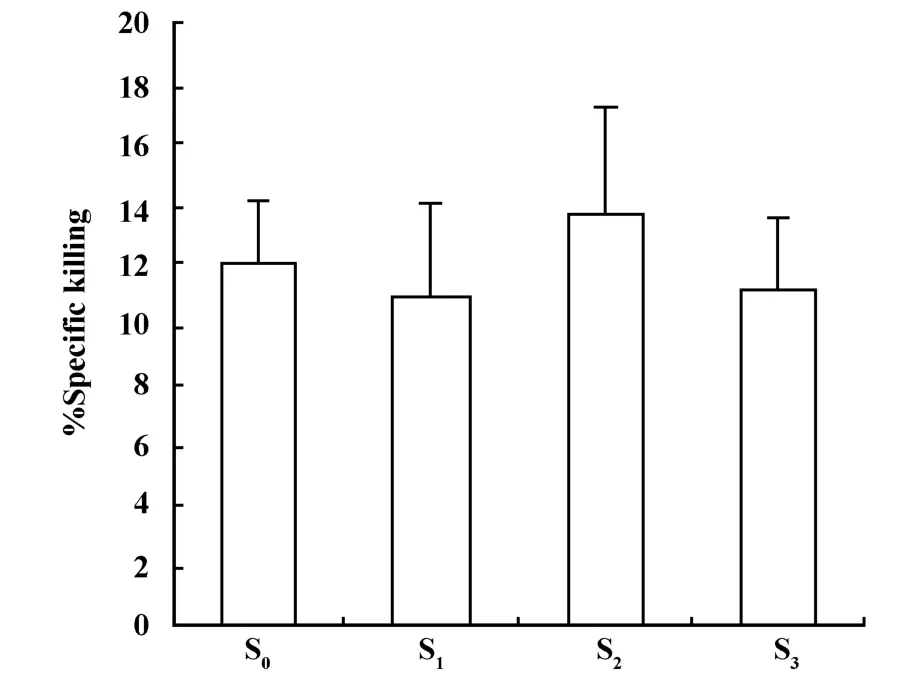
图5 卵巢癌患者化疗后NK细胞杀伤活性的动态变化Fig.5 The dynam ic changes of NK cell function in ovarian cancer patients after chemotherapy
3 讨论
患者体内针对肿瘤细胞的免疫应答可分为获得性免疫应答和天然免疫应答。在获得性免疫应答中,CD8+T细胞起着核心作用。通过过继转输抗原特异性细胞毒性T淋巴细胞(CTL)可有效消除已建立的肿瘤[7,8]。NK细胞是肿瘤天然免疫应答中的关键成份,它不需预先致敏即能杀伤肿瘤细胞,其杀伤作用无肿瘤特异性和MHC限制性,构成机体抗肿瘤的第一道防线。鉴于CD8+T细胞和NK细胞在肿瘤免疫中的重要作用,本研究以此为切入点,探索化疗后卵巢癌患者获得性和固有免疫应答的动态变化。
紫杉醇和卡铂是目前国内外公认的卵巢癌一线化疗药物,本课题选取手术后应用紫杉醇+卡铂化疗的晚期卵巢癌患者为研究对象,全面检测了化疗前、化疗后早期、中期和晚期外周血T细胞亚群的动态改变。CD3+细胞、CD4+细胞和CD8+细胞的绝对数量均在S1期降至最低点,随后开始恢复,但不同细胞其恢复的动态过程不尽相同。CD3+细胞数量在S1期后逐步增多,虽然在S2期仍然显著降低,但至S3期已完全恢复,甚至较化疗前有显著增加。CD4+细胞数量在S1、S2期显著降低,至S3期恢复到化疗前水平。CD8+细胞数量在S1期降至最低,但随后迅速恢复,至S2期已经恢复到化疗前水平,提示CD8+细胞在化疗早期后增生明显。CD3+和CD4+细胞的比例在化疗前后无明显改变,而CD8+细胞的比例在S1期显著下降,S2期则恢复到化疗前水平,这提示CD8+细胞在S1期受到明显抑制,但随后又迅速大量增生,从而无论是数量还是所占比例均在S2期得到恢复。近年的研究发现各种非遗传因素(如化疗药物)导致的淋巴细胞减少可诱发机体免疫系统的自稳性增生(免疫重建),从而使体内的T细胞数目保持在一定的水平。淋巴细胞自稳性增生可使肿瘤抗原特异性T淋巴细胞克隆在“广阔”的空间内扩增,增强抗肿瘤的免疫应答[3]。我们的研究提示CD8+细胞自S1期后开始发生明显的自稳性增生,至S2期已恢复到化疗前水平,而CD4+细胞的自稳性增殖可能相对后延,至S3期才得以恢复。
为了进一步探讨化疗后不同时间点CD8+T细胞的应答能力,我们进行了体外功能测定。无论是对照组(无自身肿瘤抗原)还是实验组(自身肿瘤抗原脉冲淋巴细胞),化疗后分泌IFN-γ的CD8+细胞比例于S2期显著增加,至S3期又明显下降。该结果表明化疗后经自稳性增殖的CD8+细胞的应答能力在S2期显著增强。Coleman等人[9]的研究也发现卵巢癌患者体内CD8+T细胞的功能不是永远处于被抑制状态,成功的化疗可提高抗原特异性T细胞免疫应答。我们推测化疗后CD8+细胞应答能力增强的原因至少有以下三点:(1)我们的系列研究中还发现:化疗后免疫重建过程中,Tc1/Tc2亚群动态漂移,其比值在S2期显著升高,有利于对抗原发挥应答反应(文章待发表);(2)化疗后Treg细胞的绝对数在S1期降至最低,其百分比例在S2期显著降低(文章待发表)。Treg细胞在肿瘤免疫逃逸中起着至关重要的作用,Treg细胞显著减少有利于逆转其对CD8+细胞的抑制作用[10];(3)化疗后凋亡的肿瘤细胞具有免疫原性,其在体内可能起到留置疫苗的作用,促进肿瘤抗原的交叉递呈并激活CD8+细胞[4]。进一步分析发现无论是S1、S2、S3期实验组 IFN-γ+CD8+细胞比例较对照组均显著增加,这表明当再次给予自身肿瘤抗原刺激时,CD8+细胞能产生更加有效的免疫应答。上述研究提示化疗后机体存在免疫功能暂时逆转的“窗口期”,于该窗口期实施免疫治疗有望发挥最佳疗效。
迄今有关化疗对NK细胞数量和功能影响的研究寥寥无几。Bang等人[11]发现,当胰腺癌患者实施吉西他滨与顺铂联合化疗时,NK细胞的数量和百分比例在化疗后15天降至最低;较之正常人群,胰腺癌患者体内的NK细胞杀伤功能显著降低,化疗后15、28天其杀伤功能较化疗前上升。Tsavaris等人[12]的研究显示紫杉烷类化疗药物可显著增强乳腺癌患者体内NK细胞的杀伤功能。在本研究中我们发现NK细胞的绝对数量在S1、S2期均较S0期显著降低,其在淋巴细胞中所占的比例在化疗前、化疗后各个时间点均无显著性差异,这提示化疗后NK细胞于S1期开始增生,至化疗后25~28天其数量已恢复到化疗前水平。NK细胞对K562细胞的杀伤活性在S1期较S0期略有下降,至S2期则较S0期略有上升,但其杀伤活性在S1、S2、S3期与 S0期相比均未达到统计学差异水平。我们未发现化疗后NK细胞杀伤活性显著上升,这也可能是由于样本量较小的缘故。
综上所述,晚期卵巢癌患者实施紫杉醇、卡铂联合化疗后,其体内免疫细胞经历先降低、后增殖的免疫重建过程。CD8+T细胞的应答能力在化疗后12~14天显著增强;此外化疗后NK细胞的杀伤功能无明显变化。化疗后免疫重建诱生了增强的抗肿瘤免疫应答,免疫重建期可能是免疫治疗实施的最佳窗口期。
1 Zou W.Immunosuppressive networks in the tumour environment and their therapeutic relevance[J].Nat Rev Cancer,2005;5:263-274.
2 Rosenberg S A,Yang JC,Restifo N P.Cancer immunotherapy:moving beyond current vaccines[J].NatMed,2004;10:909-915.
3 Wang L X,Li R,Yang Getal.Interleukin-7-dependent expansion and persistence ofmelanoma-specific T cells in lymphodepletedm ice lead to tumor regression and editing[J].Cancer Res,2005;65:10569-10577.
4 van der Most RG,Currie A,Robinson BWetal.Cranking the immunologic enginewith chemotherapy:using context to drive tumorantigen crosspresentation towards useful antitumor immunity[J].Cancer Res,2006;66:601-604.
5 Park SD,Kim CH,Kim C Ketal.Cross-prim ing by temozolomide enhancesantitumor immunity of dendritic cell vaccination inmurine brain tumormodel[J].Vaccine,2007;25:3485-3491.
6 Zhang,T,Herlyn D.Combination of active specific immunotherapy or adoptive antibody or lymphocyte immunotherapywith chemotherapy in the treatment of cancer[J].Cancer Immunol Immunother,2009;58:475-492.
7 Yorty J L,Tevethia S S,Schell T D.Rapid accumulation of adoptively transferred CD8+T cells at the tumor site is associated with long-term control of SV40 T antigen-induced tumors[J].Cancer Immunol Immunother,2008;57:883-895.
8 Hanson H L,Donermeyer D L,Ikeda Hetal.Eradication of established tumorsby CD8+T celladoptive immunotherapy[J].Immunity,2000;13:265-276.
9 Coleman S,Clayton A,Mason M Detal.Recovery of CD8+T-cell function during systemic chemotherapy in advanced ovarian cancer[J].Cancer Res,2005;65:7000-7006.
10 Nizar S,Copier J,Meyer Betal.T-regulatory cellmodulation:the future of cancer immunotherapy?[J].Br JCancer,2009;100:1697-1703.
11 Bang S,Kim H S,Choo YSetal.Differences in immune cells engaged in cell-mediated immunityafter chemotherapy for faradvanced pancreatic cancer[J].Pancreas,2006;32:29-36.
12 TsavarisN,Kosmas C,VadiakaMetal.Immune changes in patientswith advanced breast cancer undergoing chemotherapy with taxanes[J].Br J Cancer,2002;87:21-27.
[收稿2009-06-03 修回2009-08-29]
(编辑 张晓舟)
The dynam ic changes in the numbersand functions of CD8+T cellsand NK cells in advanced ovarian cancer patients undergoing first line chemotherapy
FENGQin-Mei,DIWen,WUXia.DepartmentofObstetrics&Gynecology,RenjiHospital,SchoolofMedicine,Shanghai JiaotongUniversity,Shanghai200127,China
Objective:The purpose of this study is to investigate the dynam ic changes in the numbersand functions of CD8+T cells and NK cellsin patientswith advanced ovarian cancer undergoing first line chemotherapy,so as to identify whether therewas a“window period” of anti-tumor immune suppression reverse after chemotherapy.Methods:Peripheralblood samp lesfrom each ovarian cancer patientwere obtained before(S0)and at day 5-7(S1),day 12-14(S2)and day 25-28(S3)after chemotherapy in 13 patients.The numbers and proportions of CD3+,CD4+,CD8+and nature killer(NK)cells were analyzed by flow cytometry technique.The percentages of specific IFN-γ-secreting CD8+cellswere also calcu lated after that peripheral lymphocytes had been stimu lated with self tumor lysates.Cytotoxicity of NK cells against K562 cellswas detected by LDH releasing assay.Results:The numbers of CD3+,CD4+,CD8+T cells and NK cells reduced to the lowest on S1.Compared to thoseof the controlgroup,and the percentagesof IFN-γ-secreting CD8+T cellswere remarkably higher on S1,S2and S3when CD8+T cellswere stimulatedwith autologous tumor antigen,and the percentageof CD8+IFN-γ+cell reached the higheston S2.No significant differences ofNK cell cytotoxicity against K562 cellswere found on S1,S2and S3compared to S0.Conclusion:Paclitaxeland carboplatin induce lymphopenia,which triggers the temporary immune reconstitution.During immune reconstitution the enhanced priming of CD8+T cell response by autologoustumor antigen is found while the function of NK cells does not change significantly.Itprobably turnsout that the “window period”during immune reconstitution offers abest opportunity for cancer immunotherapy.
Ovarian cancer;Chemotherapy;CD8+T cell;NK cell
R730
A
1000-484X(2010)01-0023-06
①本文为国家自然科学基金(30801363)、上海市教育委员会科研创新项目(08YZ43)
②通讯作者,E-mail:wuxia1225@yahoo.com.cn
冯勤梅(1971年-),女,博士,主治医师,主要从事妇科肿瘤研究,目前于山西省人民医院妇科工作。
·神经内分泌与免疫·