抗人DR5功能性单克隆抗体诱导Jurkat细胞凋亡的线粒体途径的分子机制①
2010-02-06杜耀武柴立辉黄红莹白慧玲赵粤萍马远方
杜耀武 柴立辉 黄红莹 白慧玲 赵粤萍 马远方
(河南大学免疫学研究所河南大学医学院河南大学天然药物与免疫工程省级重点实验室,开封 475001)
抗人DR5功能性单克隆抗体诱导Jurkat细胞凋亡的线粒体途径的分子机制①
杜耀武 柴立辉 黄红莹 白慧玲 赵粤萍 马远方
(河南大学免疫学研究所河南大学医学院河南大学天然药物与免疫工程省级重点实验室,开封 475001)
目的:探讨抗人死亡受体5(DR5)功能性单克隆抗体(mDRA-6)对Jurkat细胞诱导凋亡的线粒体途径的分子机制。方法:MTT法检测单克隆抗体(mDRA-6)对Jurkat细胞生长抑制作用的剂量-效果及时间-效果关系;JC-1单染流式细胞术定量分析技术对凋亡的Jurkat细胞线粒体膜电位的变化进行分析;免疫印迹技术检测凋亡细胞的Caspase-8、3、9及Bid、Bax、Bcl-2、Cyto c等凋亡相关蛋白的表达情况。结果:mDRA-6对Jurkat细胞抑制具有明显剂量-效果和时间-效果关系;流式细胞仪检测显示,2.0μg/m l浓度的mDRA-6作用15、30、60和120分钟时,Jurkat细胞线粒体膜电位改变率分别为 20.14%、19.34%、21.11%、30.90%,呈逐渐增高趋势。免疫印迹技术检测显示,mDRA-6作用后,Jurkat细胞Caspase-8、9及Bid、Bax、Bcl-2、Cyto c等表达活性增加,并且Cyto c在线粒体内为递减而在胞浆呈递增的表达现象。结论:mDRA-6通过激活外源性膜受体,继而启动细胞线粒体途径导致Jurkat细胞凋亡。本研究为mDRA-6对白血病治疗奠定实验基础。
死亡受体5;单克隆抗体;Jurkat细胞;细胞凋亡
1995年Wiley等[1]报道,肿瘤坏死因子相关的凋亡诱导配体(Tumor necrosis factor related apoptosis inducing ligand,TRA IL)可与肿瘤细胞膜相应的死亡受体(Death receptor)DR4和/或DR5结合,诱导细胞凋亡。自此,对TRAIL及其DR4/DR5的研究一直备受关注,针对DR4及DR5的功能性单抗HGS-ETR1(Mapatumumab)和HGS-ETR2(Lexatumumab)等正在进行临床一期或二期实验研究。Hotte等以不同剂量的Mapatumumab对41例实体恶性肿瘤患者(其中结肠癌10例、卵巢癌 9例、宫颈癌5例、乳腺癌 3例、肺癌4例等)进行治疗结果表明,12位(29.3%)患者的治疗有效、病情稳定[2];Plummer等以不同剂量Lexatumumab对37例实体恶性肿瘤患者进行治疗后,13位(35.1%)患者的治疗结果较好[3]。我国郑德先教授研制的抗DR5功能性单克隆抗体AD5-10,也正在进行抗肿瘤的体内外实验研究[4]。
本实验室以可溶性人DR5(rhDR5)胞外段蛋白对BALB/c小鼠进行免疫获得了抗人DR5单克隆抗体,被命名为mDRA-6[5],此抗体可诱导Jurkat细胞及其它肿瘤细胞凋亡[6-8],并初步探明该抗体诱导Jurkat细胞凋亡的分子机制与膜受体途径凋亡有关[8]。本研究仍然以TRA IL敏感的Jurkat细胞株为靶细胞,探讨线粒体凋亡途径的蛋白分子机制在DRA-6诱导Jurkat细胞凋亡中意义,为mDRA-6的临床试验进一步提供理论依据。
1 材料与方法
1.1 抗体和细胞系 抗人DR5单克隆抗体mDRA-6为本实验室制备[5];山羊抗人Caspase-8、9 IgG多克隆抗体及兔抗人Caspase-3 IgG单克隆抗体购于R&D公司;山羊抗人Bid(tbid)、Cyto c、Actin多克隆抗体,山羊抗人 BCl-2、Bax单克隆抗体购自Santa Cruz公司;辣根过氧化物酶标记的兔抗山羊、山羊抗兔等IgG(H+L)购自北京中杉金桥公司。Jurkat细胞为TRAIL敏感株,由美国宾夕法尼亚大学医学院病理与实验医学系陈有海教授馈赠,培养于2mmol/L L-谷氨酰胺、1.5g/L碳酸氢钠、10mmol/LHEPES、1mmol/L丙酮酸钠、10%FBS、100 U/ml青霉素和100μg/m l链霉素的RPMI1640培养基中,在 37℃、5%CO2饱和湿度的条件下培养,实验时取对数生长期的细胞。
1.2 主要材料与试剂 RPMI 1640、胎牛血清、四氮唑蓝(MTT)购自GIBCO公司;rhTRAIL、DMSO购自Sigma公司;细胞线粒体分离及膜电位检测试剂盒(JC-1)、Western blot试剂盒及IP细胞裂解液购自Beyotime公司;ECL显影试剂盒购自Santa Cruz公司;流式细胞仪(FACSCalibur)为BD公司产品;垂直电泳仪及电转装置为Thermo EC公司产品;凝胶图像分析仪(Alphalmager2200)为A lpha Inntech公司产品;数码相机为Nikon公司产品。
1.3 mDRA-6对Jurkat细胞毒作用检测 将密度为2.0×105m l-1的Jurkat细胞加于96孔平底型细胞培养板,100μl/孔,培养8小时作对细胞增殖作用的剂量-效果的检测。加mDRA-6液100μl,使第1孔的抗体浓度为5.0μg/ml,然后倍比稀释依次至第2、第3……第10孔,第11孔为不加mDRA-6的阴性对照,第12孔为不加细胞的空白对照;以rhTRAIL作为对照;每个浓度做3个复孔。置37℃,5%CO2培养箱内孵育12小时,1 000 r/min离心5分钟,吸出150μl上清,加入新培养液130μl/孔,加MTT(5.0 mg/m l)20μl/孔,继续孵育4小时。离心后小心移弃上清。加DMSO,150μl/孔,避光振荡混和10分钟,全自动酶标仪测OD570值。
将相同密度的Jurkat细胞加于7块96孔平底型细胞培养板内作对细胞增殖作用的时间-效果的检测,第1孔加入mERA-6为100μl,使其终浓度为0.5 μg/ml,第2孔为不加mDRA-6的阴性对照,第3孔为空白对照,每个浓度做3个复孔,以rhTRAIL作为对照 。继续于培养箱内孵育,依次于 2、4、6、8、10、12小时取培养板,依照上述方法加入MTT及DMSO,全自动酶标仪测OD570值。
所有实验重复3次,取平均值。计算Jurkat细胞死亡率和存活率。细胞死亡率(%)=100%-细胞存活率;细胞存活率(%)=(实验组OD值-空白OD值)/(对照组OD值-空白OD值)×100%)。
1.4 线粒体膜电位(Mitochondrialmembrane potential,ΔΨm)检测 将密度为 6.0×105m l-1的Jurkat细胞加于一组6孔板内,0.5 ml/孔,每孔加入mDRA-6,使其浓度为2.0 μg/m l,对照孔不加 。于15、30、60和120分钟时依次收集每孔细胞,离心弃上清,加入0.5m l JC-1染色工作液,混匀后置CO2培养箱继续孵育20分钟。离心后弃上清,加入缓冲液1ml混匀置冰上,以流式细胞技术检测细胞线粒体膜电位的变化,用CellQuest软件进行分析。
1.5 参与Jurkat细胞凋亡线粒体途径的蛋白分子检测 将密度为6.0×105ml-1的Jurkat细胞加于两组6孔板内0.5 ml/孔,加入mDRA-6,使其浓度为2.0μg/ml,对照孔不加。于 15、30、60和120分钟时依次收集每孔细胞,离心弃上清,其中一组每管加入Western及IP细胞裂解液300μl充分混匀,置冰上30分钟,10 000 r/m in低温离心1分钟,吸取上清;另一组以细胞线粒体分离试剂获取每份样品的线粒体裂解蛋白;BCA法测定每份样品的蛋白总量,于12%~18%的SDS-PAGE进行电泳分离蛋白[9],随后,将蛋白转至 PVDF膜上,加入Caspase-8、3、9及Bid、Bax、Bcl-2、Cyto c 等一抗,与 PVDF 膜在室温下孵育1小时,以PBST(含0.1%Tween 20的PBS)洗6次,10分钟/次。加入二抗,室温孵育1小时,以PBST洗去未结合抗体,以Kodak X-AR胶片记录ECL法检测结果。
1.6 统计学处理 应用SPSS13.0软件包进行统计学分析和t检验和方差分析,药物作用Jurkat细胞的剂量-效果关系及时间-效果关系的分析作用采用直线回归分析,实验结果以±s表示,P<0.05为差异具有统计学意义。
2 结果
2.1 mDRA-6对Jurkat细胞的毒性作用[8]不同浓度的mDRA-6作用12小时后,Jurkat细胞的死亡率明显增高,当浓度为4.9l~1 250 ng/ml时细胞的死亡与mDRA-6呈明显的量-效关系,见图1A。以0.5 μg/m l的 mDRA-6 作用 2、4、6、8、10、12 小时时 ,Jurkat细胞死亡率明显增加,与mDRA-6作用时间呈明显的时-效关系(r=0.928,P=0.008);作为对照,相同浓度的rhTRAIL作用相同时间时,Jurkat细胞死亡率为 9.22%、17.39%、38.78%、47.18%、51.98%、58.08%,结果见图1B。本检测证明,相同浓度的mDRA-6及rhTRAIL作用于Jurkat细胞时,无论从量-效关系,还是从时-效关系上比较,mDRA-6诱导细胞凋亡的效果高于rhTRAIL。
2.2 mDRA-6对Jurkat细胞线粒体膜电位(ΔΨm)的影响经JC-1单染后流式细胞学分析结果显示,以2.0μg/m l的mDRA-6作用Jurkat细胞15、30分钟和1、2小时后,Jurkat细胞线粒体膜电位下降率分别为20.14%、19.34%、21.11%、30.90%,提示 mDRA-6可以导致线粒体膜电位降低,见图2。
2.3 mDRA-6对Jurkat细胞凋亡相关蛋白表达的影响 以2.0μg/m l的mDRA-6作用后,Western blot法检测 Jurkat细胞Caspase-8、3、9 及 Bid 、Bax、Bcl-2、Cyto c表达结果显示 ,Caspase-8、Caspase-3、Caspase-9表达水平明显增强;Bid酶原、Bcl-2随作用时间的延长表达水平逐渐减少、而激活的tbid、Bax和Cyto c表达水平逐渐增加,而线粒体内的Cyto c逐渐减少,证明Cyto c随着作用时间的延长由线粒体基质外溢至胞浆中,佐证了JC-1单染线粒体膜电位(ΔΨm)的变化,见图3。
3 讨论
自Wiley等报道TRAIL之后的十多年间,针对促凋亡受体激动剂(Proapoptotic receptor agonists,PARAs)的研究一直是方兴未艾,目前文献报道的针对DR4/DR5的功能性抗体约有8个[10],有的已经用于临床Ⅰ期试验,并取得了一定的疗效[2-4]。mDRA-6是本实验室研制的针对人DR5的功能性单克隆抗体,与rhDR4、rhDcR1、rhDcR2和 rhFas等无交叉反应,能与肿瘤细胞膜表面的DR5结合诱导肿瘤细胞凋亡,其诱导凋亡作用可以被 rhDR5完全阻断[5]。mDRA-6无需交联即可诱导多种肿瘤细胞凋亡,并与化疗药物具有协同杀伤肿瘤细胞的作用[11,12]。
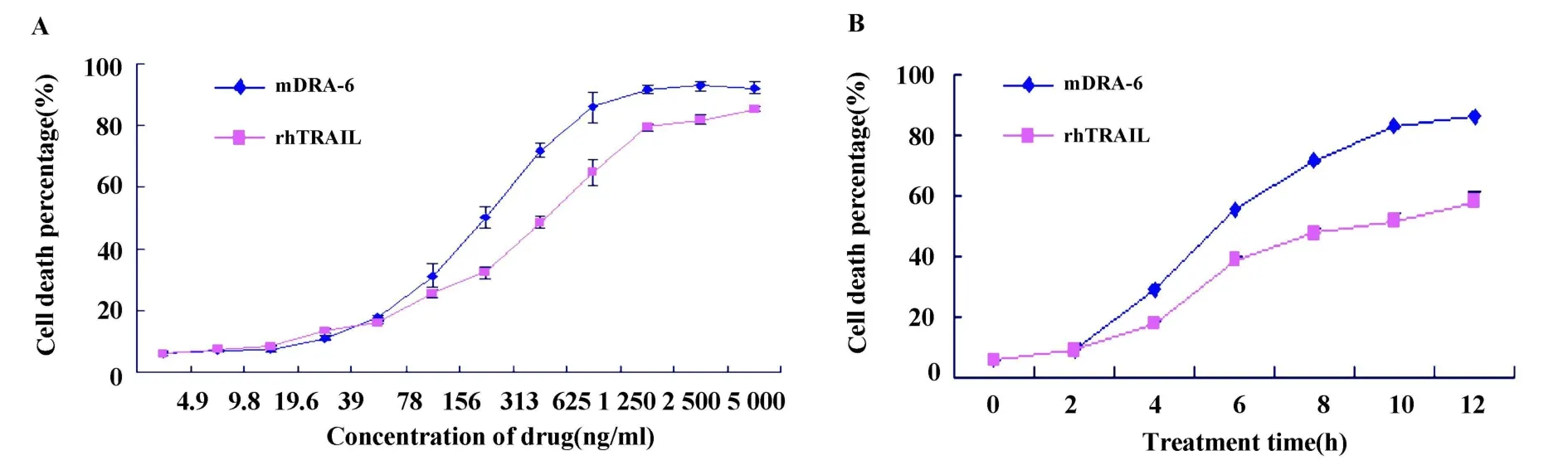
图1 mDRA-6、rhTRAIL对Jurkat细胞死亡率Fig.1 The dose-dependence and time-dependence of Jurkat cell death treated bymDRA-6&rhTRAIL

图2 mDRA-6诱导Jurkat细胞调亡的流式细胞仪分析结果Fig.2 Analysis Jurkat cellapoptosis treated bymDRA-6 with JC-1 stain by FCM
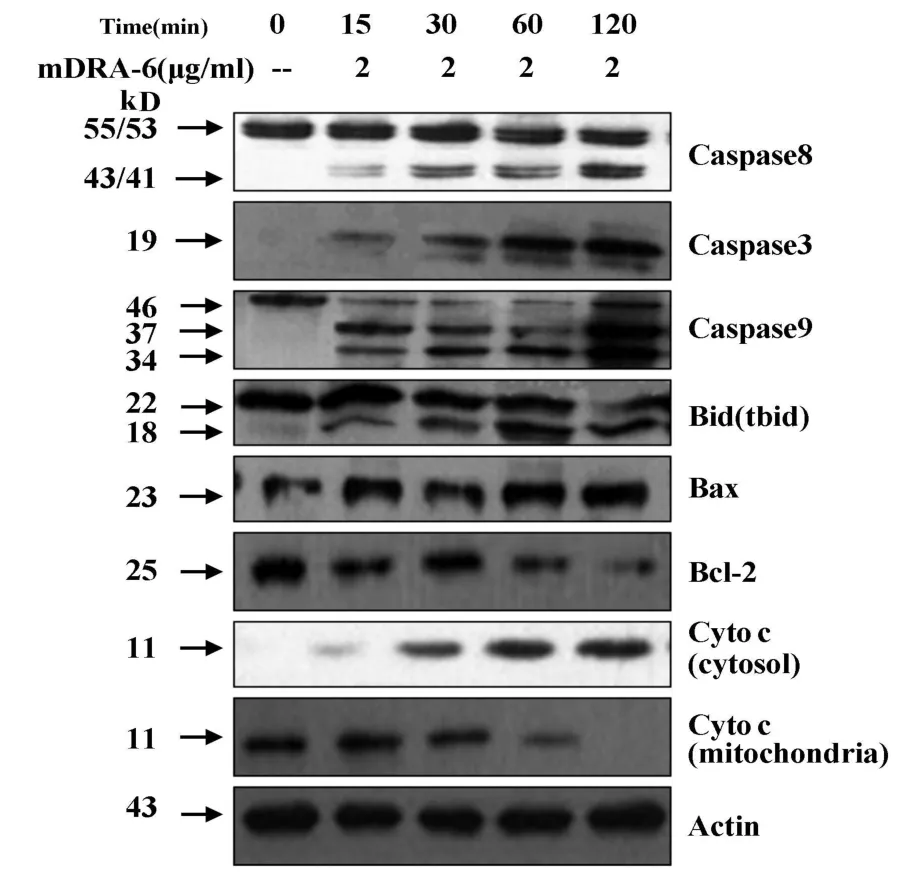
图3 Western blot检测mDRA-6作用 Jurkat细胞相关凋亡信号的结果Fig.3 Activation of caspase cascade and apoptotic proteins were tested by Western b lot
我们的前期实验结果显示,mDRA-6可诱导Jurkat细胞凋亡[8],可使 Jurkat细胞 Caspase-8、3、9 均被激活,Caspase-8抑制剂对Jurkat细胞凋亡的抑制作用远高于Caspase-3、9抑制剂的作用[8]。初步证实,mDRA-6对Jurkat细胞的凋亡作用与其它已知的DR5的功能性单抗AD5-10、TRA-8等具有相似的膜受体凋亡机制[4,13]。本实验在前期工作的基础上,对分析了对Jurkat细胞线粒体膜电位改变的分析,免疫印迹显示 Bid(tbid)、Bax、Bcl-2、Cyto c等与线粒体途径凋亡相关的蛋白分子的变化情况。
线粒体膜电位(ΔΨm)的下降是细胞早期凋亡的一个标志。JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针。在线粒体膜电位较高时,JC-1聚集在线粒体基质中形成聚合物(J-aggregates),产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体(monomer),产生绿色荧光。所以,用JC-1从红色荧光到绿色荧光的转变可以作为细胞凋亡早期的一个检测指标。当以2.0μg/ml的mDRA-6作用15分钟、30分钟、1小时、2小时后,Jurkat细胞线粒体膜电位下降率分别为20.14%、19.34%、21.11%、30.90%(见图 2),此结果与mDRA-6对Jurkat细胞毒性作用的量-效关系及时-效关系的结果分析不一致,远低于相当剂量时Jurkat的细胞死亡率,提示mDRA-6在通过降低线粒体膜电位引起细胞凋亡的同时,还有其它诱导细胞凋亡的途径[8]。
蛋白免疫印迹检测结果显示,随着mDRA-6的作用时间延长,Caspase-8、3、9和Bax活性片段表达均呈现渐进式增加,在120分钟时活性片段表达最强。Bid(tbid)Bid酶原表达逐渐减少、而激活的tbid表达逐渐增加,对凋亡有抑制作用的Bcl-2表达逐渐减少、而对凋亡起促进作用的Bax却表达逐渐增多;同时,Cyto c表达增加,在120分钟时表达最强,而线粒体内的Cyto c表达逐渐减少,在120分钟处几乎没有表达,提示随着mDRA-6对Jurkat细胞作用时间延长,Cyto c由线粒体基质大量外溢至胞浆中,进而导致细胞的凋亡(见图3)。
细胞凋亡主要通过两种既独立又彼此相关的信号传导机制:一种是外源性的膜受体途径,通过激活细胞膜表面的凋亡受体;另一种是内源性的线粒体途径,通过激活细胞内的线粒体信号。这两者汇集于效应分子Caspases,协调引导细胞凋亡[14]。对由Fas相关死亡结构域(Fas-associated death domain,FADD)及Caspase-8和/或Caspase-10启动的肿瘤细胞凋亡机制的研究中,发现有两种不同类型的凋亡机制在相应的细胞中起重要作用。Ⅰ型细胞中Caspase-8和/或Caspase-10作用于Caspase-3的二聚体酶原结构而引起Caspase-3活化[15],激活的Caspase-3消化分解包括ICAD(Inhibitorof Caspase-activated deoxyribonuclease)在内的构成细胞基本结构的多种蛋白成分,而ICAD的破坏导致CAD的活化,后者引起细胞DNA降解,最终导致细胞凋亡[16]。Ⅱ型细胞中,可能因凋亡抑制蛋白XIAP(X-chromosome linked Inhibitory of Apoptosis Protein)的影响使Caspase-3不能被有效地激活、启动凋亡进程,从而通过Caspase-8和/或Caspase-10启动了BID(Bcl-2 inhibitory BH3-domain-containing protein,BID)激活为活性状态的tbid[17],与Bax(Bcl-2-associated X protein)共同插入线粒体外膜层,使线粒体内膜亦破坏崩解而引起Cyto c等外溢[18],再与Apaf-1(Apoptotic protease activating factor 1)、Pro-caspase-9和dATP形成一种被称之为apoptosome的复合体,这种复合体二聚化再激活Caspase-9,进一步放大Caspase-3的激活而诱导肿瘤细胞的凋亡[19]。
本实验结果提示,mDRA-6诱导的Jurkat细胞凋亡的过程中,通过线粒体途径诱导细胞凋亡具有很重要的作用。mDRA-6首先作用于细胞膜表面的DR5,激活受体形成三聚体进而募集细胞内的转接分子Pro-caspase-8,使后者进一步成为活化状态的Caspase-8,通过外源性的膜受体凋亡途径进一步激活下游的效应分子Caspase-3、9,继而作用于死亡底物发生凋亡。同时,活化的Caspase-8激活Bid形成有活性的tbid,在促进凋亡的Bax分子参与下,消减抗凋亡分子Bcl-2对线粒体膜的稳定作用,破坏线粒体膜的完整性,引起线粒体膜电位下降,导致Cyto c由线粒体基质外溢至胞浆中而促使细胞的凋亡。本研究及我们的前期工作提示,mDRA-6诱导Jurkat细胞凋亡的分子机制可能与mDRA-6首先激活外源性的膜受体途径,继而启动细胞内源性的线粒体途径[8],通过细胞凋亡的两种途径导致Jurkat细胞凋亡的。详细机制参见图4。
mDRA-6诱导 Jurkat细胞凋亡过程中,有无JUK/P38/PARP途径的参与,Smac/DIABLO 、P53、NF-κB等分子的表达如何仍不清楚,还需要进一步实验。抗人DR5的功能性单克隆抗体mDRA-6是一种具有诱导肿瘤细胞凋亡活性的功能性抗体,将其人源化改造后可有效地用于抗肿瘤生物治疗,可为TRAIL/DR5系统的抗肿瘤应用提供一种新的生物治疗制剂。

图4 mDRA-6诱导Jurkat细胞凋亡的分子机制示意图Fig.4 Themolecu lar mechanisms of mDRA-6 inducing apoptosis in Jurkat cells
1 W iley SR,Schooley K,Smolak P J et al.Identification and characterization ofa new member of the TNF fam ily that induces apoptosis[J].Immunity,1995;3(6):673-682.
2 Hotte SJ,HirteH W,Chen E X et al.A phase 1 study ofmapatumumab(fully human monoclonal antibody to TRAIL-R1)in patients with advanced solid malignancies[J].Clin Cancer Res,2008;14(11):3450-3455.
3 Plummer R,Attard G,Pacey S et al.Phase 1 and pharmacokinetic study of lexatumumab in patients with advanced cancers[J].Clin Cancer Res,2007;13(20):6187-6194.
4 Yabin Guo,Caifeng Chen,Yong Zheng et al.A novel anti-human DR5 monoclonal antibody with tumoricidal activity induces caspase-dependent and caspase-independendent cell death[J].JBiolChem,2005;280(51):41940-41952.
5 刘广超,马远方,李淑莲 et al.诱导细胞凋亡的抗hDR5单抗的研究[J].中华微生物学和免疫学杂志,2006;26(7):632-636.
6 李淑莲,张 军,刘广超 et al.抗人DR5单克隆抗体(mDRA-6)诱导Jurkat细胞凋亡活性研究[J].中国免疫学杂志,2006;22(1):65-67,71.
7 张 军,马远方,刘广超 et al.抗人DR5单克隆抗体对人肝癌细胞HepG2的凋亡作用[J].现代免疫学,2007;27(1):65-68.
8 杜耀武,刘广超,王 靖 et al.抗人DR5单克隆功能抗体mDRA-6诱导Jurkat细胞的Caspase路径机制研究[J].中国免疫学杂志,2009;25(1):48-53,79.
9 林菊生主编.现代细胞分子生物学技术[M].北京:科学出版社,2004:570-974.
10 Avi A,Herbst R S etal.Tokill a tumor cell:thepotential of proapototic receptor agonists[J].JClin Investi,2008;118(6):1979-1790.
11 张 军,马远方,刘广超 etal.抗人DR5单抗与阿霉素联合对人肝癌细胞SMMC-7721协同杀伤效应[J].中国免疫学杂志,2006;22(2);133-136.
12 李淑莲,马远方,刘广超 et al.抗人DR5单克隆抗体-mDRA-6与顺铂协同杀伤白血病细胞HL-60作用研究[J].中国免疫学杂志,2006;23(2);118-122.
13 Ichikawa K,LiuW,Zhao L etal.Tumoricidalactivity ofa novelanti-human DR5 monoclonal antibody without hepatocyte cytotoxicity[J].Nat Med,2001;7(8):954-960.
14 Lavrik IN,Golks A,Krammer PH etal.Caspases:pharmacologicalmanipulation of celldeath[J].JClin Invest,2005;115(10):2665-2672.
15 ScaffidiC,Fulda S,Srinivasan A et al.Two CD95(Apo-1/Fas)signaling pathway[J].EMBO,1998;17(6):1675-1687.
16 Fischer U,Janicke RU,Schulze-Osthoff K.M any cuts to ruin:a comprehensive update of caspase substrates[J].Cell Death Differ,2003;10(1):76-100.
17 Luo X,Budihardjo I,Zou H et al.A Bcl2 interacting protein,mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors[J].Cell,1998;94(4):481-490.
18 Green D R,K roemer G.The pathophysiology ofm itochondrial cell death[J].Science,2004;305(5684):626-629.
19 Lucken-ArdjomandeS,Martinou JC.Newcomers in the process ofmitochondrial permeabilization[J].JCell Sci,2005;118(3):473-483.
[收稿2009-06-07 修回2009-09-24]
(编辑 许四平)
Them itochondrial-dependentmolecular mechanisms for inducing apoptosis in Jurkat cellsby a novelagonistic anti-human DR5monoclonal antibody
DUYao-Wu,CHAILi-Hui,HUANGHong-Ying,BAIHui-Ling,ZHAOYue-Ping,MAYuan-Fang.InstituteforImmunologyofHenanUniversity,MedicalCollegeofHenanUniversity,TheKeyLaboratoryofNaturalDrug&ImmunologyEngineering,HenanUniversity,Kaifeng475001,China
Objective:To investigatemitochondrial-dependentmolecularmechanisms of a novel agonistic anti-human death receptor 5(DR5)monoclonal antibody(mDRA-6)inducing apoptosis in Jurkat cell.Methods:The dose-dependent and time-dependent cellgrow th suppression ofmDRA-6 in Jurkat cellswas determined by MTT assay.Themeasurement of them itochond rial transmembrane potential(ΔΨm)of Jurkat cellswasdetected by flow cytometrywith JC-1 single staining.Caspase-8,9 aswell as Bid,Bax,Bcl-2 and Cyto c of apoptotic Jurkat cells were analyzed byWestern blotaftermDRA-6 treatment.Results:ThemDRA-6 induced cellgrow th suppression and cytotoxicity in dose-dependentmanner and time-dependentmanner.AftermDRA-6 treatment at2.0μg/ml for15min,30min,60min and 120min,the change inΔΨm were 20.14%,19.34%,21.11%and 30.90%respectively by JC-1 single staining.Western blot revealed that the levelofactive fragmentsof Caspase-8,9 and Bid,Bax,Bcl-2 and Cyto c respectively,and the amountof Cyto cwasincreased in cytosol concomitantwith the related attenuation of Cyto c inmitochondria.Conclusion:Apoptotic pathway of Jurkat cells induced bymDRA-6 is initiated upon DR5 ligation tomDRA-6 and exogenic Caspase-dependent cell apoptotic cascades is activated,and endogenicmitochondrial-dependent cell apoptosis pathway is activated.mDRA-6may be ausefu lagent in investigating human leukemia therapy by using TRAIL/DR5.
Death recptor5;Monoclonal antibody;Jurkat cell;Apoptosis;Western blot
R392.11
A
1000-484X(2010)01-0003-05
①本文受国家863重大专项子课题(No.2006AA02A 254)及河南省杰出人才创新基金项目(No.074200510014)的资助
杜耀武(1971年-),男,医学硕士,副教授,主要从事肿瘤免疫学研究,E-mail:dyw711@henu.edu.cn;
及指导教师:马远方(1960年-),男,医学博士,教授,博士生导师,主要从事肿瘤免疫与抗体工程研究,E-mail:mayf@henu..edu.cn。