髓样抑制细胞免疫抑制机理的研究①
2010-02-06赵贤贤李晓燕李卓娅尹丙姣
万 琳 胡 鑫 赵贤贤 李晓燕 李卓娅 尹丙姣
(华中科技大学同济医学院免疫学研究所,武汉 430030)
髓样抑制细胞免疫抑制机理的研究①
万 琳 胡 鑫 赵贤贤 李晓燕 李卓娅 尹丙姣
(华中科技大学同济医学院免疫学研究所,武汉 430030)
目的:研究荷瘤小鼠来源的髓样抑制细胞(Myeloid derived suppressor cell,MDSC)在肿瘤免疫抑制中的作用机理。方法:用Percoll分离法从荷瘤小鼠的脾脏和骨髓中分离Gr-1+CD11b+MDSC;用流式细胞术检测MDSC对T细胞增殖的抑制作用;分别用生化法和ELISA技术检测MDSC体外培养上清中抑制性因子NO、ROS和IL-10、TGF-β的含量。结果:MDSC在荷瘤小鼠的脾脏和骨髓中聚集增多,且其在骨髓中所占的比例显著高于脾脏;MDSC可以明显抑制脾脏细胞的增殖,体外培养6小时的MDSC可以分泌大量NO、ROS和IL-10、TGF-β。结论:本实验进一步证实MDSC可以通过分泌大量NO、ROS和IL-10、TGF-β抑制T细胞增殖。
髓样抑制细胞;NO;ROS;IL-10;TGF-β
多年来对肿瘤疫苗的研究,虽然在动物实验中取得了良好的效果,但是临床效果欠佳[1],其重要原因是肿瘤抗原可以产生免疫逃避现象,抑制机体免疫功能[2-4]。人们对肿瘤免疫耐受机制进行了深入的探讨和研究,发现在慢性炎症的局部和肿瘤组织中聚集有大量的未成熟髓样抑制细胞(Myeloid derived suppressor cells,MDSC),该细胞是一群异质性细胞,它包括未成熟的巨噬细胞、树突状细胞和粒细胞等,其共同的表面标志为Gr-1+CD11b+,具有很强的免疫抑制作用,是引起肿瘤免疫逃逸的重要细胞群体[5-7]。目前研究证实,MDSC的免疫抑制作用与两种精氨酸代谢酶密切相关:Ⅰ型精氨酸酶(arginase-1,ARN-1)和诱导性一氧化氮合酶(Inducible nitricoxide synthase,iNOS也称NOS-2)[8-15]。同时MDSC能分泌免疫抑制因子,如集落刺激因子、TGF-β、IL-10等抑制T细胞分化[16-20]。本研究采用Percoll密度梯度离心法从荷瘤小鼠骨髓中分离MDSC,经流式细胞术鉴定此法分离的50%~60%Percoll界面之间的细胞中有80%为Gr-1+CD11b+MDSC,以此MDSC为对象,研究其对T细胞增殖的抑制作用及其机理,为肿瘤免疫逃逸机理及临床抗肿瘤治疗研究提供新的实验手段和理论依据。
1 材料与方法
1.1 实验动物、细胞系与主要试剂
1.1.1 实验动物 6~8周龄C57BL/6J小鼠(购自武汉大学医学院实验动物中心)。
1.1.2 细胞株 C57BL/6J小鼠肺癌细胞株LLC(Lewis Lung Cancer)(曹雪涛教授惠赠)。
1.1.3 主要试剂 DMEM、RPM I1640培养基(Gibco公司,美国);小牛血清(杭州四季青生物工程公司);Percoll(Amersham 公司,美国);FITC-anti-Gr-1+、PE-anti-CD11b+、PE-anti-CD3 与 PE-anti-TNF-a(eBioscience公司,美国);CFSE、乙酰肉豆蔻佛波酯PMA、离子霉素 Iono mycin(Sigma公司,美国);mIL-10 ELISA试剂盒、mTGF-βELISA试剂盒(eBioscience公司,美国);一氧化氮试剂盒、羟自由基检测试剂盒(南京建成生物工程研究所);其他生化试剂均为国产AR级。
1.2 荷瘤小鼠肿瘤模型构建及其脾脏和骨髓单个细胞悬液的制备 用1×PBS将处于对数生长期的LLC细胞调至密度为1×107个/ml,取0.1 ml细胞悬液皮下注射至C57BL/6J小鼠右腹背部,三周后(肿瘤长至直径1~3厘米时)处死小鼠。取其脾脏,用磨砂玻片碾磨,然后取孔径为200目尼龙膜过滤,1 000 r/min离心5分钟,弃上清,加入2m l红细胞裂解液,用吸管轻轻地吹打后静置3分钟,加入10%FCSRPMI1640培养基5m l终止红细胞裂解反应,取尼龙膜过滤,离心洗细胞,用培养基调整细胞浓度,置冰上备用;同时分离小鼠的股骨和胫骨,用5 ml一次性注射器吸取1×PBS冲洗骨髓腔,经尼龙膜过滤、离心洗细胞后,用培养基调整细胞浓度,置冰上备用。
1.3 采用密度梯度离心法初步分离MDSC 文献报道MDSC的密度约为1.069,其分离方法如下:预先用100%的Percoll溶液悬浮上述脾脏和骨髓细胞,将一吸管插至15m l的离心管中,沿吸管壁依次缓缓注入各 2 ml的 PBS、50%Percoll、60%Percoll、70%Percoll和100%Percoll溶液悬浮的上述脾脏或骨髓细胞,2 900 r/min离心30分钟,收集第二层细胞悬液(50%和60%Percoll溶液之间),用1×PBS洗细胞两次后,调整细胞浓度2×107ml-1,置冰上备用。这层细胞约80%为CD11b+Gr-1+MDSC。
1.4 用流式细胞术检测脾脏和骨髓中MDSC数量百分比 取1×106上述荷瘤小鼠脾脏、骨髓的细胞原液及经Percoll溶液分离后的MDSC,按照抗体说明书加入FITC antiGr-1和PE antiCD11b对细胞进行染色,同时设对照组,用流式细胞仪检测CD11b+Gr-1+细胞的数量百分比。
1.5 采用CFSE递减法检测MDSC对T细胞增殖的抑制作用 CFSE是一种绿色荧光染料,可使细胞着色,并且随着细胞的增殖,荧光逐渐减弱,直至消失。经过CFSE染色后的T细胞会随着细胞增殖,荧光逐渐衰减,以此推测T细胞的增殖状况。本实验取正常6周龄的C57BL/6J小鼠的脾脏,按上述方法制备成5×107m l-1脾脏细胞悬液,取该细胞1m l与1m l 0.1%BSA的PBS和1μl CFSE(终浓度 5μg/m l)混匀,置37℃,5%CO2培养箱培养30分钟后加入1m l小牛血清终止反应,再加入9m l无血清的RPMI1640混匀,1 000 r/min离心5分钟,弃上清,然后取无血清的RPM I1640洗细胞两次,最后用1ml 10%FSC RPMI1640培养基重悬细胞,调细胞密度至 2×107ml-1。
取上述经CFSE染色的脾脏细胞悬液和上述经Percoll溶液分离的MDSC各100μl(2×106)(1∶1)混合,并用100μl Ionomycin(终浓度10 ng/ml)和100μl PMA(终浓度10μg/ml)刺激其中T细胞增殖。同时设各种对照组:未加MDSC组、未加MDSC及Ionomycin和PMA组。各组最终用10%FCSRPM I1640培养基补足2ml终体积,置37℃,5%CO2培养箱培养5天,收集细胞至流式测定试管中,用PE antiCD3标记T细胞,用流式细胞仪检测CD3+细胞即T细胞增殖指数。
1.6 采用生化方法检测MDSC培养上清中NO、ROS的含量 分别采用硝酸还原酶-Griess试剂法和Fenton反应法检测MDSC培养上清中NO和ROS含量。其操作按各自试剂盒说明书进行。取经Percoll溶液分离的正常小鼠和荷瘤小鼠来源的MDSC 2×106于0.5ml无血清培养基中,置37℃、5%CO2培养箱中培养6小时后,收集其细胞培养上清,其中,荷瘤小鼠来源的MDSC分别培养4、6、12、18、24小时后收集上清。
1.7 ELISA法检测MDSC培养上清中IL-10、TGF-β的含量 采用ELISA检测上述MDSC培养6小时后上清中IL-10、TGF-β的含量,其操作按试剂盒说明书进行。
2 结果
2.1 MDSC在荷瘤小鼠骨髓和脾脏中聚集增多文献报道在荷瘤小鼠和肿瘤病人的骨髓、脾脏中聚集有大量的MDSC。本实验给6周龄C57BL/6J小鼠皮下接种1×106LLC三周后,用流式细胞仪检测也发现其骨髓、脾脏中Gr-1+CD11b+细胞即MDSC较正常小鼠显著增多,并且在骨髓中增加的幅度大于脾脏。具体结果如图1、2和3所示。图1显示正常小鼠骨髓中MDSC约占23.3%,而荷瘤小鼠骨髓中MDSC明显增多,约占62.5%(P<0.01),经Percoll分离纯化后MDSC纯度提高至79.5%。图2显示正常小鼠脾脏中MDSC约占22.53%;荷瘤小鼠脾脏中MDSC显著增多,约占45.12%(P<0.01);经Percoll纯化后可使MDSC纯度提高至62.5%。
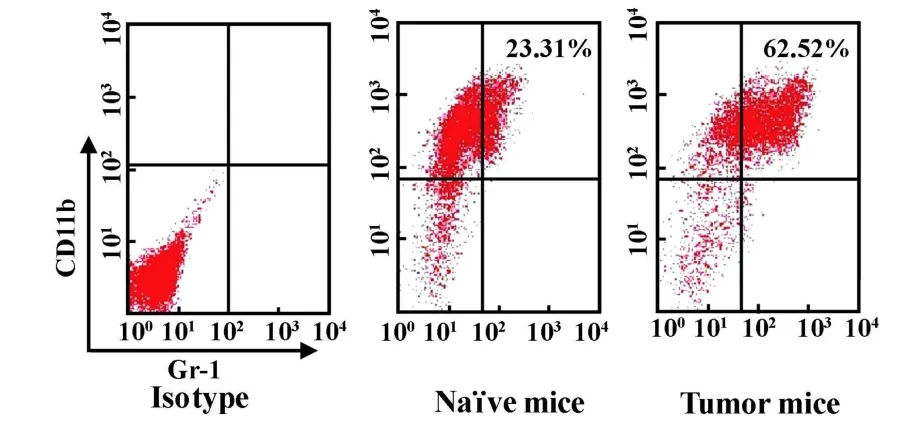
图1 荷瘤小鼠和正常小鼠骨髓中MDSC数量的比较Fig.1 Comparison on the number of MDSC from tumorbearing and normalmouse
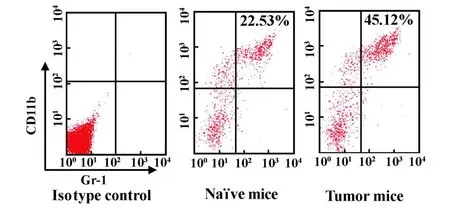
图2 正常小鼠和荷瘤小鼠脾脏中MDSC数量的比较Fig.2 Comparison on the number of MDSC from spleen of tumor-bearing and normalmouse
将骨髓和脾脏中MDSC百分比进行统计分析后,结果如图3所示,MDSC在荷瘤小鼠骨髓和脾脏中均聚集增多,且在骨髓MDSC聚集量比脾脏的多。
2.2 MDSC可以抑制T淋巴细胞增殖 检测T淋巴细胞受抗原刺激后的活化和增殖,是判断机体免疫状况的一个重要指标。本实验首先用CFSE标记脾脏细胞后,与骨髓来源的MDSC按1∶1混合培养,同时在该混合培养体系中加入Ionomycin和PMA作为T淋巴细胞的多克隆激活剂刺激T细胞增殖,以便观察MDSC细胞对T细胞增殖的影响;培养5天后,用PE antiCD3单克隆抗体标记T细胞,用流式细胞仪检测T细胞的增殖指数,结果如图4所示:静止T细胞的增值指数是1.07;在Ionomycin和PMA刺激下T细胞的增值指数增至5.68,而加入MDSC后,T细胞的增殖指数降为3.0(P<0.01),提示经percoll分离的骨髓来源的MDSC能显著抑制T淋巴细胞增殖。2.3 MDSC能产生大量的NO和活性氧(Reactive oxygen species,ROS) 有文献报道,MDSC可通过产生NO和ROS抑制机体抗肿瘤免疫[8-13],本实验也比较了正常和荷瘤小鼠骨髓来源的MDSC产生NO和ROS的水平。首先观察体外培养荷瘤小鼠来源的MDSC产生NO的动态变化,结果如图5所示:荷瘤小鼠MDSC产生的NO在4小时即开始增高,6小时达高峰,经过几个小时的平台期,在18小时时开始逐渐下降,因此后续实验中选择6小时的时间点比较正常与荷瘤小鼠MDSC产生NO的水平,结果如图6,荷瘤小鼠MDSC产生NO的量显著高于正常小鼠来源的MDSC,分别为 264.9μmol/L和31.1 μmol/L(P<0.01),是正常小鼠MDSC产生NO的8.5倍。
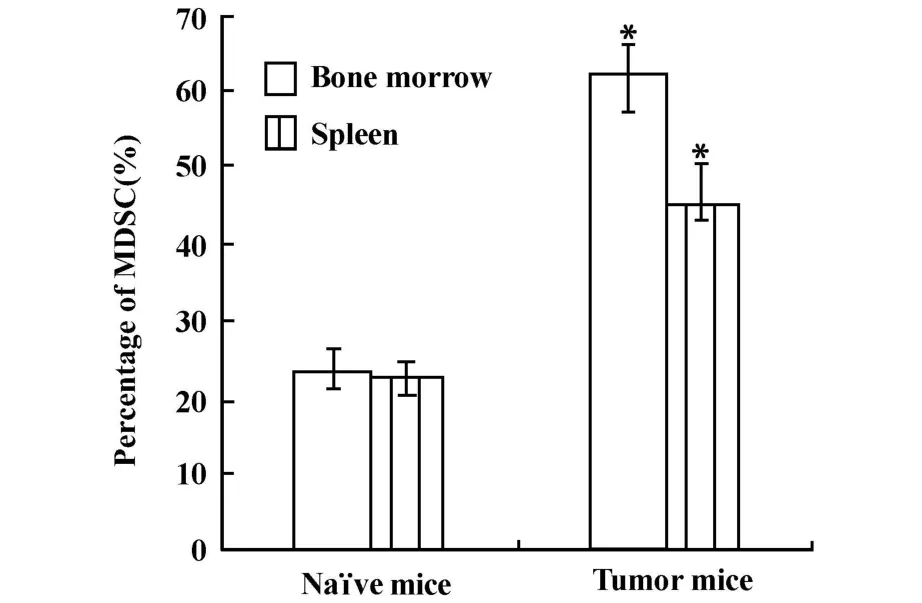
图3 正常小鼠和荷瘤小鼠脾脏和骨髓中MDSC数量的比较Fig.3 Comparison on the number of MDSC from bone marrow of tumor-bearing and normalmouse

图4 MDSC抑制T淋巴细胞增殖Fig.4 MDSCs surp ress the proliferation of T lymphocytes
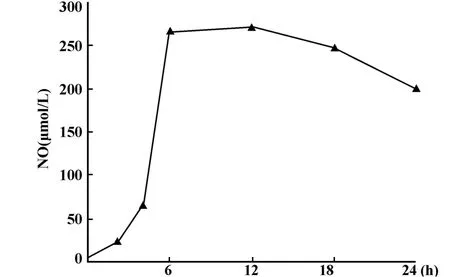
图5 荷瘤小鼠MDSC体外产生NO的动态变化Fig.5 The level of NO quantity change rule in MDSC culture supernatants from tumor-bearingmouse

图6 比较两种来源的MDSC产生NO和ROS量Fig.6 Comparison on the quantity of NO and ROS from tumor-bearing and normalmouse
此外,我们同时观察和比较了正常小鼠和荷瘤小鼠MDSC产生ROS的水平。结果如图6所示,荷瘤小鼠来源的MDSC在体外培养6小时时ROS含量显著高于正常小鼠来源的MDSC(P<0.01),约提高了1倍多。
2.4 MDSC表达IL-10、TGF-β抑制性细胞因子 为了进一步研究MDSC抑制机体抗肿瘤免疫的机制,本实验采用ELISA的方法检测了不同来源的MDSC在体外培养6小时后上清中IL-10、TGF-β的含量,结果发现来源于荷瘤小鼠MDSC分泌的IL-10显著高于正常小鼠的MDSC(P<0.01),分别为337.5 pg/m l和196.4 pg/ml,而且,TGF-β的分泌也有相同的趋势,荷瘤小鼠MDSC分泌的TGF-β显著高于正常小鼠的MDSC(P<0.01),二者分别为25 072.25 pg/ml和16 083.615 pg/ml(图7);提示荷瘤小鼠MDSC很有可能通过分泌IL-10、TGF-β等抑制性细胞因子抑制机体的免疫功能。
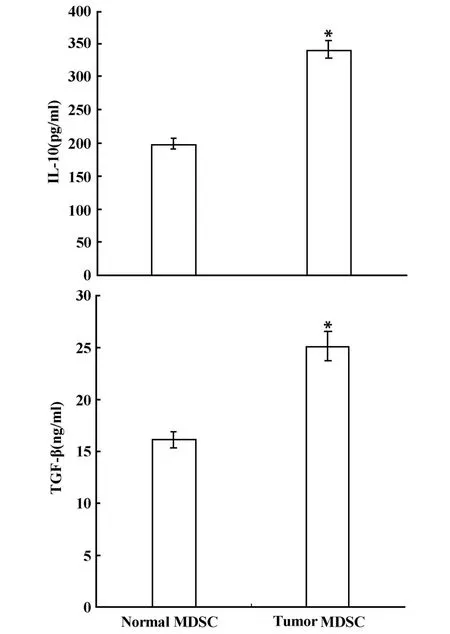
图7 比较两种来源的MDSC产生IL-10和TGF-β的量Fig.7 Comparison on the quantity of IL-10 and TGF-βfrom tumor-bearing and norma lmouse
3 讨论
大量的研究报道,慢性炎症和肿瘤组织中聚集的MDSC具有很强的免疫抑制作用,是引起肿瘤免疫逃逸的重要细胞群体。其免疫抑制机制有:①大量产生诱导性一氧化氮合成酶和精氨酸酶,通过促进NO和活性氧产生而直接抑制T细胞功能[8-15];②其产生的精氨酸酶消耗精氨酸,导致TCR CD3ζ合成受阻,使T细胞信号转导障碍[12-15];③MDSC一旦浸润肿瘤组织即可分化为TAM和血管内皮细胞,抑制T细胞的抗肿瘤免疫功能[7]。④MDSC可分泌TGF-β、IL-10等抑制性细胞因子,诱导CD4+CD25+Foxp 3+调节性 T细胞(Treg)产生,抑制肿瘤免疫[16-20]。
本研究也进一步证实MDSC在荷瘤小鼠的脾脏和骨髓中聚集显著增多,且其在骨髓中所占的比例及增高的幅度显著高于脾脏;经Percoll纯化的、骨髓来源的MDSC(取自50%~60%界面的细胞,其MDSC纯度达80%)可以明显抑制脾脏细胞中T淋巴细胞的增殖,体外培养6小时后可以分泌大量NO、ROS和IL-10、TGF-β。但MDSC的免疫抑制功能与其来源有关,往往只有从荷瘤小鼠和肿瘤患者体内分离到的MDSC才具有免疫抑制功能,而用同样的方法从正常小鼠和人体内分离的MDSC不具有或仅有很低的免疫抑制功能[20],本实验也得到同样的结论,即荷瘤小鼠来源的MDSC的免疫抑制功能显著高于正常小鼠来源的MDSC。
MDSC高表达精氨酸酶(ARN)和一氧化氮合酶(NOS),两者均参与了MDSC免疫抑制作用。其具体机制如下:肿瘤微环境中左旋精氨酸(L-Arg)减少,L-A rg通过两种酶——ARN和NOS代谢:①ARN途径:L-Arg在ARN的作用下生成鸟氨酸和尿素。②NOS途径:L-Arg被NOS氧化,生成一氧化氮(NO)和瓜氨酸。进一步研究证实,L-Arg是CD8+T细胞生成CD3和CD8所必须的氨基酸,L-A rg缺乏可导致T细胞受体(TCR)CD3ζ链合成受阻和TCR信号转导障碍。而CD3ζ链合成受阻又可通过反馈机制使细胞内ARN生成增多,故导致机体内L-Arg的耗竭[12,13,21-24]。
IL-10具有很强的免疫抑制作用,其参与MDSC的免疫功能的机制可能包括:①IL-10能够诱导未成熟的辅助性T淋巴细胞(Th0)向Th2细胞分化,抑制Th1细胞的生成。Th2细胞产生的IL-4、IL-6、IL-10都可直接刺激肿瘤细胞生长,促进肿瘤细胞和MDSC产生更多的IL-10。②IL-10能抑制单核/巨噬细胞系统产生 IL-1、IL-12、TNF-α、GM-CSF,抑制T 细胞及NK 细胞产生TNF-β、IFN-γ,并促进单核/巨噬细胞系统、T细胞和NK细胞产生IL-10。③IL-10能抑制各种抗原递呈细胞(APC)对抗原的趋化反应,并抑制APC膜上MHCⅠ、Ⅱ类分子及CD80、CD86等的表达,从而抑制了APC向T细胞递呈抗原[16,20,21,25-31]。
另外,荷瘤小鼠来源的MDSC产生大量TGF-β参与MDSC的免疫功能的机制可能包括如下:①可以促使Th1/Th2平衡向Th2细胞方向偏移。②可以抑制CTL和NK细胞CD3中ζ链信号的传递,抑制ζ链及细胞质中蛋白酪氨酸、丝氨酸、苏氨酸的磷酸化,故抑制相应转录因子的活化。③TGF-β能够抑制IFN-γ及MHC Ⅱ类分子合成[18,20]。
总之,本实验进一步证实荷瘤小鼠的MDSC通过分泌大量NO、ROS和IL-10、TGF-β抑制机体抗肿瘤免疫,同时证明荷瘤小鼠骨髓细胞经Percoll分离后取其50%~60%界面的细胞可用于MDSC生物学功能的基础研究,为研究肿瘤免疫逃逸机理及临床抗肿瘤治疗提供新的实验手段和理论依据。
1 Finn O J.Cancer vaccines:between the idea and the reality[J].Nat Rev Immunol,2003;3(8):630-641.
2 Dunn G P,Bruce A T,Lkeda Hetal.Cancer immunoediting:from immunosurveillance to tumor escape[J].Nat Immunol,2002;3(11):91-98.
3 Pardoll D.Does the immune system see tumors as foreign or self?[J].Annu Rev Immunol,2003;21:807-839.
4 Yang RC,CaiZ,YuanW illiam Hetal.CD80 in immune suppression by mouse ovarian carcinoma-associated Gr-1+CD11b+myeloid cells[J].Cancer Res,2006;66(13):6807-6815.
5 Vakkila J,Lotze M T.Inflammation and necrosis promote tumor growth[J].Nat Rev Immunol,2004;4(8):641-648.
6 Bronte V,Serafini P,Apolloni Eetal.Tumor-induced immune dysfunctions caused bymyeloid suppressor cells[J].JImmunother,2001;24(6):431-446.
7 Yang L,DeBusk LM,Fukuda Ketal.Expansion ofmyeloid immunesuppressor Gr-1+CD11b+cells in tumor-bearing host directly promotes tumor angiogenesis[J].Cancer Cell,2004;6(4):409-421.
8 Ochoa A C,Zea A,Hernandez Cetal.A rginase,prostaglandins,and myeloid-derived suppressor cells in renal cell carcinoma[J].Clin Cancer Res,2007;13(2):721-726.
9 Sinha P,Clements V K,Ostrand-Rosenberg S.Interleukin-13-regulatedM2macrophages in combination with myeloid suppressor cells block immune surveillanceagainst metastasis[J].Cancer Res,2005;65(24):11743-11751.
10 Bronte V,Serafini P,De Santo Cetal.IL-4-induced arginase 1 suppresses alloreactive T cells in tumor-bearingm ice[J].J Immunol,2003;170(1):270-278.
11 Sinha P,Clements V K,Ostrand-Rosenberg S.Reduction ofmyeloid-derived suppressor cellsand induction ofM1macrophages facilitate the rejection of establishedmetastatic disease[J].J Immunol,2005;174(2):636-645.
12 Zhao X Q,Mohaupt M,Jiang Jetal.Tumor necrosis factor receptor 2-mediated tumor suppression is nitric oxide dependent and involves angiostasis[J].Cancer Res,2007;67(9):4443-4450.
13 SaioM,Radoja S,MarinoMetal.Tumor infiltratingmacrophages induce apoptosis in activated CD8T cellsby amechanism requiring cellcontact and both the cell-associated form of TNF and nitric oxide[J].J Immunol,2001;167(10):5583-5593.
14 Bronte V,Serafini P,Mazzoni Aetal.Largininemetabolism inmyeloid cells controls T-lymphocyte functions[J].Trends Immunol,2003;24(6):302-306.
15 Rodriguez P,Ochoa A C.T cell dysfunction in cancer:role ofmyeloid cells and tumor cells regulating am ino acid availability and oxidative stress[J].Sem in Cancer Biol,2006;16(1):66-72.
16 Huang B,Pan P Y,Li QSetal.Gr-1+CD115+Immaturemyeloid suppressor cellsmediate the development of tumor-induced T regulatory cells and T-cell anergy in tumor-bearing host[J].Cancer Res,2006;66(2):1123-1131.
17 Terabe M,Matsui S,Noben-Trauth Netal.NKT cell-mediated repression of tumor immunosurveillance by IL-13 and the IL-4R-STAT6 pathway[J].Nat Immunol,2000;1(6):515-520.
18 Umemura N,Saio M,Suwa Tetal.Tumor-infiltrating myeloid-derived suppressor cells are pleiotropic-inflamed monocytes/macrophages that bearM1-andM2-type characteristics[J].J Leukoc Biol,2008;83(5):1136-1144.
19 Sinha P,Clements V K,BuntSKetal.Cross-Talk betweenmyeloid-derived suppressor cells andmacrophages subverts tumor immunity toward a type 2 response[J].JImmunol,2007;179(2):977-983.
20 SerafiniP,Borrello I,Bronte V.Myeloid suppressor cells in cancer:recruitment,phenotype,properties,andmechanismsof immunesuppression[J].Sem in Cancer Biol,2006;16(1):53-65.
21 Gabrilovich D.Mechanisms and functional significance of tumor-induced dendritic-celldefects[J].Nat Rev Immunol,2004;4(12):941-952.
22 Staveley-O'Carroll K,Sotomayor E,Montgomery Jetal.Induction of antigen-specific T cellanergy:an early event in the courseof tumor progression[J].Proc Natl Acad Sci USA,1998;95(3):1178-1183.
23 Shevach EM.CD4+CD25+suppressor T cells:more questions than answers[J].Nat Rev Immunol,2002;2(6):389-400.
24 Kusmartsev SA,Li Y,Chen SH.Gr-1+myeloid cells derived from tumor-bearingm ice inhibit primary T cellactivation induced through CD3/CD28 costimulation[J].JImmunol,2000;165(2):779-785.
25 Vudattu N K,Holler E,Ewing Petal.Reverse signaling ofmembraneintegrated tumor necrosis factor differentially regulates alloresponses of CD4+and CD8+T cells against humanmicrovascular endothelial cells[J].Immunology,2005;115(4):536-543.
26 KusmrtsevS,Gabrilovich D I.Role of immaturemyeloid cells inmechanismsof immune evasion in cancer[J].Cancer Immunol Immunother,2006;55(3):237-245.
27 Sauter B,AlertM L,Loise Franciscoetal.Consequences of cell death:exposure to necrotic tumor cells,but not primary tissuecellsor apoptotic cells,induces thematuration of immunostimulatory dendritic cells[J].J Exp Med,2000;191(3):423-434.
28 Thurnher M,Radmayr C,Ramoner Retal.Human renal-cell carcinoma tissue contains dendritic cells[J].Int JCancer,1996;67(1):1-7.
29 Almand B,Resser JR,Lindman Betal.Clinical significance of defective dendritic celldifferentiation in cancer[J].Clin Cancer Res,2000;6(5):1755-1766.
30 Wojas K,Tabarkiewicz J,JankiewiczMetal.Dendritic cells in peripheralblood of patientswith breast and lung cancer-a pilot study[J].Folia Histochem Cytobiol,2004;42(1):45-48.
31 Levitsky H I,Montgomery J,Ahmadzadeh Metal.Immunization with granulocyte-macrophage colony-stimulating factor-transduced,but not B7-1-transduced,lymphoma cells primes idiotype-specific T cells and generates potentsystemic antitumor immunity[J].J Immunol,1996;156(10):3858-3865.
[收稿2009-03-15 修回2009-06-05]
(编辑 倪 鹏)
Study on mechanismsof immune suppression mediated bymyeloid derived suppressor cells
WANLin,HUXin,ZHAOXian-Xian,LIXiao-Yan,LIZhuo-Ya,YINBing-Jiao.InstituteofImmunology,TongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective:To study themechanisms of immune suppressionmediated by Gr-1+CD11b+myeloid derived suppressor cells(Gr-1+CD11b+MDSC)from tumor-bearingmice.Methods:Gr-1+CD11b+MDSC recruited into spleen and bonemarrow of tumor-bearing micewere purified by Percoll,and suppressionmediated byMDSC on T cell proliferation from sp leen of naïvemicewas detected by flow cytometry with CSFE and FITC-anti CD3 staining,and NO,ROS,IL-10 and TGF-βin the supernatantofMDSCwere detected by Griess and ELISA.Results:There weremuchmoreGr-1+CD11b+MDSCs in spleen and bonemarrow from tumor-bearingmouse than those of naïvemouse,and suppression on T cell proliferationmediated by MDSC from tumor bearingmouse was significantly increased,and there weremuchmore NO,ROS,IL-10 and TGF-βin the supernatant of these MDSC than that from naïvemouse.Conclusion:MDSC from tumor-bearingmice secreted high level of NO,ROS,IL-10 and TGF-βto induce immune suppression,and inhibite the proliferation of T cells.
MDSC;NO;ROS;IL-10;TGF-β
R392.111
A
1000-484X(2010)01-0017-06
①本文为国家自然科学基金资助项目(No.30771976)
万 琳(1982年-),女,在读硕士,主要从事肿瘤免疫学研究,E-mail:wanlin811002@sina.com;
及指导教师:尹丙姣(1964年-),女,教授,硕士生导师,主要从事肿瘤免疫学研究,E-mail:bingjiaoyin@gmail.com。