禽巴氏杆菌OmpH外膜蛋白DNA疫苗的免疫效果①
2010-02-06牛明福王帅涛秦翠丽孙晓菲马丽苹侯玉泽河南科技大学洛阳471003
宫 强 牛明福 王帅涛 秦翠丽 孙晓菲 马丽苹 侯玉泽 (河南科技大学,洛阳 471003)
禽巴氏杆菌OmpH外膜蛋白DNA疫苗的免疫效果①
宫 强 牛明福 王帅涛 秦翠丽 孙晓菲 马丽苹 侯玉泽 (河南科技大学,洛阳 471003)
目的:研究禽多杀性巴氏杆菌omph DNA疫苗在小鼠体内诱导的免疫保护效果。方法:利用PCR技术扩增出禽多杀性巴氏杆菌的 omph基因片段,克隆到pMD18-T上,再亚克隆到真核载体pcDNA3.1(+)上,构建重组质粒pOMPH,体外转染SP2/0细胞,RT-PCR、间接免疫荧光试验、Western blot检测其转录及表达情况。然后进行动物免疫,实验动物分为三组即:pOMPH组、pCDNA3.1(+)空载体组和PBS对照组,每组16只BALB/c小鼠,pOMPH组和 pCDNA3.1(+)组以100μg/只的剂量肌注免疫,PBS组每只小鼠肌注100μl 1×PBS,各组均进行了三次免疫,每次间隔两周。间接ELISA检测免疫后小鼠血清特异性抗体水平,MTT法检测免疫小鼠脾淋巴细胞增殖情况,三免两周后检测脾淋巴细胞IFN-γ分泌情况。强毒攻击,计算小鼠存活数目及保护率。结果:间接免疫荧光试验、Western blot和RT-PCR检测结果均表明pOMPH可在体外培养的SP2/0细胞中表达目的蛋白。动物免疫后,pOMPH组免疫小鼠血清抗体水平持续上升,与pCDNA3.1(+)组和PBS组相比差异极显著(P<0.01)。经提取的外膜蛋白(Omps)刺激后,pOMPH组的刺激值(SI值)与pCDNA3.1(+)组及PBS免疫组相比均差异显著(P<0.05)。免疫小鼠脾细胞产生的IFN-γ极显著高于两对照组产生的IFN-γ(P<0.01)。攻毒后pOMPH组保护率明显高于两对照组,可达70%。结论:成功构建了禽多杀性巴氏杆菌omph DNA疫苗,该疫苗可诱导免疫小鼠产生较强的体液和细胞免疫应答及较好的保护效果。
禽多杀性巴氏杆菌;omph DNA疫苗;免疫应答;保护效果
禽多杀性巴氏杆菌病是严重影响我国养禽业发展的重大疫病之一,呈世界性分布,在我国依然是常见的多发病,几乎所有的鸡群都存在该病。其传染流行严重影响着我国养禽业的健康发展,造成了巨大的经济损失。
目前对于该病的控制措施,主要采用的是药物治疗,尤其是抗生素如磺胺嘧啶、链霉素等效果较好,但易产生抗药性,且应用时间较长时对禽体,尤其是泌尿系统产生明显毒害作用。对产蛋鸡用后可明显引起产蛋率的下降,从而大大降低了其商业价值。“防重于治”,对于大多数传染病来说,疫苗免疫被认为是最佳的预防策略,对于禽巴氏杆菌病亦是如此,因此,要想有效控制该病的流行,必须研制有效的疫苗。
目前我国应用的商品化疫苗主要有禽巴氏杆菌病弱毒活疫苗和灭活疫苗两种,其中弱毒疫苗是我国所有禽弱毒疫苗中研究最多的一类,曾在上世纪80年代达到了研制的高峰期,但由于禽多杀性巴氏杆菌本身复杂的抗原结构和易变异等固有的问题,至今尚未获得理想的弱毒疫苗。现有的市售弱毒苗存在着一系列的问题,如免疫期偏短(约2~3个月)、免疫保护力偏低(约50%~75%)、局部及全身的反应偏大,不仅造成减食和严重产蛋下降,还会造成一些死亡,以及菌株遗传不够稳定等关键性技术问题,应用不当甚至会引起禽霍乱的爆发[1],因此其效果并不理想。而灭活苗存在的保护率低和免疫期短的问题较弱毒苗更为严重,所以研制新型有效的禽巴氏杆菌病疫苗势在必行。目前针对多杀性巴氏杆菌新型疫苗的研究主要集中在重组亚单位疫苗上[2-5],而DNA疫苗的研究相对较少一些,且主要集中在猪巴氏杆菌病的DNA疫苗上[6,7],禽多杀性巴氏杆菌DNA疫苗的研究则鲜有报道。本研究以禽多杀性巴氏杆菌主要外膜蛋白编码基因omph为基础构建了真核表达质粒pOMPH,导入哺乳动物SP2/0细胞中进行了表达及检测,并通过对实验动物免疫指标的测定及攻毒保护率的测定,综合评价其免疫效果,旨在为进一步研究禽多杀性巴氏杆菌病新型有效疫苗奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 菌种和细胞 禽多杀性巴氏杆菌C48-1菌株购自中国兽医药品监察所;大肠杆菌感受态细胞DH 5α、小鼠骨髓瘤细胞(SP2/0细胞)为本实验室保存。
1.1.2 实验动物 6~8周龄BALB/c小鼠购自河南省实验动物中心。
1.1.3 主要试剂 限制性内切酶、连接酶为MBI公司产品;HRP标记的山羊抗鼠IgG、FITC标记的山羊抗兔IgG为北京希凯创新科技有限公司;RPMI1640液体培养基为Sigma公司产品;脂质体2000为Invitrogen公司产品;小鼠IFN-γELISA检测试剂盒购自上海卓康生物科技有限公司;MTT购自上海华舜生物工程有限公司。
1.2 方法
1.2.1 重组质粒构建 设计合成禽多杀性巴氏杆菌omph基因(1 050 bp,包括信号肽序列)引物,以C48-1菌株全基因组DNA为模板,PCR扩增omph基因,回收后连接pMD18-T载体,序列测定,以KpnⅠ/EcoRⅠ双酶切后亚克隆到真核载体pcDNA3.1(+)的相应位点,构建重组质粒pOMPH。
1.2.2 禽巴氏杆菌外膜蛋白抗血清的制备 超声波裂解法[8]提取多杀性巴氏杆菌总外膜蛋白(Omps),SDS-PAGE检测分子量范围,Bradford法测定蛋白浓度。加入矿物油乳化成疫苗免疫兔子,抗原含量为2mg/m l,每只兔注射1ml,采用背部多点注射,共免疫三次,每次间隔2周,采血检测抗体效价后备用。
1.2.3 重组质粒的瞬时表达 将SP2/0细胞传代于24孔细胞培养板中,待细胞密度达80%时转染重组质粒pOMPH和空载体pCDNA3.1(+),37℃5%CO2培养72小时。收获细胞以间接免疫荧光试验、Western blot和RT-PCR检测其表达情况。
1.2.4 动物免疫 6~8周龄雌性BALB/c小鼠共48只,随机平均分为三组,分别为pOMPH组、pCDNA 3.1(+)空载体组和PBS对照组。
重组质粒体外转染SP2/0细胞,经检测表达成功后,碱裂解法大量制备质粒pOMPH和pCDNA3.1(+),PEG法纯化,溶于 1×PBS(pH7.2)中,分光光度计测定其浓度和纯度并用上述PBS调整浓度为1 μg/μl。将各组疫苗注射于小鼠大腿内侧肌肉,pOMPH组和pCDNA 3.1(+)组免疫剂量均为100 μg/只小鼠,PBS对照组每只小鼠注射100μl1×PBS(pH7.2),共免疫三次,每次间隔两周。
1.2.5 血清性抗体检测 以间接ELISA测定抗体效价,即免疫后每周断尾采血,分离血清,用10μg/m l提取的外膜蛋白包被酶标板,封闭后加入100倍稀释的待检血清,37℃湿盒内作用1.5小时后加入HRP-羊抗鼠IgG作用1.5小时,加入OPD暗室内显色10分钟后用2mol/L硫酸终止反应,在OD490处测定吸收值以确定免疫小鼠血清抗体水平,共检测6周。
1.2.6 淋巴细胞增殖试验 分别于一免两周、二免两周和三免两周后取两只小鼠脱颈处死,无菌采取脾脏制备脾细胞悬液,调整细胞浓度为1×107个/ml。96孔细胞培养板每孔加入脾细胞悬液50μl,同时设阴性对照。试验孔和阴性对照孔各设3个重复,试验孔每孔加入50μl20μg/m l提取的巴氏杆菌外膜蛋白,阴性对照孔每孔加入50μl RPIM1640培养液,置37℃、5%的CO2培养箱培养48小时后,每孔加入5mg/mlMTT 10μl,继续培养3小时。然后每孔加100μl SDS-Hcl,继续作用2小时终止反应,测定OD570吸光值,计算刺激值(SI)=OD(试验孔)/OD(阴性对照孔)。
1.2.7 免疫小鼠IFN-γ水平的测定 三免两周后,杀死小鼠,无菌条件下迅速取出脾脏制备脾淋巴细胞悬液,细胞计数后调整细胞浓度为1×107个/ml。按上述同样方法制备Omps活化的脾淋巴细胞,37℃5%CO2培养箱中培养48小时后,吸取培养上清离心收集后-20℃保存。按照IFN-γ检测试剂盒制作标准曲线,对免疫小鼠脾细胞分泌的IFN-γ进行检测。
1.2.8 攻毒保护试验 三免后两周,各组小鼠腹腔注射禽多杀性巴氏杆菌强毒C48-1菌株进行攻毒,5 LD50/只,观察10天,记录各组小鼠死亡数量。
2 结果
2.1 重组质粒的体外表达 通过提取转染重组质粒和空载体的细胞总RNA,进行RT-PCR扩增,结果表明,转染有pOMPH的细胞中扩增出了大小约为1 050 bp的基因片段,而空载体转染的细胞中未扩增出相应片段(图1A),说明目的基因在真核细胞中进行了转录。间接免疫荧光分析结果表明,转染了重组质粒pOMPH的细胞在倒置显微镜下可见到绿色荧光,而空载体转染的细胞中无荧光出现(图1B、C);Western blot分析显示重组质粒pOMPH转染的SP2/0细胞泳道约38 kD处出现阳性条带,而空载体pcDNA3.1(+)转染的细胞泳道中无该特异性条带出现(图1D)。以上结果表明禽多杀性巴氏杆菌omph基因能通过体外转染途径进入细胞并表达目的蛋白。
2.2 ELISA抗体检测 以提取的外膜蛋白为包被抗原进行间接ELISA试验检测免疫小鼠血清特异性抗体水平,结果如图2所示。
由图2可知,pOMPH组免疫小鼠抗体水平随着免疫次数的增加逐渐上升,从一免后三周开始与两对照组差异极为显著(P<0.01),而PBS组和pCDNA 3.1(+)组小鼠血清抗体水平始终保持在较低水平,两者之间差异不显著(P>0.05),此结果表明重组质粒pOMPH免疫后可诱导机体产生较强的体液免疫应答。
2.3 淋巴细胞增殖试验结果 每次免疫后两周,制备免疫小鼠脾淋巴细胞悬液,MTT法检测其增殖情况,结果如图3所示。一免后pOMPH组的SI值明显高于PBS和pCDNA3.1(+)对照组(P<0.05),二免和三免后DNA疫苗组SI值则极显著高于两对照组(P<0.01)。

图1 omph基因转染 SP2/0细胞的RT-PCR鉴定(A)、免疫荧光检测(B、C)和W estern blot分析(D)Fig.1 The Results of RT-PCR(A),indirect immunofluorescent test(B&C),W estern b lot ana lysis(D)of exp ression p rotein
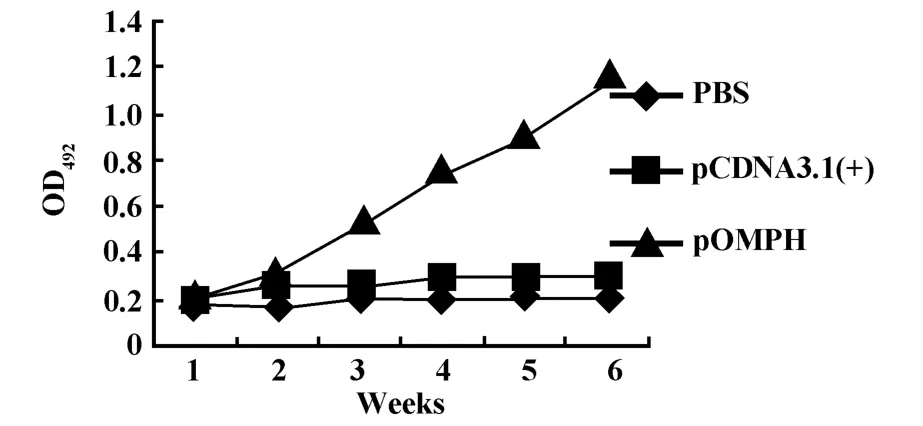
图2 血清抗体水平Fig.2 The dynam ic changes of serum antibody
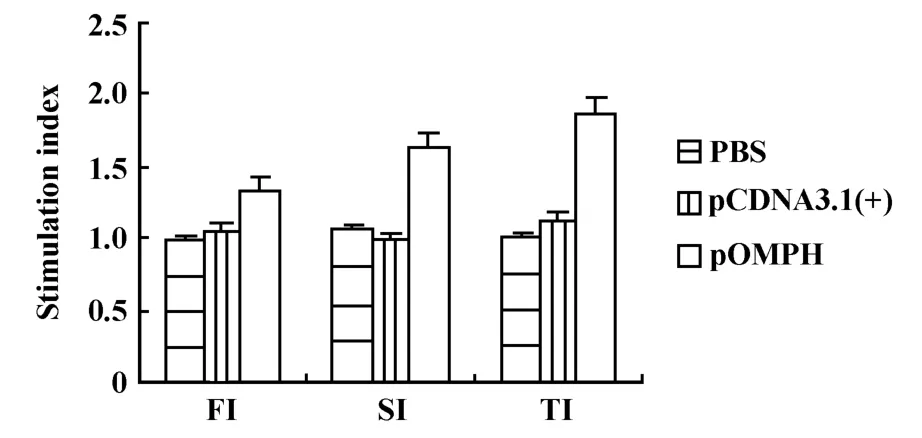
图3 淋巴细胞增殖情况(SI,±s)Fig.3 The lymphocytes proliferation in m ice(SI,±s)

图4 脾淋巴细胞IFN-γ分泌水平Fig.4 The level of specific IFN-γsecred by splenic lymphocy tes induced with OMPs
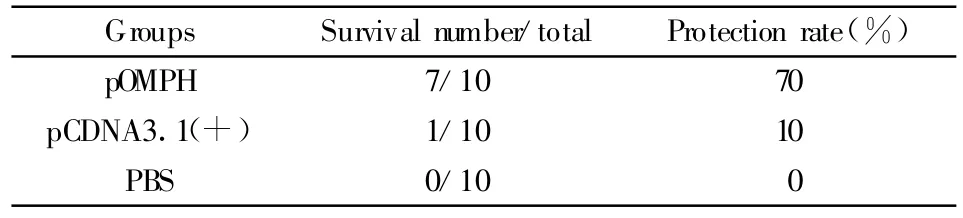
表1 攻毒试验结果Tab.1 Protection of immunized mice against lethal challenge with Pasteurellamuhocida
2.4 IFN-γ分泌水平 三免两周后,同样制备脾淋巴细胞悬液,以提取的外膜蛋白Omps进行诱生,收集上清,检测上清中IFN-γ的量,结果如图4所示。IFN-γ分析结果表明,经omps诱生后pOMPH组分泌的IFN-γ含量约为809 pg/m l,明显高于两对照组(P<0.01),两对照组之间则无明显差异(P>0.05)。
2.5 攻毒试验结果 各组实验动物于三免后两周以多杀性巴氏杆菌强毒进行攻击。十天后,pOMPH组仅有少数小鼠死亡,而pCDNA3.1(+)组和PBS组小鼠几乎全部死亡,各组存活数及保护率如表1所示。
3 讨论
禽多杀性巴氏杆菌病作为影响养禽业发展的重要疫病之一,近些年来已越来越受到人们的重视。目前市售商品化疫苗存在一定的缺陷,导致免疫失败的现象屡见不鲜,为提高免疫保护效果,势必要研制更为有效的新型疫苗。DNA疫苗是上世纪九十年代后发展起来的新型疫苗,具有制备方便、免疫力持久、副作用少等优点,因此成为人们研究的热点。
构建DNA疫苗的关键在于选取有效的保护性抗原基因。研究表明外膜蛋白(Omps)编码基因为致病菌主要的免疫原基因之一。Omps对细菌致病机理和免疫作用机理的探讨已经越来越受到人们的重视,通过对其的深入研究有助于揭示Omps诱发保护反应的机理及其在诱发免疫应答时与免疫细胞的相互作用,并为确定Omps的有效最小抗原结构及研制相应的疫苗奠定基础。Confer等[9]用多杀性巴氏杆菌接种实验动物,刺激其产生抗多杀性巴氏杆菌Omps的抗体,并用ELISA方法检测其效价,结果发现有6种Omps血清抗体与抵抗攻毒有关,并可增强巨噬细胞的吞噬能力和活化补体,抑制细菌与宿主的粘附,提示Omps在保护多杀性巴氏杆菌感染方面有着重要的作用。
多杀性巴氏杆菌Omps包括主要蛋白和微量蛋白两种,两者在细胞中的拷贝数含量差别较大。主要蛋白包括外膜A蛋白(OmpA)、外膜蛋白H(OmpH)等。OmpH是多杀性巴氏杆菌最主要的微孔蛋白,也是多杀性巴氏杆菌的一种保护性抗原,免疫保护实验表明OmpH蛋白能够诱导机体产生较高水平的免疫应答[10-12]。Luo等克隆了OmpH蛋白编码基因,试验显示它具有微孔蛋白活性,用重组的OmpH免疫试验动物,其保护率几乎为100%,与全菌诱导的保护率相当,进一步的研究表明,来源于不同血清型的OmpH蛋白具有高度的同源性,因此其具有交叉保护性[13]。由此可见,以禽多杀性巴氏杆菌OmpH构建的疫苗有望为禽类提供较好的保护效果。
机体对抗多杀性巴氏杆菌感染的过程中,体液免疫应答具有至关重要的作用,重组亚单位疫苗由于可诱导较高水平的抗体应答,因此过去人们主要致力于此类疫苗的研究。然而,目前已知细胞免疫应答在抗多杀性巴氏杆菌免疫中也具有举足轻重的作用,而DNA疫苗则可有效地诱导细胞免疫反应。本实验对pOMPH DNA疫苗免疫后诱导的体液和细胞免疫应答进行了检测,结果表明该DNA疫苗可刺激产生较高水平的免疫应答。攻毒试验结果进一步表明该疫苗可为实验动物提供一定的保护力。因此,以外膜蛋白H编码基因构建的DNA疫苗在抗禽多杀性巴氏杆菌病方面表现出了一定的应用前景。
本研究成功构建了禽多杀性巴氏杆菌omph DNA疫苗pOMPH,动物实验表明该疫苗可诱导实验动物产生较强的体液和细胞免疫应答,并可为免疫小鼠提供较高的保护率,从而为禽巴氏杆菌病新型疫苗的研究提供了一定的理论依据。
1 Mariana S,Hirst R.The immunogenicity and pathogenicity ofPasteurella multocidaisolated from poultry in Indonesia[J].VetMicrobijol,2000;72(1-2):27-36.
2 Liao CM,Huang C J,Hsuan S Letal.Immunogenicity and efficacy of three recombinant subunitPasteurellamultocidatoxin vaccines against progressive atrophic rhinitis in pigs[J].Vaccine,2006;24(1):27-35.
3 Sthitmatee N,Numee S,Kawamoto Eetal.Protection of chickens from fow l cholera by vaccination with recombinant adhesive protein ofPasteurellamultocida[J].Vaccine,2008;26(19):2398-2407.
4 Dabo SM,Confer A,Montelongo Metal.Vaccination withPasteurella multocidarecombinantOmpA induces strong but non-protective and deleterious Th2-type immune response inm ice[J].Vaccine,2008;26(34):4345-4351.
5 Hsuan SL,Liao CM,Huang Cetal.Efficacy ofa novelPasteurellamultocidavaccine against progressive atrophic rhinitis of swine[J].Vaccine,2009;27(22):2923-2929.
6 Register K B,Sacco RE,Brockmeier S L.Immune response in mice and swine to DNA vaccines derived from thePasteurellamultocidatoxin gene[J].Vaccine,2007;25(32):6118-6128.
7 Hsuan S L,Liao C M,Huang C Jetal.Efficacy of a novel Pasteurella multocidavaccine against progressive atrophic rhinitis of swine[J].Vaccine,2009;27(22):2923-2929.
8 胡晓娜,朱瑞良,刘红珍etal.禽波氏杆菌外膜蛋白的提取及其免疫原性的检测[J].微生物学报,2007;47(7):714-717.
9 ConferAW,金光明.牛对多杀性巴氏杆菌A:3外膜蛋白的抗体反应[J].国外兽医学—畜禽传染病,1998;18(1):34-36.
10 Bosch M,TarragóR,Garrido M Eetal.Expression of thePasteurella multocidaompHgene is negatively regulated by the Fur protein[J].FEMSM icrobiol Lett,2001;203(1):35-40.
11 Antony P X,Nair GK,Jayaprakasan Vetal.A simple protocol for amplification ofgenes from inactivated oiladjuvant fow l cholera vaccine[J].Int JPoul Sci,2006;5(7):623-626.
12 李良军,黎 璐,李 健etal.猪源产毒素多杀性巴氏杆菌HN-13株外膜蛋白H的基因克隆与特征[J].农业生物技术学报,2007;15(2):30-33.
13 Luo Y,Glisson JR,Jackwood MWetal.Cloning and characterization of themajor outermembrane protein gene(OmpH)ofPasteurellamultocidaX-73[J].JBacteriol,1997;179(24):7856-7864.
[收稿2009-09-17 修回2009-11-04]
(编辑 张晓舟)
The immune efficacy ofOmpH DNA vaccine from avian Pasteurellamultocida
GONGQiang,NIUMing-Fu,WANGShuai-Tao,QINCui-Li,SUNXiao-Fei,MALi-Ping,HOUYu-Ze.HenanUniversityofScience&Technology,Luoyang471003,China
Objective:To research on protective immunity of omph DNA vaccine against avian Pasteurella multocida in mice.Methods:The omph gene fragmentamplified by PCR from avian Pasteurellamultocida was cloned into pMD18-T.Subsequently itwas subcloned into the eukaryotic expression vector pcDNA3.1(+),and the recombinant p lasmid pOMPHwasobtained.Then the recombinantplasmid was transfected into SP2/0 cells in vitro.The transcription and expression of targetgene were analyzed by RT-PCR,Western blot analysis and indirect immunofluorescence.Three groups of BALB/cmice(n=16)named pOMPH,pCDNA3.1(+)and PBSwere intramuscu larly vaccinated with the recombinant plasm id,control vector and PBS respectively.The serum antibodies were detected by indirect ELISA.The spleen lymphocyte proliferation(SLP)and secreted IFN-γof spleenwere tested byMTT.Them icewere challenged with virulentofavian Pasteurellamultocida on week 2 post the third immunization,the protection ratewere counted.Results:RT-PCR,Western blotanalysis and indirect immunofluorescence showed that the omph gene could be transfected into SP2/0 cells in vitro and expressed the targetprotein.Indirect ELISA showed that the levels of antibodiesin pOMPH group weremost significantly higher than in theothergroups(P<0.01).Spleen lymphocyte p roliferationbyMTTassay indicated that the SIvalue inducedwith avian Pasteurellamultocida Ompsin pOMPH groupwashigher than those in pCDNA3.1(+)and PBS groups(P<0.05).The IFN-γexperiments(Double-antibodies-sandwich-ELISA)showed that the levels of IFN-γinduced with Omps in the group of pOMPHwasmostly higher than in theother controlgroups apperent(P<0.01).The protection rateof pOMPH(70%)was better than in the othergroups.Conclusion:The omph DNA vaccine against avian Pasteurellamultocida had been constructed successfu lly.The DNA vaccine could enhance the immunity level and the protective effectof the vaccinatedmice.Presentstudymay be useful for the developmentof avian Pasteurellamultocida vaccine.
avain Pasteurellamuhocida;omph DNA vaccine;Immune response;Protective effect
S855.1
A
1000-484X(2010)01-0013-05
①本文为河南省重点科技攻关计划项目(092102110162)
宫 强(1979年-),男,博士,讲师,硕士生导师,主要从事兽医分子生物学与免疫学研究,E-mail:qianggong79@yahoo.com.cn。
·肿瘤免疫学·