黄芪皂苷Ⅱ成分对三阴性乳腺癌细胞增殖及侵袭转移的抑制作用研究
2025-02-19殷生楠高一戴怀洋王刚殷勇
摘 要:目的" 探究三萜皂苷黄芪皂苷Ⅱ(Astragaloside Ⅱ , ASⅡ)对三阴乳腺癌(Triple negative breast cancer,TNBC)细胞增殖及侵袭转移的作用及可能的机制。方法" 采用MTT法检测黄芪皂苷Ⅱ(0.78μM、1.56μM、3.12μM、6.25μM、12.5μM、25μM、50μM、100μM)对MDA-MB-231细胞增殖的影响;采用Transwell法及划痕实验分别检测黄芪皂苷Ⅱ对MDA-MB-231细胞转移及侵袭的影响;采用Western blot检测PI3K/AKT/mTOR通路蛋白的表达水平,从而阐明其调控PI3K/AKT/mTOR通路的分子机制。结果" 25μM黄芪皂苷Ⅱ显著抑制MDA-MB-231细胞增殖,选用未影响细胞增殖的药物浓度3.12μM、6.25μM、12.5μM作为低、中、高药物浓度;与对照组相比,黄芪皂苷Ⅱ呈浓度依赖性地抑制MDA-MB-231细胞的侵袭与转移;同时,该成分抑制MDA-MB-231细胞PI3K、AKT、mTOR蛋白磷酸化水平。结论" 黄芪皂苷Ⅱ可能通过调控PI3K/AKT/mTOR通路抑制MDA-MB-231细胞增殖、侵袭及转移。
关键词:黄芪皂苷Ⅱ;三阴性乳腺癌;转移;PI3K/AKT/mTOR通路
中图分类号:R285.5,R737.9 " " 文献标志码:A 文章编号:1671-0142(2025)01-0063-04
乳腺癌作为威胁世界女性的恶性肿瘤之一,长期占据女性恶性肿瘤发病率的之首,在女性所有癌症相关的死亡中仅次于肺癌。乳腺癌所有病理类型中,三阴性乳腺癌约占15%~20%。同其他类型乳腺癌相比,对该类型乳腺癌缺乏针对性的靶向药物,且内分泌治疗无效。此外,三阴性乳腺癌具有强侵袭性,远处转移风险高,内脏及脑易转移等特点,因而其预后差,死亡风险较高[1]。目前,手术和化疗是临床上治疗三阴性乳腺癌治疗的主要手段,但效果并不理想,寻找治疗三阴性乳腺癌的有效方法势在必行。
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)是一类具有丝氨酸/苏氨酸激酶活性的蛋白激酶,参与了细胞生长、增殖、分化、运动和代谢等功能。磷酸化受体酪氨酸激酶的酪氨酸残基可使其与PI3K调控亚基p85相互作用,激活催化亚基p110,后者能催化PIP2转化为PIP3,而PIP3将作为第二信使通过磷酸化激活蛋白激酶B,即激活AKT。激活的AKT会介导下游包括mTOR、GSK3β在内的多个靶点的激活或抑制,通过多种机制实现对细胞功能的调控。在大约70%的乳腺癌中,PI3K/AKT信号通路被过度激活[2],因此该通路已成为乳腺癌治疗的一个有效靶点。由于三阴性乳腺癌中抑癌基因PTEN的缺失及编码p110亚基的PIK3CA基因的突变,PI3K被过度激活,引发下游信号激活放大,进而促进癌细胞的生长和增殖[3],因此,抑制PI3K/AKT信号通路可能成为三阴性乳腺癌治疗的一个有希望的途径。
我国药用植物资源丰富,从有应用背景的传统药用植物中寻找具有抗三阴性乳腺癌的活性物质具有重要意义,课题组前期从药用植物刺楸中首次发现了以3-羰基常春藤皂苷元和阿江榄仁酸为苷元的三萜皂苷类成分[4],该植物中皂苷类成分具有抗肿瘤、抗炎、抗糖尿病及抗真菌作用。刺楸皂苷A能够通过线粒体依赖性途径诱导MDA-MB-231细胞凋亡,该细胞中被激活的PI3K/AKT信号通路受到了抑制。基于以上研究,本课题拟在前期研究的基础上,基于PI3K/AKT/mTOR信号通路探讨三萜皂苷成分黄芪皂苷Ⅱ对三阴性乳腺癌细胞增殖及侵袭转移的抑制作用,为临床乳腺癌的治疗提供新的途径。
1 材料
1.1 MDA-MB-231细胞购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂 黄芪皂苷Ⅱ购自江苏永建医药科技有限公司(5mg/支,纯度大于98%,批号:100723);DMSO购自国药集团化学试剂有限公司;DMEM基础培养基和胎牛血清分别由美国Hyclone公司和Gibco公司生产;RIPA裂解液和PMSF蛋白酶抑制剂由北京鼎国公司生产(批号:89100146);ECL化学发光检测试剂盒由圣尔生物制造(批号:20180810);BCA蛋白浓度测定试剂盒及MTT试剂均采购自南京诺唯赞生物科技有限公司;PI3K抗体购自ABclonal公司(批号:4292)、p-PI3K抗体来源于CST公司(批号:17366)、AKT抗体(批号:A17909)、p-AKT抗体(批号:AP1259)、mTOR抗体(批号:A2445)、p-mTOR抗体(批号:AP0115)均购自ABclonal公司;二抗(兔二抗:ABclonal公司,批号为AS014)。
1.3 仪器 细胞培养箱由上海力申科学仪器有限公司供应;酶标仪的制造商为美国Molecular Devices公司;荧光倒置显微镜的生产商是日本奥林巴斯有限公司;化学发光成像仪(上海天能生命科学有限公司)。
2 方法
2.1 MTT法检测黄芪皂苷Ⅱ对MDA-MB-231细胞增殖的作用 MDA-MB-231细胞放置于一种特定的完全培养基中,该培养基以DMEM为基础,并补充10%的胎牛血清、青霉素和链霉素。PBS清洗3遍,用胰酶处理后离心后计数,细胞计数4×104cells/mL,接种于96孔板,其中每孔被加入200 μL悬液,在37℃、5% CO2的条件下培养12至24小时,观察细胞形态确保正常生长。实验分为对照组及黄芪皂苷Ⅱ0.78 μM、1.56 μM、3.12 μM、6.25 μM、12.5 μM、25 μM、50 μM、100 μM组。每组均设6个重复孔。移除各孔中的培养基上清液,向每个孔内添加100μL的DMEM基础培养基以及10μL的MTT溶液(浓度:5mg/mL),继续培养4h。培养结束后,再次移除上清液,并向每个孔中加入150μL的二甲基亚砜(DMSO)。轻轻震荡10分钟后,使用570 nm波长的光度计测量吸光度(A)值。细胞的相对增殖率可通过以下公式进行计算:细胞相对增殖率(%)=给药孔OD值/对照孔OD值×100%。
2.2 Transwell细胞迁移实验 实验前对MDA-MB-231细胞进行无血清处理促进细胞饥饿,持续时间为24小时,选择处于对数增长阶段的细胞,按照每孔1 × 105个细胞的密度、100μL的细胞悬浮液接种于上室,向下室各孔加入600μL含有20%胎牛血清(FBS)的培养基,并于上室后加入终浓度为3.12μM、6.25μM、12.5μM的MDA-MB-231细胞以及等体积DMSO溶剂对照,继续培养24小时。培养结束后,使用棉签轻轻清除上室中的细胞,用PBS洗涤3次,每次持续5分钟,下室细胞用0.1%甲醇结晶紫染液进行固定染色30分钟。染色完成后,再次用PBS溶液洗涤并晾干小室。最后,在倒置显微镜下,使用100倍物镜随机选取上下左右共5个视野,拍摄照片以观察和评估细胞的跨膜迁移情况。
2.3 划痕实验 取对数增殖期的MDA-MB-231细胞,将其制备成单细胞悬浮液,按照每孔5×105个细胞的密度及每孔2mL的体积接种于六孔板,在显微镜下观察到细胞已生长并发生融合后,更换为不含血清的培养基,并持续培养24小时,以便进行后续的划痕测试。利用培养板板盖顶住一支200 μL的无菌黄色枪头进行操作,垂直于板底面并沿孔板中线处迅速划出一条细细的直线,并保证划痕的宽度一致,于倒置显微镜下拍摄初始时间的细胞状态和宽度。其后,弃去培养液,用PBS洗去细胞碎片后,加无血清培养基,加入3.12μM、6.25μM、12.5μM的黄芪皂苷Ⅱ以及等体积DMSO溶剂对照。24小时后,PBS洗涤3次,拍照观察细胞生长状态及划痕宽度。
2.4 Western blot检测蛋白表达 取对数生长期的MDA-MB-231细胞,接种于6孔板。培养24小时后,各组分别给予等体积DMSO及 3.12μM、6.25μM、12.5μM黄芪皂苷Ⅱ。继续培养24小时,PBS清洗3遍,冰上进行细胞裂解,裂解完成后,通过离心分离细胞碎片,收集上清液,将上清液与5倍体积的loading buffer以1:4的比例混合均匀,并将混合物在100℃条件下加热10分钟,以完成变性处理步骤。样品保存于-20 ℃。蛋白样品上样量25 μg,电泳条件为150v,60 min,转膜条件为320mA,200min。加入一抗(PI3K、AKT、mTOR及对应的磷酸化蛋白),4 ℃孵育过夜,在室温条件下,将二抗孵育2h。孵育步骤结束后,利用TBST溶液对样本进行洗涤处理,以有效去除未与抗原结合的抗体。洗涤后,采用ECL发光试剂对蛋白质条带执行显影操作。为了精确量化条带的灰度值,运用ImageJ软件进行图像分析。
2.5 统计学分析 实验数据采用GraphPad Prism 8软件处理分析。分析结果以平均值±标准差的形式呈现。为了比较不同组之间的差异,采用了单因素方差分析(ANOVA)。在进行组间样本均值的比较时,使用了LSD-t检验作为后续的多重比较方法。
3 结果
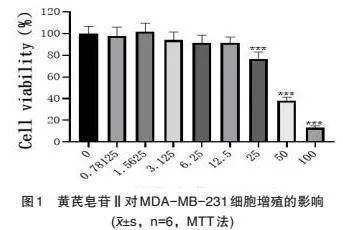
3.1 黄芪皂苷Ⅱ对MDA-MB-231细胞增殖作用 采用不同浓度梯度的黄芪皂苷Ⅱ干预MDA-MB-231细胞,对照组采用等量的DMSO溶液,培养24小时后,MTT结果显示(图1),黄芪皂苷Ⅱ浓度低于25μM对MDA-MB-231细胞增殖无影响,浓度≥25μM显著抑制细胞增殖(Plt;0.001),故选用黄芪皂苷Ⅱ浓度3.12μM、6.25μM、12.5μM用于后续对MDA-MB-231细胞转移的作用的研究。
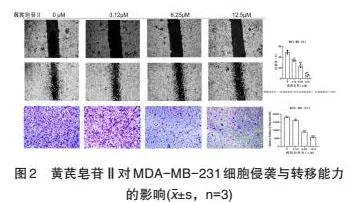
3.2 黄芪皂苷Ⅱ对MDA-MB-231细胞的侵袭与转移的影响 选用不抑制细胞增殖的黄芪皂苷Ⅱ浓度3.12μM、6.25μM、12.5μM干预MDA-MB-231细胞,划痕实验结果显示(图2A),与对照组比较,黄芪皂苷Ⅱ作用后,MDA-MB-231细胞转移能力显著下降,(Plt;0.01或Plt;0.001)并呈浓度依赖性;Transwell实验结果显示(图2B),黄芪皂苷Ⅱ作用后,MDA-MB-231细胞侵袭能力显著下降(Plt;0.05或Plt;0.001),结果呈浓度依赖性。综上可见,黄芪皂苷Ⅱ能够在不影响细胞增殖的情况下,显著抑制MDA-MB-231细胞的侵袭与转移能力。
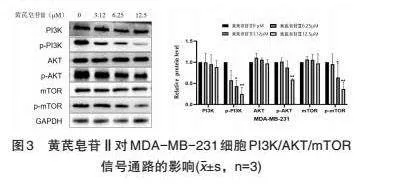
3.3 黄芪皂苷Ⅱ通过PI3K/AKT/mTOR通路影响MDA-MB-231细胞侵袭与转移 Western blot结果表明(图3),黄芪皂苷Ⅱ浓度6.25μM抑制p-PI3K、p-mTOR的表达(Plt;0.05),12.5μM显著抑制p-PI3K、p-AKT、p-mTOR蛋白表达(Plt;0.01)。因此,黄芪皂苷Ⅱ抑制PI3K/AKT/mTOR信号通路激活,从而抑制MDA-MB-231细胞的侵袭与转移。
4 讨论
研究表明[5],乳腺癌的发病率在全球女性癌症中占第一位,三阴性乳腺癌作为乳腺癌的一种,对靶向和内分泌治疗不敏感,且其自身的高侵袭转移能力,最终导致预后较差,死亡风险较高。目前临床尚无可靠的三阴性乳腺癌转移的防治方法,而中医药凭借其独特的辩证论治理论在肿瘤转移中发挥关键性作用。近年来,中药凭借多靶点优势、治疗效果明显、毒副作用小等优点,备受研究者的关注。黄芪皂苷Ⅱ是传统中药黄芪中主要有效成分之一,研究发现[6,7],黄芪皂苷具有升阳、固表、补中益气的功效,能有效增强机体特异及非特异性免疫功能和抗肿瘤。
本研究结果发现,三阴性乳腺癌细胞MDA-MB-231增殖活力随黄芪皂苷Ⅱ的剂量而改变,黄芪皂苷Ⅱ的剂量越高,其对MDA-MB-231的增殖抑制作用就越强。划痕实验结果发现,黄芪皂苷Ⅱ作用后,MDA-MB-231细胞转移能力显著下降;Transwell实验结果发现,给予黄芪皂苷Ⅱ后,MDA-MB-231细胞侵袭能力显著下降。因此,中黄芪皂苷Ⅱ能够显著抑制MDA-MB-231细胞的侵袭与转移能力。
PI3K/AKT/mTOR信号通路在乳腺癌疾病发展过程中发挥重要作用,参与了细胞的分化、增殖、凋亡等过程[8,9]。PI3K脂类激酶及其下游分子AKT参与调控多种酪氨酸激酶受体激活的致癌信号通路。酪氨酸激酶在细胞内异常高表达进而激活下游信号通路,其基因表达水平与乳腺癌的生长及转移有关[10]。本实验结果显示,黄芪皂苷Ⅱ浓度6.25μM抑制MDA-MB-231细胞p-PI3K、p-mTOR蛋白的表达,12.5μM显著抑制MDA-MB-231细胞p-PI3K、p-AKT、p-mTOR蛋白的表达,说明黄芪皂苷Ⅱ能不同程度的抑制MDA-MB-231细胞PI3K/AKT/m TOR信号通路的激活。
综上,黄芪皂苷Ⅱ可以明显降低MDA-MB-231细胞增殖、细胞的侵袭与转移,同时会明显降低细胞p-PI3K、p-AKT、p-mTOR蛋白表达,且具有剂量效应。因此,黄芪皂苷Ⅱ抑制三阴性乳腺癌MDA-MB-231细胞增殖、侵袭及迁移,可能是通过抑制PI3K/AKT/mTOR信号通路的激活来发挥抗肿瘤作用,本研究将为三萜皂苷类活性物质临床抗肿瘤应用提供实验基础。
参考文献:
[1] Harbeck N,Gnant M. Breast Cancer[J].Lancet,2017,389(10074):1134-1150.
[2]Dey N, De P, Leyland-Jones B. PI3K-AKT-mTOR inhibitors in breast cancers: From tumor cell signaling to clinical trials[J].Pharmacol Ther,2017,175:91-106.
[3]Khan M A, Jain V K, Rizwa1ah M, et al. PI3K/AKT/mTOR pathway inhibitors in triple-negative breast cancer: a review on drug discovery and future challenges[J]. Drug Discovery Today,2019,24(11):2181-2191.
[4]Yao H,DuanJ, WangJ, LiY. Triterpenoids and their saponins from the roots of Kalopanax septemlobus[J]. Biochem Syst Ecol,2012(42):14-17.
[5]郑红梅,冯尧军,许娟,等.免疫治疗研究进展及其在三阴性乳腺癌中的应用[J].肿瘤防治研究,2020,47(11):889-893.
[6]唐冕,许晓芬.药用黄芪皂苷类化学成分及药理作用研究进展[J].中医药导报,2018,24(20):117-122.
[7]谭艳芳,张艳冰,万红霞,等.黄芪总皂苷调控LKB1/AMPK信号通路对人乳腺癌细胞增殖、凋亡、周期的影响及机制[J].中国老年学杂志,2023,43(2):388-391.
[8]Malayil R, Chhichholiya Y, Vasudeva K, et al. Oncogenic metabolic reprogramming in breast cancer: focus on signaling pathways and mitochondrial genes[J]. Med Oncol,2023,40(6): 174.
[9]杨鑫,佟仲生,赵伟鹏.三阴性乳腺癌中PI3K/AKT/mTOR信号通路的突变及相关靶向治疗的研究进展[J].中国肿瘤生物治疗杂志,2024,31(4):397-403.
[10]Ellis H,Ma CX.PI3K inhibitors in breast cancer therapy[J].Curr Oncol Rep,2019,21(12):110-117.
(责任编辑 刘 红)
