备案制实施后江西省药物临床试验机构管理现状及项目承接情况分析
2025-02-15姜敏林莉甘晨曦孙文雄许清松赵秀丽

关键词药物临床试验机构;备案制;管理状况;项目承接
2017年10月,中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[1]明确提出临床试验机构实行备案管理。为响应该意见要求,根据新修订《药品管理法》,2019年11月,国家药监局与国家卫生健康委联合发布了《关于发布药物临床试验机构管理规定的公告》[2],确定自2019年12月1日起药物临床试验机构由资格认定改为备案管理,即药物临床试验机构管理由“认定制”改为“备案制”。由于备案条件要求相对简单,多家医院积极参与备案。笔者查询药物临床试验机构备案管理信息平台发现,在备案制实施以前,截至2018年,全国由资格认定获得资质的药物临床试验机构(以下简称“机构”)不到900家,但备案制实施以后,截至2023年,累计备案的机构数量已接近1500家。但在认定制实施期间获得资质的机构(以下简称“老机构”)和仅在备案制实施期间获得资质的机构(以下简称“新机构”)管理现状如何、承接临床试验项目的情况如何,尚不清楚。鉴于江西省老机构和新机构的机构数量和专业数量均在全国各省份中处于中游位置[3―4],因此中国药理学会药物临床试验专业委员会以江西省作为试点省份,对备案制实施后江西省老机构和新机构的管理现状和承接药物注册临床试验情况进行调研和分析,以便更好地推动江西省乃至全国临床试验机构尤其是新机构的规范化管理,为我国药物临床试验的健康发展提供一定的保障。
1 资料与方法
1.1 调查对象
本研究的主要调查对象为江西省内已完成药物临床试验机构资质备案1年以上的38家医疗机构。参与调研填表的均为药物临床试验机构办公室(以下简称“机构办”)管理人员。
1.2 问卷调查及资料收集
利用“问卷网”制作调查问卷,并通过微信发放,主要针对机构基本情况、备案的专业数量和主要研究者(principalinvestigator,PI)数量、组织管理机构硬件和信息化建设情况[包括机构办是否为医院独立科室、机构办是否具备独立办公场所、试验药物管理模式和临床研究管理系统(ClinicalTrailManagementSystem,CTMS)使用情况]、人员配置及培训情况[包括机构办专职管理人员人数、机构办质量控制员人数、开展药物临床试验质量管理规范(goodclinicalpractice,GCP)集中培训情况和研究者接受GCP集中培训意愿及效果评价情况]、机构承接药物注册临床试验数量(包括2023年承接试验项目数、近3年承接试验项目数和自获临床试验资质以来承接试验项目数)等方面开展调研。调查时间为2024年1月5-18日。
1.3 统计学处理
采用描述性统计方法对调查资料进行分析。定量资料采用M(P25,P75)表示,定性资料用频数和百分比表示。统计软件为SPSS24.0。
2 结果
2.1 医院基本情况调查结果
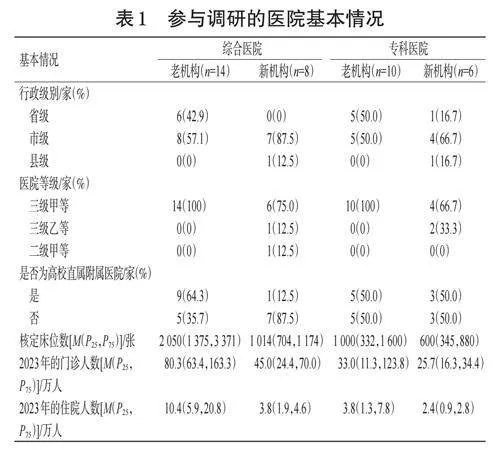
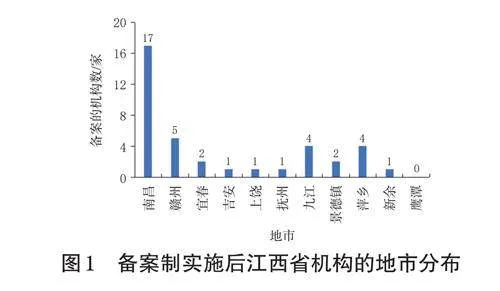
本次调研问卷共发放给38家机构,回收问卷38份。其中,老机构24家、新机构14家,综合医院22家、专科医院16家。参与此次调研的机构分布于江西省南昌市、赣州市、宜春市、吉安市等多个地级市(图1)。其中,省级医院12家(31.6%),市级医院24家(63.2%),区县级医院2家(5.3%);三级甲等医院34家(89.5%),三级乙等医院3家(7.9%),二级甲等医院1家(2.6%);高校附属医院18家(47.4%)。
参与调研的医院基本情况见表1。由表1可见,无论是综合医院还是专科医院,老机构的行政级别、医院等级均高于新机构,且前者多为高校直属附属医院;此外,老机构的核定床位数、门诊人数和住院人数均多于新机构。
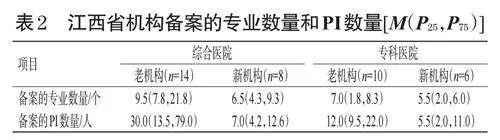
2.2 备案的专业数量和PI数量情况
调查结果显示,无论新机构还是老机构,均按照《药物临床试验机构管理规定》要求对专业和PI进行了备案,备案的专业数量和PI数量见表2。由表2可见,无论是综合医院还是专科医院,老机构备案的专业数量和PI数量均多于新机构。
2.3 组织管理机构硬件和信息化建设情况
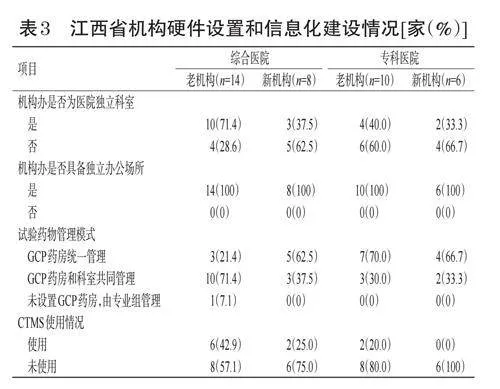
在硬件方面,老机构和新机构均具备独立的办公场所。新机构均设置了GCP药房,而老机构尚有1家医院未设置GCP药房;在信息化建设方面,新机构中使用CTMS的医院比例明显较老机构低。结果见表3。
2.4 人员配置及培训情况
在综合医院层面,老机构中机构办专职管理员人数和机构办质量控制员人数明显多于新机构;而在专科医院层面,老机构中机构办专职管理员人数明显多于新机构,但老机构中机构办质量控制员人数明显少于新机构。在人员培训方面,新机构的开展情况好于老机构,新机构每年均会开展GCP集中培训,而有不少老机构仅偶尔开展;并且新机构中研究者接受GCP集中培训的意愿更强,培训效果也更好。结果见表4。
2.5 机构承接药物注册临床试验项目情况
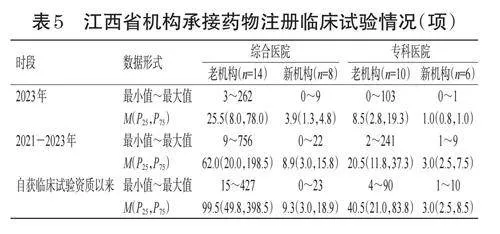
无论是综合医院还是专科医院,老机构承接的临床试验项目数量总体而言要多于新机构。结果见表5。
3 讨论
药物临床试验机构资格管理由认定制改为备案制,这项改革举措是响应国务院“简政放权”号召的重要体现。该措施非常有利于释放药物临床试验资源,因此全国各大医院积极参与,多个省份临床试验机构数量呈现快速增长[5―10]。这解决了我国药物临床试验数量日益增长与临床试验机构及专业数量严重不足的矛盾,可加快我国医药研发的发展速度。但由于备案制对于机构的备案条件要求相对简单,如二级甲等及以上的医院即可申请备案,且备案首次监督检查是“省检”而不是“国检”,医院重视程度相对较低,导致未曾接受过药物临试验机构资格认定的新机构存在管理水平和临床试验研究能力不高,遵循GCP等法规意识薄弱等诸多问题[11―13]。这必定会为以后临床试验工作留下较大质量安全隐患,也给省级药品监督管理部门的日常监管带来挑战。为此,本研究对机构管理现状和承接药物注册临床试验情况进行调研和分析具有较大意义。
此次调研的对象为江西省内已完成机构资质备案1年以上的机构,其中既有综合医院,也有如肿瘤医院、妇幼保健院、皮肤病医院等在内的专科医院,分布于全省境内几乎所有的地级市。被调研机构的医院行政级别构成比、医院等级构成比与全国其他省份相似[5―10],具有较好的代表性,这也说明以江西省作为试点调研省份是合适的。基于综合医院和专科医院情况不同,且目前仅见有备案前后机构总体大致情况分析比较的报道[4―10],因此,本研究从综合医院和专科医院2个层面分别就老机构和新机构的基本情况、机构硬件和信息化建设情况、人员配置及培训情况及承接临床试验情况等方面进行调研。
调研结果显示,无论是综合医院还是专科医院,老机构的医院行政级别、医院等级均高于新机构,且前者多数为高校直属附属医院;此外,其核定床位数、门诊住院人数、备案的专业数量和PI数量均多于新机构。张娟利等[7]的调研结果显示,陕西省药物临床试验机构在备案的专业数量和PI数量上也呈现出老机构要明显多于新机构的情况。这与认定制对医院和专业组整体实力要求更高有关。比如,尽管资格认定时没有对医院的等级提出要求,但业内普遍认为只有三级甲等医院能申请资格认定,而备案制对医院等级的要求仅为二级甲等及以上的医院。
在机构硬件和信息化建设、人员配置及培训方面尚未见有老机构和新机构比较的文献报道。本调研结果显示,在机构硬件方面,综合医院新机构在GCP药房硬件设置方面投入相对较多。在CTMS方面,使用的新机构数量明显较老机构要少,这可能与部分新机构临床试验项目承接不多,使用CTMS没有那么迫切有关。在人员配置及培训方面,综合医院老机构中机构办专职管理员人数和机构办质量控制员人数明显多于新机构;而在专科医院层面,老机构中机构办质量控制员人数明显少于新机构。在人员培训方面,新机构的开展情况明显好于老机构,新机构每年均会开展GCP集中培训,而有不少老机构仅偶尔开展;并且新机构中研究者接受GCP集中培训的意愿更强,培训效果也更好,这可能与专科医院新机构创建机构的积极性高,在人员配置和人员培训方面投入更多有关。
在承接药物注册临床试验项目情况方面,本调查结果显示,无论是综合医院还是专科医院,老机构承接的项目数据均多于新机构。张娟利等[7]的调研结果显示,陕西省也存在老机构承接项目多于新机构的情况。张勋等[10]的调研结果显示,广东省2020-2022年累计备案了41家新机构,这41家新机构3年累计承接项目仅69项。这可能是因为老机构相较于新机构具有更为完善的管理制度、更先进的设施设备,并具有经验更为丰富的研究团队等优势,申办方更倾向于选择老机构[12]。
综上所述,江西省新机构尽管硬件设置投入更多,研究人员积极性也高,但医院整体实力不强,备案的专业数量和PI数量也较少,承接药物临床试验数量明显少于老机构。因此,笔者建议新机构应进一步加强内涵建设,争取承接更多的临床试验项目,通过规范化运行实施临床试验,进一步促进临床试验研究水平和管理水平的提高,从而形成良性循环;同时也建议政府部门、申办者和机构等各方应积极配合,主动作为,切实采取有效措施,促进新老机构在药物临床试验方面均衡、高质量发展。
