肝移植后免疫抑制剂与肠道菌群相互作用的研究进展
2025-02-15鲁赛娟宋沧桑李兴德王国徽毛盼盼
关键词免疫抑制剂;肠道菌群;肝移植;他克莫司;环孢素;麦考酚酯;糖皮质激素
肝移植后,排斥反应是不可避免的病理生理过程,也是导致移植失败的主要原因之一,其机制复杂,涉及众多的分子和信号通路。免疫抑制剂是对机体的免疫反应具有抑制作用的药物,能抑制免疫细胞(T细胞、B细胞和巨噬细胞等)的增殖和功能,从而抑制免疫反应。免疫抑制剂虽然会引起高血压、感染、高脂血症等多种不良反应,但却是预防排斥反应的首选药物,能提高受者和移植物的存活率[1]。目前临床使用的免疫抑制剂主要有糖皮质激素、类固醇、钙调神经磷酸酶抑制剂(环孢素、他克莫司)、抗代谢药(吗替麦考酚酯、硫唑嘌呤)和哺乳动物雷帕霉素靶蛋白(mammaliantargetofrapamycin,mTOR)抑制剂(西罗莫司、依维莫司)等。肝移植后的免疫抑制治疗方案尚无统一标准,免疫抑制个体化治疗是目前研究的难点和方向[1]。
肠道菌群可以促进免疫系统的发育,激活免疫系统,其失调与一些疾病的发生和发展密切相关。肠道菌群的失衡会通过能量吸收、胆碱、短链脂肪酸、脑-肠轴、胆汁酸等多种途径影响宿主的健康[2]。研究结果表明,肠道菌群可影响精神分裂症、多发性硬化症、肝脏疾病等多种疾病的发生发展[3],但具体机制尚不清楚。本文主要综述了肝移植后免疫抑制剂与肠道菌群之间的相互作用,以期为临床用药提供一定的依据,帮助优化免疫抑制治疗方案,同时减少药物不良反应。
1 肝移植对肠道菌群的影响
研究表明,肝移植与肠道生态失调有关,其特征是总细菌量和有益细菌(如双歧杆菌、普氏栖粪杆菌和乳酸菌属)减少,肠杆菌科和肠球菌属细菌增加[4]。肝移植患者术后感染的发生率为47%~80%,病死率高达13%~36%,以肠道感染最为常见[5]。肝移植可破坏肠道屏障,使内毒素和细菌进入血液或腹腔,从而导致肠道感染[5];同时,肝移植术中存在无肝期,肝移植术后早期肝功能恢复也需要时间,门静脉血流阻断、重建会导致肠道血液回流淤滞,因此肝移植后早期肠道菌群失调的风险较高[6];而且,血液循环受阻会导致肠道屏障受损,在肝移植术前、术中和术后是否接受过抗菌药物的预防和治疗,以及术后是否有终末期肝病相关并发症,这些因素均可能破坏肠道菌群的平衡[7]。此外,肝移植后抗菌药物的使用也会破坏肠道中的有益菌群,导致肠道菌群失衡,这种失衡可能会导致肠道功能紊乱、免疫系统受损以及其他健康问题的发生[8]。长期、过度或不适当使用抗菌药物可能会对肠道菌群造成持久的破坏,进而影响人体的整体健康[8]。
2 免疫抑制剂对肠道菌群的影响
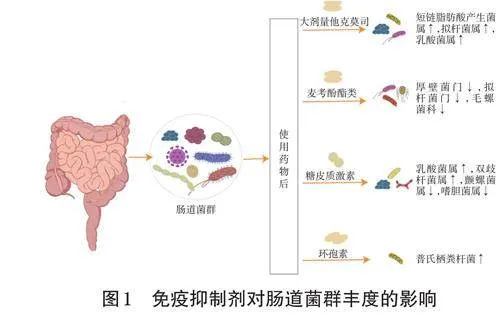
应用不同的免疫抑制剂方案会产生不同的肠道菌群谱[9]。肝移植后常用的免疫抑制剂方案包括环孢素、他克莫司、麦考酚酯类药物、糖皮质激素等药物的单药使用和联合应用。不同免疫抑制剂对肠道菌群的影响不同,但都会影响肠道菌群的丰度,如图1所示。
2.1 环孢素
环孢素属于免疫抑制剂中的钙调神经磷酸酶抑制剂,可以有效抑制免疫系统的活性,但也会影响肠道菌群的组成和功能。研究发现,在肝移植大鼠模型中,环孢素改变了肠道菌群的丰度——增加了普氏栖粪杆菌的丰度,降低了肠杆菌科细菌和梭菌簇Ⅰ、ⅪⅤ的占比,从而可减轻肝移植后的肝损伤,部分恢复肠道菌群丰度,这可能有利于治疗肝移植后的排斥反应[10]。由于不同个体的肠道菌群组成和环孢素对肠道菌群影响的程度存在差异,故在实际临床中,需要结合患者的具体情况综合考虑,并进行个体化的肝移植后免疫抑制治疗决策。
2.2 他克莫司
他克莫司的治疗窗较窄,且血药浓度具有一定的个体差异,其改变了肠道菌群的组成和代谢物,可能影响机体免疫功能和移植肝的存活率[11]。因此,临床在使用他克莫司时,需关注患者的肠道健康,并考虑采用适当的措施(如进行益生菌补充、避免过度使用抗生素等)来维持肠道菌群的平衡。有研究者观察到经他克莫司处理过的小鼠模型的盲肠中,丁酸盐产生菌的丰度在降低,丁酸浓度在下降,而丁酸在维持胰岛素敏感性和葡萄糖代谢方面发挥着重要作用,有助于维持血糖平衡[12],这表明他克莫司介导的肠道菌群变化可能导致葡萄糖代谢紊乱。另有研究发现,他克莫司对C57BL/6正常小鼠的肠道菌群具有调节作用,通过粪群移植和给予低剂量他克莫司可调节小鼠的结肠肠道菌群失衡和全身免疫反应,并提高同种移植肝的存活率;与未给药组相比,高剂量他克莫司组小鼠的肠道菌群组成和丰度发生了明显变化,短链脂肪酸产生菌属、拟杆菌属和乳酸菌属的丰度均显著增加[11]。短链脂肪酸产生菌属的增加使得短链脂肪酸水平也随之升高,而短链脂肪酸不但是能量来源,而且对造血系统、T细胞功能以及黏膜免疫均有调控作用[13],同时具有抗氧化、抗纤维化和调节血压的作用[14],能够增加机体对外界病原体的防御能力。
2.3 麦考酚酯类药物
麦考酚酯类药物是一种新型的免疫抑制剂,能够特异性干扰免疫细胞的信号传导,从而降低免疫系统的活性。目前,国内常用的麦考酚酯类药物包括吗替麦考酚酯(mycophenolatemofetil,MMF)和麦考酚钠(mycophenolatesodium,MPS)2类。MMF和MPS都是前体药物,口服或静脉注射后在体内迅速代谢为活性代谢产物麦考酚酸(mycophenolicacid,MPA)。这一代谢转化过程主要涉及肠道和肝脏。具体来说,在肠道中,MMF和MPS会被酯酶迅速水解为MPA,而MPA进入肠道细胞后,通过乳酸转运体进入血液循环;在肝脏中,MPA主要经过葡萄糖醛酸转移酶的作用,与葡萄糖醛酸结合形成一种无活性的代谢产物——麦考酚酸葡萄糖苷酸(mycophenolicacidglucuronide,MPAG),最终排出体外。含有MPA类药物的免疫抑制方案可用于预防和治疗器官移植术后的排斥反应,改善肝移植受者和移植肝的长期存活情况[15]。
MPA具有抗菌作用,会导致肠道菌群发生变化,会使厚壁菌门和拟杆菌门的菌群密集度和多样性降低[16],也会降低毛螺菌科细菌的相对丰度[17]。研究表明,在传统饲养的小鼠中,MMF会导致其盲肠萎缩、结肠发炎和体重减轻;但将MMF给予无菌小鼠或先前用广谱抗生素治疗过的小鼠时,它们均没有发生上述问题,这表明MMF可能是通过菌群失衡导致上述症状[4]。另外,MMF暴露也会导致肠道菌群多样性和菌群组成发生变化,增加肠道菌群的致病潜力[18]。
2.4 糖皮质激素
糖皮质激素亦是一类常用的免疫抑制剂,被广泛应用于治疗各种免疫介导性疾病。该类药物可通过调节免疫系统的功能,减轻炎症反应和自身免疫反应,从而发挥治疗作用。另外,糖皮质激素增加了乳酸菌属、双歧杆菌属等菌群的相对丰度,减少了颤螺旋菌属、嗜胆菌属等菌群的丰度[4],可能导致肠道菌群的不平衡。16SrRNA测序结果表明,经地塞米松处理过的正常雄性Wistar大鼠的盲肠内容物中,肠道菌群的总量和多样性在降低,变形菌门的丰度在增加,说明外源性糖皮质激素改变了肠道菌群的结构[19]。另一项研究显示,长期接受泼尼松治疗的正常SD大鼠的肠道菌群会发生改变,其粪便代谢产物的分布也会发生改变[20]。此外,泼尼松对肠道菌群的影响具有剂量依赖性,肠道菌群的改变程度与泼尼松的剂量相关;泼尼松在治疗MRL/Lpr小鼠时可增加变形杆菌和志贺杆菌等菌群的丰度,降低瘤胃球菌属、另枝菌属等菌群的丰度[19]。糖皮质激素的长期治疗可能通过调节肠道菌群对宿主产生有益影响,该治疗过程能够产生人体必需氨基酸L-苯丙氨酸、抗真菌物质苯乳酸和羟基苯乳酸[20]。
2.5 联合用药
肝移植后,单一的免疫抑制剂治疗有时可能无法有效地控制排斥反应,这时就需要进行联合用药。但研究表明,他克莫司与MMF联用可能会显著改变肠肝循环,增加药物与肠道细胞的接触,造成肠道菌群失衡,最终引起结肠炎;环孢素与MMF联用可减少后者的活性代谢产物MPA的排泄,从而降低胃肠道损伤的发生率[21],进而可能降低肠道菌群失衡的发生率。与他克莫司和MMF联用相比,环孢素和MMF联用会抑制MPA的肠肝循环,导致与环孢素联用的MPA的药-时曲线下面积显著减小(约40%)[22]。肠溶麦考酚钠(enteric-coatedmycophenolatesodium,EC-MPS)与MMF会产生相同的活性代谢产物MPA。当环孢素和MMF/EC-MPS联用时,如需达到与他克莫司和MMF/EC-MPS联用时类似的暴露量,MMF/EC-MPS的剂量需要更高;即使MMF/EC-MPS的剂量不变,但停用环孢素或将环孢素换成另一种钙调神经磷酸酶抑制剂也有可能会引起MPA相关的不良反应(如腹泻、白细胞减少等)[22],而肠道菌群的失衡可能是引发腹泻的一个重要因素。
除以上免疫抑制剂外,还有类固醇、硫唑嘌呤、mTOR抑制剂(西罗莫司、依维莫司)、抗体制剂等药物与肠道菌群之间也存在相互作用,但相关研究较少;之后可通过研究这些药物与肠道菌群之间的影响,来探究其个体化用药情况,从而实现精准医疗。
3 肠道菌群对免疫抑制剂的影响
许多药物的体内过程都会受到肠道菌群的影响,肠道菌群可以将药物还原或水解成疏水性产物,从而影响药物的药理作用[23]。有研究指出,肠道菌群对免疫抑制剂的影响主要体现在以下几个方面:一是肠道菌群能够影响免疫抑制剂不良反应的发生情况,通过调节肠道菌群的平衡,可以减少免疫抑制剂的不良反应,并提高患者的耐受性。二是肠道菌群会影响免疫抑制剂的肠道代谢与吸收[24]。三是肠道菌群会产生一系列酶和代谢产物,这些酶和代谢产物可能会通过化学方式来改变药物的临床效果[25]。此外,除了直接影响药物的代谢外,肠道菌群还可通过调节宿主的基因表达等间接影响药物的代谢。
普氏栖粪杆菌是一种益生菌,与免疫系统调节相关,并可对肝移植后患者的抗排斥反应产生积极影响。具体而言,普氏栖粪杆菌的丰度与他克莫司的剂量之间存在关联,这可能意味着该菌在调节他克莫司疗效方面发挥了一定的作用[26]。肠道菌群可以消除很大一部分他克莫司,他克莫司可被多种肠道菌群代谢。以普氏栖粪杆菌为代表的细菌可直接将他克莫司代谢为M1(他克莫司的一种新型代谢产物),后者作为免疫抑制剂和抗真菌剂的效力低于母体药物他克莫司[27]。M1存在于血液中,支持肠道菌群对他克莫司进行主动代谢;他克莫司在肠道中转化为M1可能是该药在肠道中消除的新途径,可能导致该药在肠道中的损失[26―27]。
麦考酚酯类药物的活性代谢产物MPA可通过肠道菌群介导的β-葡糖醛酸糖苷酶进行广泛的肠肝再循环,在胃肠道内将MPA从MPAG中重新激活[28],而激活后的MPA能够通过血液循环到达目标组织或器官,从而发挥药物疗效;通过菌群介导的肠肝再循环,麦考酚酯类药物在体内的循环时间会延长,从而疗效也会增强。β-葡糖醛酸糖苷酶活性可能是进入体循环的MPA含量的关键决定因素,也是MMF精确给药的重要考虑因素[18]。一些抗菌药物可通过减少β-葡糖醛酸糖苷酶的表达、活性及其产生的菌株,从而减少MMF代谢产物MPAG分解代谢为游离MPA,预防和逆转MMF诱导的肠道毒性,因而通过抑制含β-葡糖醛酸糖苷酶的细菌可改善MMF肠道相关副作用并提高临床疗效[29―30]。MMF具有肠道毒性,肠道菌群的存在似乎是MMF毒性所必需的关键因素,因此,可通过改善肠道菌群失调来减轻MPA诱导的肠道相关不良反应,其中梭状芽孢杆菌可能是发挥该作用的主要肠道菌群[18]。
4 免疫抑制剂与肠道菌群之间的相互影响
免疫抑制剂对肠道菌群的丰度产生影响,肠道菌群对免疫抑制剂的代谢也会产生影响;肠道菌群的特定组成可以影响免疫系统的活性,从而影响免疫抑制药物的疗效。肠道菌群衍生的代谢产物可通过免疫细胞中的受体影响免疫细胞的代谢,这些来自不同菌群的代谢产物不仅可以促进免疫细胞的分化和功能发挥,还可以抑制炎症细胞,对巨噬细胞、调节性T细胞、调节性B细胞等产生影响,从而在维持肠道和全身稳态方面发挥关键作用[31]。
肠道菌群能影响炎症因子,其与肠道中的白细胞介素17(interleukin-17,IL-17)受体信号转导之间存在相互关系,能控制生态失调,限制IL-17的发育,并能调节对自身免疫性炎症的易感性[32],是肠道中IL-22产生的核心原因,对保护宿主免受肠内炎性损伤至关重要[33]。免疫抑制剂也能影响炎症因子,如他克莫司能降低IL-4、IL-5、IL-13等的水平,减少过敏原诱导的促炎细胞因子[34],使T细胞的活化、转录和细胞因子(如IL-2)的释放被抑制[35]。另外,炎症因子也能影响免疫抑制剂的代谢[36]。
综上,在一定程度上可认为,免疫抑制剂通过肠道菌群发挥作用。
5 总结与展望
当前的研究发现,免疫抑制剂与肠道菌群之间存在着复杂的相互作用关系,肠道菌群的代谢产物对免疫抑制剂的活性也会产生影响。药物进入消化道后,会接触到大量的细菌及其分泌的活性酶(包括氧化还原酶、转移酶和其他代谢酶),肠道菌群在药物的药动学和药效学中起着重要的作用[37]。免疫抑制剂的使用会改变肝移植后肠道内部的免疫环境,影响肠道菌群的多样性和丰度,并促进某些病原微生物的生长。上述结论对改进肝移植后的治疗方案以及促进健康肠道菌群的维护具有重要意义。
对于未来的医学实践和药物研发来说,理解免疫抑制剂和肠道菌群之间的关系将有助于最大程度地减少肝移植后免疫抑制剂的剂量和副作用,同时保持健康的肠道菌群。肝移植后使用不同的免疫抑制剂对肠道菌群有着不同的影响,肠道菌群也通过不同的方式影响着免疫抑制剂的药效。目前,还有一些免疫抑制剂与肠道菌群的相互关系尚未阐明,并且免疫抑制剂对肠道菌群的影响程度和机制也尚不清楚,肠道菌群对免疫系统调节作用的分子机制和调节途径仍需深入研究;同时,相关研究仍需要大规模的临床研究证据加以支持。随着科学技术的进步,可以借助宏基因组学等先进的研究方法来更加深入了解肠道菌群和免疫抑制剂之间的关系,从而为肝移植后的免疫治疗提供更精细化的证据。
