顺铂脂质体在肿瘤治疗中的研究进展
2025-02-15赵玮璇卢雪赵瑞林张艳梅杨晔曹德
关键词顺铂;脂质体;肿瘤;共递送脂质体;刺激响应型脂质体;具有靶向功能的脂质体
癌症是威胁人类生命健康的主要因素之一,每年可导致数百万人死亡。有研究报道称,估计到2040年,全球癌症患者人数将增长至2800万[1]。癌症的治疗方法主要包含手术治疗、放射治疗和化学药物治疗。小分子抗癌药物在化学药物疗法中占有重要地位,其中顺铂因疗效佳、作用强且与多种抗癌药物有协同作用,成为了临床治疗癌症的常用药之一,其应用范围包括小细胞或非小细胞肺癌、睾丸癌、卵巢癌、膀胱癌等。虽然顺铂类药物具有广谱抗癌效果,但强烈的副作用使其临床应用受限;此外,现有顺铂类药物注射剂的药代动力学不佳、水溶性差和易使癌细胞产生耐药性等问题也制约了其发展[2]。因此,亟待研发治疗效果更佳的顺铂类药物新剂型。
近年来,脂质体药物在医疗健康领域得到了广泛的应用,并有多款抗肿瘤的脂质体药物经美国FDA批准上市。脂质体作为小分子药物的载体,主要具有以下优势:(1)可以有效改善小分子药物血液半衰期短、毒副作用强等问题,重塑其药代动力学性质;(2)可以通过静电吸附、亲疏水作用、化学连接等多种方式负载药物,改善药物的理化性质(如溶解度等);(3)可以通过高通透性和滞留(enhancedpermeabilityandretention,EPR)效应滞留并富集在肿瘤组织中,减少药物的系统毒性和细胞耐药性;(4)可以通过表面修饰、结构优化、组分设计等方式改变给药特性,提高细胞对药物的摄取效率[3―4]。若结合脂质体技术的优势递送顺铂类药物,可改善顺铂的药代动力学特性,并使顺铂被动靶向递送至肿瘤组织,从而减轻药物不良反应、克服耐药性并提高抗肿瘤功效,具有良好的应用前景,但目前尚无顺铂类脂质体药物(以下简称“顺铂脂质体”)上市[5]。本文总结了已进入临床研究阶段的顺铂脂质体在癌症治疗领域的研究进展,并展望了其未来的发展方向,以期为顺铂脂质体的研发提供参考。
1 顺铂类药物简介
1.1 顺铂的基本性质及顺铂类药物的作用机制
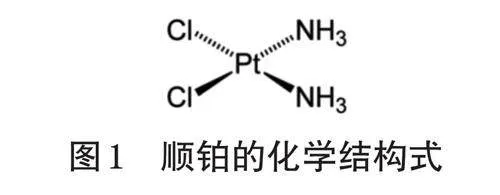
顺铂的化学结构式如图1所示。该药为重金属铂的络合物,以铂为中心原子,四周围绕2个氯原子和2个氨分子,其结构类似双功能烷化剂。顺铂微溶于水,易溶于二甲基亚砜,常温常压下稳定,在氧化条件和光照条件下不稳定[6]。
顺铂类药物化疗的作用机制为造成肿瘤细胞遗传物质DNA损伤、诱发细胞凋亡。该类药物进入血液后,血液中高浓度的氯离子可使顺铂分子维持自身形态,进而与血浆蛋白结合,运送入细胞内;进入细胞后,顺铂的配体氯原子会被水分子取代,进一步通过水解形成具有更高活性的一价或二价离子,最后结合DNA链N7位的嘌呤碱基,引起DNA链发生链内或链间交联,导致DNA双链弯曲,从而抑制DNA的复制和转录,影响蛋白的表达,造成细胞周期阻滞,最终诱发细胞凋亡和坏死[2,7]。
1.2 顺铂类药物的临床应用
顺铂类药物是多种癌症治疗的单药化疗方案或联用化疗方案的一线推荐药物,对实体瘤治疗效果较好,具有抗癌谱广、作用强等特点[8]。临床应用的顺铂类药物大多为注射剂型,经静脉注射后,其血液半衰期呈双相型,第1个血液半衰期为注射后25~49min,第2个为注射后55~73h[2]。
不良反应是顺铂类药物临床应用的主要限制因素之一。经静脉注射给药后,顺铂类药物在多个组织器官中都有分布,包括皮肤、肝、肾及大小肠,亦可少量分布于脑组织,从而引发严重的肾毒性、消化道毒性和神经毒性,且大多表现为剂量相关性[9]。由于顺铂会以原型或与DNA结合的形式经肾小球滤过,再经肾小管分泌排出体外,故可使药物大量积累在肾脏,导致肾小管不可逆性损伤,最终诱发肾衰竭[2,10]。临床上大多通过充分水化来预防顺铂类药物所引起的肾毒性,比如大量滴注等渗葡萄糖溶液或氯化钠溶液,或同时使用利尿剂(呋塞米)以加快尿液的排出,但效果仍不太理想[11]。耐药性是顺铂类药物临床应用的另一个主要限制因素。研究表明,长期使用顺铂类药物会导致参与顺铂进入细胞的受体表达下调,使肿瘤细胞对顺铂的摄取减少;同时还会导致跨膜转运蛋白的过度表达,使肿瘤细胞对顺铂的外排增加[1,7];此外,治疗过程中肿瘤细胞的DNA修复机制被激活,导致凋亡的肿瘤细胞减少,使得许多癌症患者最终产生顺铂耐药性[10―11]。为了克服耐药性,顺铂类药物常与其他药物联用,如紫杉醇、5-氟尿嘧啶、吉西他滨和维生素D等[12―13]。虽然联合治疗具有更低的耐药性、更优的治疗效果和更高的患者生存率,但顺铂类药物产生的肾毒性和耐药性仍然严重影响了其在临床上的应用[10]。
2 顺铂脂质体的优劣势与临床研究进展
2.1 顺铂脂质体的优势与挑战
通过脂质体技术递送顺铂类药物可以提高其生物相容性、减少不良反应(如肾毒性)、改善药代动力学特性,并优化其在靶细胞处的释放特性[14]。脂质体是由磷脂和胆固醇组成的球形双层载体,其结构及组成与生物膜类似,具有良好的生物相容性。脂质体可通过将难溶性药物顺铂包裹于腔内,从而增加其溶解度,提高其在体内的稳定性和生物利用度。顺铂类药物见光易分解,而脂质体的屏蔽性可使相关制剂具有一定的耐光性,增加顺铂类药物的稳定性,使其更易储存和运输[5]。由于脂质体存在EPR效应,故其可以通过内皮细胞之间的间隙被动靶向肿瘤组织,并且还可因淋巴引流不畅而在肿瘤组织内滞留,从而增加顺铂脂质体在肿瘤部位的富集,提高药效并减少全身毒副作用。除此之外,聚乙二醇(polyethyleneglycol,PEG)化脂质体还可通过“气球效应”避免被网状内皮系统识别,从而具有较好的屏蔽作用,这不仅可以解决顺铂类药物相对较高的血液清除率问题,还可以减少脂质体在生物体内可能产生的不良反应,提高细胞对药物的耐受性,帮助顺铂等化疗药物更好地发挥抗肿瘤作用[15]。因此,良好的生物相容性、肿瘤靶向性和药代动力学特征,使脂质体成为最适合递送顺铂类药物的载体之一。
在顺铂脂质体的作用过程中,药物存储在脂质体的内部水相中——1H和31P的核磁共振结果显示,顺铂和带正电的顺铂水解产物均存在于脂质体的内核中[5]。但是顺铂的不稳定性、低效负载性和肿瘤部位的低药物释放性等特性,使其脂质体化的制备和分析过程面临很大挑战[16]。首先,顺铂的低亲脂性和低水溶性导致脂质体包封效率很低,使得药物与脂质的比率也较低。虽然在这种情况下,脂质体递送顺铂所导致的细胞毒性作用会减轻,但也更易诱导肿瘤细胞对其产生耐药性。其次,在脂质体制备的过程中要充分考虑顺铂的不稳定性,在保存时需使用密封性好且避光的容器,并于药液配制完成的1h内使用。研究显示,在低氯离子浓度的环境中,顺铂可与阴性磷脂发生相互作用,使顺铂药性失活[5]。同时,pH也是影响顺铂与不同磷脂材料结合的重要因素,因此在脂质体制备、膜间相互作用评估及细胞摄取程度考察时都需要考虑这一点。此外,顺铂的持续性作用可能导致慢性毒性的发生,这也是在构建顺铂脂质体系统时需要考虑的问题之一。
2.2 顺铂脂质体的临床研究现状
目前,为了改善顺铂类药物的生物相容性和药代动力学,有多种顺铂脂质体已进入到临床研究阶段。与其他种类的顺铂脂质体相比,长循环脂质体更能帮助顺铂类药物克服耐药性问题,并且到目前为止还未出现严重的药物耐受性反应[5]。下文将着重介绍国内外已经进入临床研发阶段的顺铂脂质体。
2.2.1 L-NDDP
由美国Antigenics公司开发的顺式-二新癸酸根-反式-(1R,2R-环己二胺)合铂(liposome-entrappedcisplatinanalog,L-NDDP)是一款进入临床研究的顺铂脂质体注射剂。但由于该制剂所用的脂质材料二肉豆蔻酰磷脂酰胆碱和二肉豆蔻酰磷脂酰甘油组成的多室脂质体存在体内降解、顺铂释放效率较低的缺点,加之药物微粒易在肺部发生聚集,对难治性结肠癌的疗效(Ⅱ期临床试验)不佳,故其临床应用受限[17]。
2.2.2 SPI-077®
SPI-077®是由美国Alza公司开发的一款PEG化的顺铂长循环脂质体注射剂。临床前研究表明,该制剂在肿瘤部位的聚集相比于游离顺铂明显增加、肾毒性减弱,并且将顺铂的药代动力学模型由线性二室消除优化为单室消除,将半衰期由0.24h提高至16h,使其血液循环时间明显延长[18]。与传统顺铂类药物相比,该制剂在Ⅰ期临床研究中表现出了半衰期的延长[(145±107)h],并且在治疗过程中也显示出了良好的安全性[19]。此外,一项Ⅰ/Ⅱ期临床研究显示,SPI-077®的耐受性良好,且具有较低的肾脏、神经系统、血液系统和肝脏毒性[20]。然而,尽管SPI-077®在肿瘤部位的滞留率高,但Ⅱ期临床研究发现其顺铂的释放极其缓慢,这可能是由于内源性磷脂酶不足以完全降解脂质体的磷脂双分子层,导致顺铂的释放减少,进而使得顺铂-DNA复合物的形成减少,最终导致治疗效果不佳,限制了该药物的临床应用。为了提升疗效,Alza公司进一步开发出了SPI-077B10,利用不饱和磷脂替代原本使用的氢化磷脂酰胆碱,但效果依旧不理想[21]。
2.2.3 Lipoplatin®
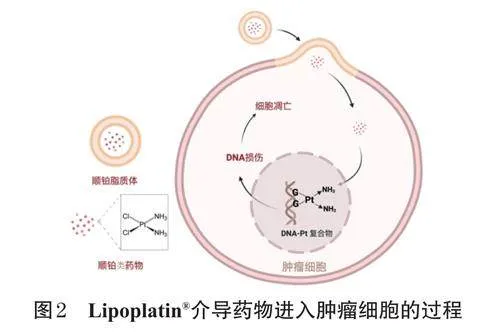
由美国Regulon公司研发的Lipoplatin®是第一个完成Ⅲ期临床评价的顺铂脂质体注射剂,其组成成分包含中性磷脂二硬脂酰磷脂酰胆碱、阴离子脂质二棕榈酰磷脂酰甘油(1,2-dipalmitoyl-sn-glycero-3-phosphorylglycerolsodiumsalt,DPPG)、线性PEG磷脂二硬脂酰磷脂酰乙醇胺和胆固醇,粒径约为110nm[8]。其体内作用过程如图2所示:阴离子脂质DPPG的加入,使Lipoplatin®具有与细胞膜融合的特性,可以规避顺铂类药物进入细胞转运所需的铜离子转运蛋白1介导的运输方式,促进药物的跨膜转运,增强药物在肿瘤细胞内的释放效果[4]。这也是Lipoplatin®的治疗效果优于SPI-077®的原因之一。临床前研究数据显示,对于经腹腔或静脉注射入动物体内的人乳腺癌MCF-7细胞或前列腺癌LNCaP异种移植物而言,Lipoplatin®的抗肿瘤效果与顺铂相当,但其肾毒性明显低于顺铂[22]。另一项临床前研究比较了Lipoplatin®和顺铂类药物的细胞毒性和血液半衰期,结果显示,Lipoplatin®对非小细胞肺癌和肾癌的抗肿瘤活性较顺铂类药物增加,且血液半衰期可延长约12倍[21]。一项有关Lipoplatin®的临床试验结果显示,患者血浆中的顺铂浓度在用药后6~8h(半衰期)时达到峰值,在血液中持续释放的时间可达到117h,并且在治疗过程中未产生类似顺铂的严重副作用和肾毒性[23]。Lipoplatin®所使用的PEG可使药物在肿瘤部位聚集。一项测量癌症患者肿瘤和正常组织中顺铂水平的试验结果显示,肿瘤组织中的总顺铂水平较正常组织平均高出10~50倍,其中结肠癌组织的顺铂积累高达正常组织的200倍,这些数据均表明Lipoplatin®是一种很有前途的抗肿瘤药物[5]。更多的临床研究聚焦于将Lipoplatin®与其他抗肿瘤药物或治疗方法联用,例如:Lipoplatin®与5-氟尿嘧啶联用的有效性已在头颈癌的Ⅲ期临床试验中得到验证;Lipoplatin®结合放射疗法治疗进展期胃癌处于Ⅰ/Ⅱ期临床试验中;Lipoplatin®与吉西他滨联用治疗非小细胞肺癌、与长春瑞滨联用治疗人表皮生长因子受体2/神经氨酸酶转移性隐匿性乳腺癌处于Ⅱ期临床试验中[24]。
2.2.4 LiPlaCis
由丹麦MedicalPrognosisInstitute(MPI)子公司OncologyVenture开发的LiPlaCis是一种顺铂脂质体靶向注射剂,主要用于治疗难治性转移性乳腺癌。由于肿瘤组织可通过分泌磷脂酶对脂质体进行水解,故该效应可使LiPlaCis中的顺铂在肿瘤组织中定点释放。但Ⅰ期临床研究结果显示,LiPlaCis并未降低顺铂的肾毒性,且在治疗过程中存在输液反应,限制了其在肿瘤治疗中的应用[25]。
2.2.5 吸入型顺铂脂质体
除了注射给药的顺铂脂质体,还有一部分研究工作集中于吸入型顺铂脂质体的研发,后者不仅可以利用脂质体改善顺铂类药物的半衰期和药代动力学,而且可以利用吸入式递送方式使药物主要聚集在呼吸道及肺部,从而提高药物的治疗效率[26]。由美国Transave公司开发的SLIT顺铂脂质体是一种吸入型脂质体制剂,其临床前研究在SD大鼠中进行。结果显示,相比于传统的顺铂类药物,通过气管给药的SLIT可增加顺铂在肺部的聚集并降低肾毒性[27]。有研究验证了SLIT在Ⅰ期临床试验中治疗原发性或转移性肺癌和在Ⅰb/Ⅱa期临床试验中治疗复发/进展性骨肉瘤过程中的安全性,发现在采用雾化给药的最大剂量下,没有出现顺铂的剂量限制毒性,也未观察到肾毒性、血液毒性、耳毒性和神经毒性,但患者出现了恶心、呕吐和用力呼气量下降的副作用[28]。但也有研究显示,SLIT的治疗效果不佳,这是由于该药物在呼吸系统中的沉积较少,目前主要通过在雾化器中使用5%的CO2以及与紫杉醇的联用来增加药物在肺部的沉积,从而提升疗效[29]。另一款吸入型顺铂脂质体是由恩康药业科技(广州)有限公司从美国ELEISON公司授权开发的ILC,该制剂采用与肺部相容的磷脂材料,主要用于治疗非小细胞肺癌[30]。临床研究显示,ILC不仅克服了采用静脉注射的顺铂类药物的典型毒性(包括血液毒性、肾毒性和耳毒性),而且对转移至肺部的骨肉瘤具有较好的耐受性和治疗效果[31]。目前ILC已在海外完成了Ⅰ期临床试验,并获得了美国FDA和我国药品监督管理局新药审评中心的Ⅲ期临床批件,用于治疗肺转移性肿瘤和非小细胞肺癌。
3 顺铂脂质体的未来发展方向
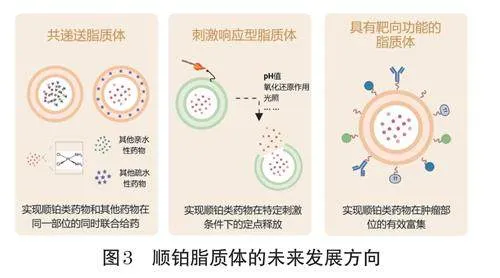
通过脂质体技术递送顺铂类药物可以提高其生物相容性、减少不良反应(如肾毒性)、改善药代动力学以及在靶细胞处具有适当的释放特性(EPR效应),但对肿瘤的靶向递送不理想仍是阻碍顺铂脂质体发展的一个主要问题[3]。随着脂质体技术的深入发展,新的脂质体递送技术不断涌现,这也为顺铂脂质体的研发提供了全新的思路,实现更高效的肿瘤部位富集和更可控的药物释放速率仍是顺铂脂质体主要的研究方向。顺铂脂质体的未来发展方向如图3所示。
3.1 共递送脂质体
共递送脂质体是通过脂质体技术实现同一部位的同时联合给药,包括其他种类的小分子化疗药物、核酸类药物或酶类药物。目前已有共递送脂质体类药物在临床上取得巨大成功:一种是将阿糖胞苷和柔红霉素进行共递送的脂质体药物CPX-351(Vyxeos),用于治疗白血病[32];另一种是将伊立替康和氟尿苷进行共递送的脂质体注射剂CPX-1,用于治疗晚期实体瘤[33]。这都说明了利用脂质体技术实现多种肿瘤治疗药物同步给药具有巨大的发展空间。在临床应用中,顺铂也经常和其他化疗药物联用以降低其耐药性,因此,共递送脂质体技术成为了未来顺铂脂质体研发的重点方向之一。目前,已有研究将顺铂和谷氨酰胺酶抑制剂共载入脂质体用于杀伤卵巢癌细胞[34],将顺铂和可以增强药物敏感度的苯乙基异硫氰酸酯共载入脂质体作用于非小细胞肺癌模型等[35],均可显著提高其肿瘤杀伤能力。
3.2 刺激响应型脂质体
相较于体内正常组织而言,肿瘤部位拥有特殊的肿瘤微环境,包括特定蛋白酶和磷脂酶的高表达、低pH值(6.0~7.2)、高还原性、缺氧等。因此,可以在特定刺激条件下实现药物定点释放的脂质体制备技术应运而生,主要分为pH响应型、酶响应型和氧化还原响应型脂质体。目前已有研究将该技术应用于顺铂类药物的递送,例如以二油酰磷脂酰乙醇胺和胆固醇半琥珀酸酯为材料的脂质体可在pH5.5处(肿瘤部位)实现80%顺铂的释放,从而降低全身毒性,提高药物的抗肿瘤效果[36]。除了内源性刺激外,还有在声、光、温度、电磁等外源性刺激下实现药物特异性释放的脂质体,其中最具研究潜力的是光敏感型脂质体[37]。光敏感型脂质体通过近红外光照射实现脂质体的降解,从而可以定时定点地释放顺铂类药物,降低对其他部位的毒性[38]。
3.3 具有靶向功能的脂质体
顺铂类药物产生副作用的主要原因是针对肿瘤部位的特异性不佳,虽然可以借助脂质体的EPR效应被动靶向肿瘤部位,在一定程度上减少顺铂类药物的副作用,但由于缺乏特异性和选择性,新的方法还有待开发。目前,已有研究通过对脂质体表面进行修饰从而实现主动靶向,进一步增强了装载顺铂类药物脂质体的肿瘤靶向能力。该方法是在脂质体表面修饰肿瘤靶向配体,如抗体、肽、小分子等,通过肿瘤表面特异性受体的亲和力,实现对肿瘤细胞的选择性和高效内化[39]。已有多项研究针对该方法在体内外肿瘤模型中进行验证,例如使用细胞穿透肽修饰的顺铂脂质体杀伤宫颈癌细胞[40]、叶酸修饰的顺铂脂质体靶向卵巢癌细胞[41],均可实现顺铂类药物在肿瘤部位的有效富集,并且能降低肾毒性。
4 总结与展望
顺铂类药物自20世纪70年代被发现以来,一直作为临床首选的抗肿瘤药物之一。但是,顺铂类药物的非特异性所导致的副作用(包括神经毒性、血液学毒性、肝毒性、肾毒性等)极大地限制了其作为一线抗肿瘤药物的临床应用。为克服此不足,科学家们集中于开发低毒、高效的新型药物制剂,通过脂质体技术递送顺铂类药物以改善其药代动力学性质、降低其毒副作用和耐药性。因此,将顺铂类药物与脂质体递送技术相结合已成为一个重要的发展方向。
虽然目前已有多款脂质体药物获批上市,但至今仍未有抗肿瘤顺铂类药物的纳米递送新制剂获准上市。研究进展较快、显示出了良好的癌症治疗潜力且进入Ⅲ期临床试验的顺铂脂质体目前只有注射剂Lipoplatin®和吸入剂ILC,两种制剂均可显著降低顺铂类药物对正常组织的毒性。而其他顺铂脂质体的临床试验都因各种各样的原因宣告终止——L-NDDP和SPI-077®都因为顺铂在肿瘤部位的释放过于缓慢而导致治疗效果不佳,Li‐PlaCis则因磷脂酶触发药物释放的治疗窗口过窄而停止在Ⅰ期临床。这几种顺铂脂质体被期望通过在体内长时间循环或利用肿瘤微环境的特殊性来降低顺铂的全身毒性,导致其在临床试验中遇到的问题集中在药物释放速率和脂质体降解速率的平衡上。目前临床结果最佳的Lipoplatin®是通过长循环脂质体的EPR效应来增强药物在肿瘤组织的富集,这种方式本身并不具有特异性,使得其在正常组织中仍具有较高浓度,所以其在临床研究中仍显示出微量的血液毒性和胃肠道毒性。
由此看出,顺铂脂质体的研究难点首先是由于顺铂自身的不稳定性、低效负载性和肿瘤部位的低药物释放性等特性,使脂质体在制备前就需要经过严密的设计和优化,从而为选用高分子生物材料提供指导依据。其次,脂质体化后的顺铂相比于传统的顺铂类药物,其药代动力学和生物学特性均发生了较大改变,所以对其作用机制也应该进行详细而全面的研究,建立体内药物释放谱,使包封的药物浓度和其在肿瘤细胞处的释放速率达到平衡。结合以上两点科学地设计脂质体系统,对推动顺铂类药物的脂质体化取得突破性进展至关重要。除此之外,通过新型脂质体技术,如共递送脂质体、刺激响应型脂质体和具有靶向功能的脂质体,可以进一步改善现有制剂的不足,实现顺铂在肿瘤部位的有效释放。综上所述,顺铂脂质体在临床肿瘤治疗中拥有广阔的发展空间和应用前景。
