解淀粉芽孢杆菌wxy-b3产脂肽类物质对苹果斑点落叶病菌的抑菌活性研究
2025-01-25崔皓玥田露胡乐梅龚国利






摘 要:苹果斑点落叶病菌是苹果生产过程中常见的病害,严重危害苹果农作物的产量.脂肽作为一种主要来源于微生物次生代谢产物的抗菌剂,具有广谱抑菌、低耐药性、安全低毒等优势.本研究发现,解淀粉芽孢杆菌wxy-b3产生的脂肽类物质能够抑制苹果斑点落叶病菌的生长,对苹果斑点落叶病菌的最小抑菌浓度为16 mg/mL,此浓度可造成该病原菌细胞膜电位超极化、线粒体膜电位去极化、大分子蛋白质和核酸泄露,以及胞内活性氧和丙二醛含量分别累积增加0.33倍和5.44倍,并通过扫描电镜进一步观察到MIC处理组的细胞形态起皱、细胞膜破损.上述结果表明,脂肽可能通过破坏细胞膜系统,导致细胞形态发生变化,细胞膜破裂,改变细胞膜通透性来达到抑菌效果.该研究将为脂肽作为抑制苹果斑点落叶病菌的抗菌剂奠定理论基础.
关键词:解淀粉芽孢杆菌; 脂肽类物质; 苹果斑点落叶病菌; 抑菌活性
中图分类号:TS201.3
文献标志码: A
Study on the antibacterial activity of lipopeptide produced by Bacillus amyloliquefaciens wxy-b3 against Alternaria mali
CUI Hao-yue, TIAN Lu*, HU Le-mei, GONG Guo-li
(School of Food Science and Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China)
Abstract:Alternaria mali is the common disease in apple cultivation,which seriously jeopardises the yield of its crops.As an antimicrobial agent mainly derived from microbial secondary metabolites,lipopeptide has the advantages of broad-spectrum inhibition,low drug resistance,safety and low toxicity.This study showed that lipopeptides produced by Bacillus amyloliquefaciens wxy-b3 were able to inhibit the growth of A.mali,and the minimum inhibitory concentration of A.mali was 16 mg/mL,and caused hyperpolarisation of cell membrane potential,depolarisation of mitochondrial membrane potential,leakage of macromolecule proteins and nucleic acids,as well as cumulative increase of intracellular reactive oxygen species and malondialdehyde content of A.mali,respectively 0.33 and 5.44 times,and the wrinkling of the cell morphology and the breakage of the cell membrane in the MIC-treated group were further observed by scanning electron microscopy.The above results indicated that lipopeptides could achieve the antibacterial effect by disrupting the cell membrane system,leading to changes in cell morphology,cell membrane rupture,and altering cell membrane permeability.This study will provide a theoretical basis for the use of lipopeptides as antimicrobial agents for the inhibition of A.mali.
Key words:Bacillus amyloliquefaciens; lipopeptides; Alternaria mali; antibacterial activity
0 引言
苹果是我国重要的经济作物之一,其产量和出口量多年来均居世界前列[1].苹果斑点落叶病(Alternaria mali)是苹果生产上最常见的病害之一,严重危害苹果的产量[2].该病害主要是由链格孢属的链格孢苹果专化型(Alternaria Alternata f.sp.Mali)侵染引起的[3].其主要危害苹果叶片,病害发生后,可导致果树提前落叶和树势下降,甚至影响果品品质[4].目前对于苹果斑点落叶病的防治,主要通过喷施化学杀菌剂,其他措施较少.但是过量施用农药不仅会导致病菌产生耐药性,还会产生农药残留影响果品品质[5].
近年来,由于传统抗真菌药物耐药性的问题,研究人员不断寻找替代抗真菌的药物,如植物精油以及微生物提取物等.解淀粉芽孢杆菌(Bacillus Amyloliquefaciens)是一种土壤环境中常见的革兰氏阳性需氧菌[6],芽孢杆菌发挥抑菌效果的重要机制之一是产生抗真菌肽(Antifungal Peptide,AFP)[7],芽孢杆菌AFP 主要包括脂肽类和多肽,其中脂肽类物质是一类具有高效广谱抑菌活性的低分子多肽[8],对真菌、细菌、病毒和支原体均具有拮抗作用,因其毒性低、易降解和热稳定性强等特点,具有极大的研究价值[9].目前,有关细菌及其代谢产物的研究日益增多,其中,Guo等[10]发现,高地芽孢杆菌Q7所产的脂肽对链格孢菌具有抑制作用,最小抑菌浓度为1.2 mg/mL,该研究表明来自高地芽孢杆菌Q7的脂肽类化合物是一种潜在的生物防治剂.Deng等[11]发现,贝莱斯芽孢杆菌FJAT-52631及其粗脂肽对针叶松FJAT-30256的抑制率为75.3%,抑制区直径为17.66 mm.廖思晨等[12]发现解淀粉芽孢杆菌wxy-b3具有较广谱的抗菌活性,对大肠杆菌、金黄色葡萄球菌、小麦赤霉病菌、马铃薯干腐病菌和苹果腐烂病菌等均具有抑制作用.然而,有关解淀粉芽孢杆菌wxy-b3产脂肽类物质对苹果斑点落叶病菌的抑菌活性和其作用机制还尚不清晰.
本研究通过确定解淀粉芽孢杆菌wxy-b3产脂肽类物质对苹果斑点落叶病菌的最小抑菌浓度、测定蛋白质泄露、核酸泄露、细胞膜电位、线粒体膜电位、胞内活性氧含量和丙二醛,并利用场发射扫描电镜(SEM)进一步观察细胞膜完整性和菌体形态,探究脂肽对苹果斑点落叶病菌的抑菌作用和可能的机制,为苹果产业的长期稳定发展和脂肽作为新型高效抗菌剂提供参考,对苹果斑点落叶病菌的防治措施研究具有重要意义.
1 材料与方法
1.1 实验材料与仪器
1.1.1 菌株
解淀粉芽孢杆菌wxy-b3 由实验室保存.
苹果斑点落叶病菌(A.mali)由实验室保存.
1.1.2 脂肽
将实验室保藏的解淀粉芽孢杆菌wxy-b3在20 mL LB肉汤培养基活化,取1%活化后的种子液于100 mL发酵培养基中进行摇瓶培养,37 ℃、180 rpm共培养72 h,得到发酵液.
参考廖思晨等[12]方法并进行修改,为了收集脂肽,用12 M HCl 调节100 mL发酵上清液的pH至2.0,4 ℃冰箱静置过夜.以4 ℃、8 000 r/min离心10 min,收集沉淀,加入5 mL甲醇,使沉淀溶解并抽提2 h,收集滤液重复抽提两次,将抽提液用有机滤膜(尼龙66)过滤,收集滤清液(即透明状滤液).将滤清液于37 ℃~42 ℃、0.08~0.09 MPa条件下用旋转蒸发仪真空浓缩减压蒸干,将蒸干后的固体用15 mL蒸馏水溶解,溶解后的水溶液预先在-80 ℃冰箱中冷冻2 h,然后在-20 ℃真空冷冻干燥48 h,得到棕黄色粉末状脂肽成品.
1.1.3 主要试剂
PDA培养基(北京奥博星生物技术有限责任公司),双(1,3-二丁基巴比妥酸)三甲炔氧羰醇(DiBAC4(3))、2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluo rescein diacetate,DCFH-DA)(美国sigma公司),碘化丙啶 (propidium iodine,PI)、SYTO-9试剂盒(赛默飞世尔科技公司),丙二醛检测试剂盒(南京建成生物工程研究所),BCA蛋白测定试剂盒、JC-1荧光探针(上海碧云天生物技术有限公司).
1.1.4 主要仪器
DZF-6050真空干燥箱、THZ-98A恒温振荡器(上海一恒科学仪器有限公司),TGL20M台式高速离心机(长沙英泰仪器有限公司),Synergy H1多功能酶标仪(美国伯腾仪器有限公司),场发射扫描电子显微镜(美国FEI).
1.2 实验方法
1.2.1 苹果斑点落叶病菌的培养
将保藏在-80 ℃冰箱中的苹果斑点落叶病菌,在PDA固体平板上进行点种传代培养,28 ℃恒温培养箱中培养5 天.
1.2.2 脂肽对苹果斑点落叶病菌最小抑菌浓度(Minimum Inhibition Concentration,MIC)测定
将脂肽配制成浓度分别为64 mg/mL、32 mg/mL、16 mg/mL、8 mg/mL、4 mg/mL、2 mg/mL和1 mg/mL的溶液,在不同浓度的脂肽溶液里放入灭菌好的空白药敏片进行浸泡,再取出放置在37 ℃烘箱内干燥备用.按1.2.1的方法,用菌饼打孔器将培养好的苹果斑点落叶病菌取菌饼放在PDA固体培养平板上,在距离菌饼2.5 cm的左右两侧各放置不同浓度的药敏片.设置溶剂空白对照组,将全部实验固体平板在28 ℃下静置培养4~5天,观察对照组菌落约长至培养皿面积的75%,开始测量抑菌圈直径,记录实验数据.实验设置三组平行,重复三次.
1.2.3 场发射扫描电镜(FEG-SEM)观察
按1.2.1节的方法培养苹果斑点落叶病菌,用打孔器切取菌饼,将制备好的菌饼分别在0、1/2 MIC、MIC脂肽浓度下培养,用磷酸缓冲盐溶液(PBS)洗涤2次样品.加入2.5%的戊二醛溶液,4 ℃静置过夜.PBS溶液浸洗样品15 min,重复3次.随后,将样品浸没于体积分数为30%、50%、70%、80%、90%的乙醇中梯度脱水15 min,再用体积分数为100%的乙醇洗脱 2次,每次处理20 min.用乙酸异戊酯处理样品30 min.样品烘干后喷金处理,使用扫描电镜在3 000×下进行观察.
1.2.4 大分子物质蛋白质泄露
按1.2.1节的方法制备样品,设置时间梯度2 h、4 h、6 h,分别用0、1/2 MIC、MIC脂肽浓度处理样品后进行离心收集上清液.蛋白浓度测定按照BCA试剂盒说明书进行,绘制标准曲线,在波长为562 nm处测定吸光值.实验设置三组平行,重复三次.
1.2.5 大分子物质核酸泄露
按1.2.1节的方法制备样品,设置时间梯度2 h、4 h、6 h、8 h、24 h,分别用0、1/2 MIC、MIC脂肽浓度处理样品后进行离心收集上清液,使用紫外分光光度计,测定260 nm处的吸光值.实验设置三组平行,重复三次.
1.2.6 细胞膜电位测定
根据Shi等[13]描述的方法进行细胞膜电位的测定.按1.2.1节的方法培养得到所需真菌,设置时间梯度2 h、4 h、6 h,收集分别在0、1/2 MIC、MIC脂肽浓度下培养的菌体细胞.将菌体重新悬浮于PBS中,加入3 mM DiBAC4(3)膜电位荧光探针,黑暗孵育2 h.在黑色96孔微量培养板中加入200 μL菌悬液,随后在492/515 nm的激发/发射波长下测量荧光强度.实验设置三组平行,重复三次.
1.2.7 线粒体膜电位测定
根据宁亚维等[14]描述的方法,按1.2.1节的方法培养得到所需真菌,设置时间梯度2 h、4 h、6 h,收集分别在0、1/2 MIC、MIC脂肽浓度下培养的菌体细胞,用PBS缓冲液洗涤两次.将JC-1荧光探针用PBS稀释至2.5 μg/mL,取 JC-1稀释液对三组菌体沉淀染色20 min.PBS缓冲液洗涤两次后,在黑色96孔微量培养板中加入200 μL菌悬液,测量荧光强度,激发波长485 nm,发射波长分别为525 nm(FL1)和590 nm(FL2),计算FL2/FL1.实验设置三组平行,重复三次.
1.2.8 细胞活性氧(Reactive-Oxygen Species,ROS)累积
按1.2.1节的方法培养得到所需真菌,收集分别在0、1/2 MIC、MIC脂肽浓度下培养的菌体细胞,用PBS缓冲液洗涤两次,加入10 μM的荧光探针DCFH-DA重悬,避光孵育1 h后,经PBS缓冲液洗涤两次并重悬,在黑色96孔微量培养板中加入200 μL菌悬液,随后在485/535 nm的激发/发射波长下测量荧光强度.实验设置三组平行,重复三次.
1.2.9 细胞丙二醛(Malondialdehyde,MDA)累积
MDA含量是反映细胞抗氧化潜在能力的重要参数[15].按1.2.1节的方法培养得到所需真菌,收集分别在0、1/2 MIC、MIC脂肽浓度下培养的菌体细胞,用PBS缓冲液洗涤两次,使用丙二醛(MDA)测定试剂盒,将待测样品加入到96孔板中,使用酶标仪测量各孔吸光度.实验设置三组平行,重复三次.
1.2.10 数据统计和分析
本研究中所有试验重复三次,数据通过SPSS分析软件进行处理,结果使用平均值±标准误差表示,并且使用T检验对数据结果进行显著性差异分析(“*”表示实验组与对照组有显著差异(p<0.05),“* *”表示实验组与对照组极显著有差异(p<0.01)).本章绘图采用绘图软件Origin.
2 结果与讨论
2.1 脂肽的产率
在发酵温度34 ℃、初始pH 7.3、接种量12%、装液量150 mL、转速215 rpm、2%糊精、1%牛肉粉、0.05%NaCl、发酵时间66 h下脂肽产率为551 mg/L.
2.2 脂肽对苹果斑点落叶病菌的最小抑菌浓度
MIC 值为完全抑制病原真菌生长的最低药物浓度[16].通过测定MIC来确定脂肽对苹果斑点落叶病菌的抑菌活性.由图1可知,当脂肽的浓度≥16 mg/mL时,苹果斑点落叶病菌的生长受到明显抑制.表明脂肽对苹果斑点落叶病菌的MIC为16 mg/mL.
2.3 FEG-SEM观察结果
通过场发射扫描电镜更直观的观察脂肽对苹果斑点落叶病菌菌丝形态造成的变化,其结果如图2所示.未经脂肽处理的菌丝形态结构完整,表面光滑饱满,整齐呈束状(图2(a)).经1/2 MIC处理的菌丝出现明显节状皱缩(图2(b)).由MIC脂肽处理的苹果斑点落叶病菌菌丝失去原有的形态,顶端出现膨大,菌丝体表面出现多个突起,部分出现断裂;菌丝整体绕缩畸形,分支明显(图2(c)).结果表明脂肽对苹果斑点落叶病菌的细胞壁和细胞膜完整性造成了损伤,且随浓度增大,细胞壁和细胞膜受损程度加剧,菌丝形态发生变化.
2.4 大分子物质蛋白质泄露
通过细胞内部物质的泄露可判断细胞膜的破损情况.如图3所示,经脂肽处理的1/2 MIC、MIC组的蛋白含量远高于空白对照组,处理2 h后蛋白浓度分别增加至1.26、1.78,处理4 h后增加至2.06、3.20,而处理6 h后蛋白浓度增加至2.06、3.27.结果表明,蛋白质泄漏量随着处理浓度的增高和处理时间延长而逐步增加,从而说明细胞膜破损程度越来越明显.
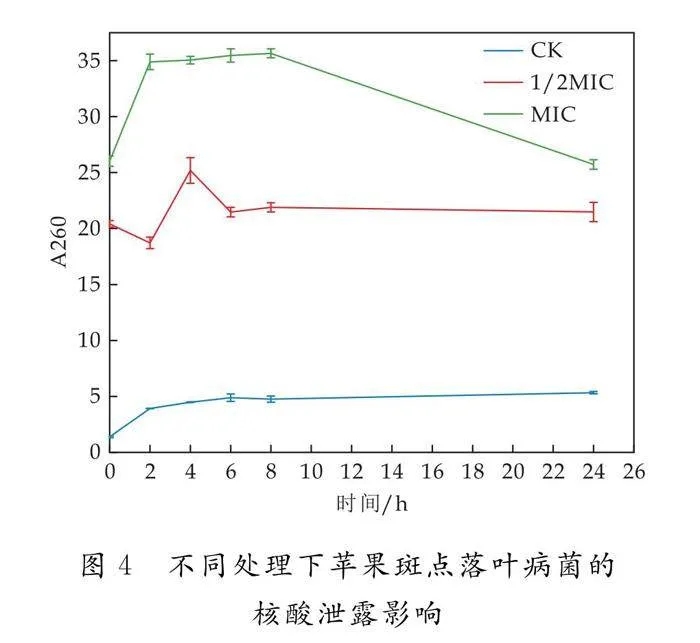
2.5 大分子物质核酸泄露
如图4所示,随着脂肽浓度的增加会造成苹果斑点落叶病菌核酸大分子物质的泄露,核酸泄露在脂肽处理初始2 h内会表现明显,随着处理时间的延长会缓慢增加,可能是菌丝体细胞膜通透性改变,或是大分子合成受阻.
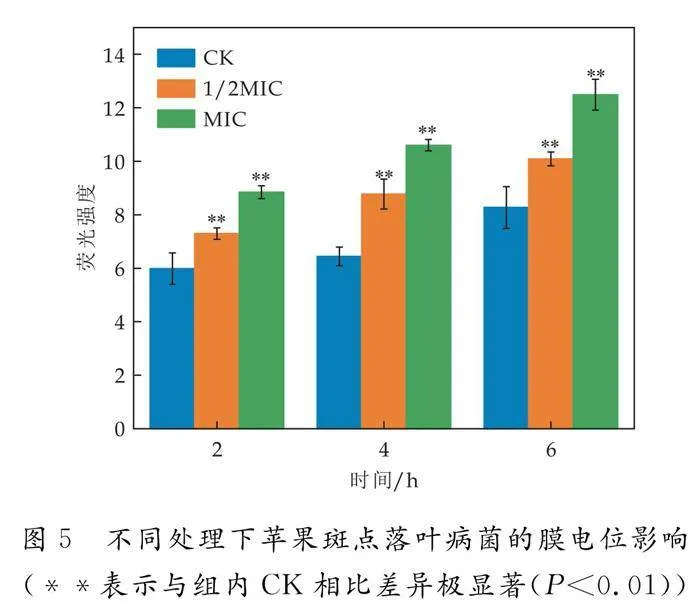
2.6 细胞膜电位测定
如图5所示,经脂肽处理后,苹果斑点落叶病菌的细胞膜电位升高,细胞膜发生超极化.对比同一处理条件下不同时间的样品,MIC浓度下处理时间从2 h增长到6 h时,苹果斑点落叶病菌的膜电位显著增长.
2.7 线粒体膜电位测定
如图6所示,与对照组相比,1/2MIC浓度处理后胞内线粒体膜电位显著下降,当浓度增加为MIC浓度时真菌线粒体膜电位继续降低,表现为去极化状态.在2 h时,经1/2 MIC以及MIC浓度处理后,线粒体膜电位降低了70%和75%;4 h时,分别降低42%和56%;在6 h时,分别降低了66%和74%.结果表明,脂肽刺激细胞,使苹果腐烂病原菌线粒体膜电位呈去极化状态.
2.8 细胞活性氧累积
2′,7′-二氯二氢荧光素二乙酸酯是一种可渗透细胞的荧光探针,可定量ROS变化,用于评估毒理学中的整体氧化应激[17].如图7所示,对照组的ROS含量为69,经1/2 MIC以及MIC浓度处理后,苹果斑点落叶病菌是ROS含量分别达到83和92,分别增加了0.20和0.33倍.结果表明脂肽引起了苹果斑点落叶病菌中ROS的积累,从而抑制苹果斑点落叶病菌的代谢活性并诱导细胞出现氧化损伤.
2.9 细胞丙二醛累积
如图8所示,随着脂肽浓度增大,细胞内MDA累积量增大,经1/2 MIC以及MIC浓度处理后,MDA含量分别增大了3.55倍和5.44倍.表明随着脂肽浓度的增加,细胞内MDA累积量增大,细胞膜出现了氧化损伤.
3 结论
本研究揭示了解淀粉芽孢杆菌产脂肽类物质对苹果斑点落叶病菌的抑菌活性和潜在的抑菌机理.结果表明脂肽对苹果斑点落叶病菌具有良好的抑菌作用,其MIC值为16 mg/mL,脂肽处理后的苹果斑点落叶病菌细胞膜和细胞壁发生了损伤,造成苹果斑点落叶病菌的细胞膜发生超极化,线粒体膜电位发生去极化,ROS和MDA的累积,导致细胞过氧化损伤,细胞膜结构被破坏.综上,解淀粉芽孢杆菌wxy-b3产脂肽类物质可以有效抑制苹果斑点落叶病菌生长繁殖.本研究为脂肽的开发和应用提供理论依据.
参考文献
[1] 林玉懿.球毛壳菌株61239对苹果树腐烂菌的抑菌机制研究与生防潜力评价[D].杨凌:西北农林科技大学,2022.
[2] Zeng X,Wu C,Zhang L,et al.Molecular mechanism of resistance to Alternaria alternata apple pathotype in apple by alternative splicing of transcription factor MdMYB6-like[J].International Journal of Molecular Sciences,2024,25:8.
[3] 包查娜.MdZAT5及其上游调控因子MdWRKY33在苹果抗旱及斑点落叶病中的机理研究[D].杨凌:西北农林科技大学,2022.
[4] 姜 莉,项颖颖,张 鹰,等.浅谈苹果斑点落叶病的发生与防治措施[J].果农之友,2023(9):64-66.
[5] 孟祥涛,李梦洁,段海明,等.生防芽孢杆菌与杀菌剂复配对苹果斑点落叶病菌的联合毒力[J].西昌学院学报(自然科学版),2024,38(1):14-20.
[6] 宛甜甜.解淀粉芽孢杆菌SN16-1对水稻稻瘟病的防治作用及其诱抗机理研究[D].上海:华东理工大学,2023.
[7] 金伟伟,贾振华,宋水山.芽胞杆菌产生的脂肽类抗生素的结构和应用[J].微生物学杂志,2017,37(3):122-127.
[8] 李雨欣,戴欣宇,曹雪梅,等.生防菌在植物病害领域的研究进展[J].湖南生态科学学报,2023,10(2):109-116.
[9] 杨然迪,杨怡妍,曹 灏,等.贝莱斯芽孢杆菌TCS001产脂肽类物质抑菌活性及发酵条件优化[J].农药学学报,2024,6(7):1-18.
[10] Guo P,Yang F,Ye S,et al.Characterization of lipopeptide produced by Bacillus altitudinis Q7 and inhibitory effect on Alternaria alternata[J].Journal of Basic Microbiology,2022,63(1):26-28.
[11] Deng Y,Chen Z,Ruan C,et al.Antifungal activities of Bacillus velezensis FJAT-52631 and its lipopeptides against anthracnose pathogen Colletotrichum acutatum[J].Journal of Basic Microbiology,2023,63(6):594-603.
[12] 廖思晨,田 露,王旭阳,等.产抗菌脂肽解淀粉芽孢杆菌wxy-b3的抑菌活性及其分离鉴定[J].陕西科技大学学报,2022,40(6):55-61.
[13] Shi C ,Sun Y ,Zheng Z ,et al.Antimicrobial activity of syringic acid against Cronobacter sakazakii and its effect on cell membrane[J].Food Chemistry,2016,197:100-106.
[14] 宁亚维,孙 颖,张东春,等.植物乳杆菌HB13-2抑制白假丝酵母菌作用及机制[J].食品科学,2023,44(24):164-170.
[15] 王 艳,陈 谦,徐 攀,等.藠头抗菌成分的复合酶法提取及其抑菌性能评估[J].食品安全质量检测学报,2022,13(15):5 053-5 061.
[16] 姚裕群,黄 丽,谢正轶,等.越南槐内生真菌JXRPH-20的鉴定及其体外抗真菌功能[J].分子植物育种,2024,7(8): 1-13.
[17] 齐 琦,田 露,杨思琪,等.麝香草酚对藤黄微球菌的抑菌活性及其作用机制[J].陕西科技大学学报,2023,41(4):64-69.
【责任编辑:蒋亚儒】
