基于马尔可夫链的COVID-19流行病患病区域变化趋势预测
2025-01-25王鑫王令戈师鹏柔







摘 要:在COVID-19疫情环境下,为精准预测不同症状状态的人群人数和区域级别的发展趋势,以SIR传染病模型为基础,基于马尔可夫链预测时空相关的特性,设计了感染人群状态与管控措施相关的K-SIRD传染病预测模型.根据COVID-19疫情人群之间传染性的特征及受距离影响造成有效传染数Re的变化而导致不同的症状状态改变的转移规律,实时精准预测了不同状态的人员人数变化,并根据同一区域人群症状状态分布情况不同,针对不同级别的区域采用不同等级的管控措施.
关键词:K-SIRD模型; COVID-19; 马尔可夫链; 有效繁殖数
中图分类号:O236.2
文献标志码: A
Prediction of the areal trends of COVID-19 epidemic based on markov-chain
WANG Xin *, WANG Ling-ge, SHI Peng-rou
(School of Electronic Information and Artificial Intelligence," Shaanxi University of Science amp; Technology, Xi′an 710021, China)
Abstract:In the COVID-19 epidemic environment,in order to accurately predict the number of people with different symptom states and the development trend at the regional level,based on the SIR infectious disease model and the spatio-temporal correlation under Markov chain prediction,designs the K-SIRD infectious disease prediction model related to the infected population state and the control measures.According to the characteristics of the contagiousness among the COVID-19 epidemic population and the transfer law of different symptomatic state changes caused by the changes in the effective number of infectious Re affected by distance,the real-time accurate prediction of the changes in the number of people in different states,and according to the distribution of the symptomatic state of the population in the same area is different,different levels of control measures are used for different levels of the area.
Key words:K-SIRD model; COVID-19; Markov-chain; the effective reproduction number
0 引言
自2019年12月以来,恰逢中国春节,COVID-19疫情在全国迅速蔓延,已波及到全球所有公民[1-4].由于COVID-19具有高传染性并且在潜伏期很难发现患者的特性,全球感染人数呈爆炸式增长,传播范围不断扩大.在此期间,六大洲114个国家、领土或地区不同程度地受到疫情影响,国内外疫情增长趋势不容乐观.截至2022年7月15日,世界卫生组织(World Health Organization,WHO)共收到了确诊病例557 917 904例,死亡病例6 358 899例.截至2022年7月11日,全球共接种疫苗12 130 881 147支[5,6].因此在当前形势下,分析疫情发展规律,预测疫情发展趋势,对有效防控疫情至关重要[7,8].
SIR模型是传统的流行病模型之一,被广泛应用于各种环境[9-12].该模型表示恒定规模人群中三类个体相对比例的发展:易感者S,能够感染疾病并具有传染性的人群;感染者I:自身表现患病症状并能够使易感者患病的人群;抵抗者R:在愈合或死亡后永久免疫或者不存在患病可能性的人群.根据人群分类不同情况,可建立SI或者SEIR等模型反应参数之间的约束关系.这些传统的传染病模型具有较强的疾病预测能力[13-15],根据感染人数的动态变化来分析传染病的感染率,通过常微分方程模型拟合过程,可以估计一些关键参数,然后利用下一代矩阵的概念,根据这些参数推导出病毒基本繁殖数R0[16,17],进而预测传染病的传播和发展趋势.然而,传统模型无法动态刻画政府防控措施[18-23]的变化对疫情发展趋势的影响,与此同时,其参数一旦确定则无法更改,缺乏了预测人员症状状态改变这一随机事件信息的动态统计特性.其次,虽然大多数常微分方程模型能够预测感染的转折点,但很少有模型能够预测第二波或第三波何时以及如何开始[24-27].随COVID19 疫情的发展,人们逐渐认识到传播系数是一个随时间变化的术语[28].
基于马尔可夫链的传染病预测模型符合现状.针对COVID-19传染病的特殊性,根据政府提出的隔离政策和居民位置的移动变化,结合流行病经典模型中核心参数在刻画症状不同状态人数的变化的重要影响,使用历史数据根据改进的K-SIRD模型统计计算下一时刻的症状状态人数数量,达到实时统计的准确性.针对数据模型的更新,马尔可夫链可以根据时间结合距离等的物理背景,更准确的考虑在COVID-19疫情过程中,传播系数的动态变化对传染病模型的影响,周期性的调整参数,对马尔可夫状态转移矩阵进行更新,从而更精确预测同一区域在未来不同时刻的管控等级,从而采取不同等级的管控措施.
1 基于马尔可夫链的 K-SIRD 模型系统框架
在流行病背景下,患者症状的严重程度差异、距疫区位置距离远近以及自身抗体具备的能力,会导致个体传染概率的差异、传染结果的不同,从而使患者症状人数有所变化.其中,人员与患者的接触距离是导致病症人数改变的主要因素.针对位置距离、疾病传染率和治愈率与人员是否被隔离对传染病传播的结果,通过改进的K-SIRD模型统计算下一时刻七种症状状态的人数数量,然后根据该实时状态数量,利用拟合的参数构建马尔可夫状态转移矩阵,预测同一区域在未来不同时刻的管控等级,从而提出对应的管控措施的方法.系统框架如图1所示.
1.1 COVID-19流行病模型中的人群状态
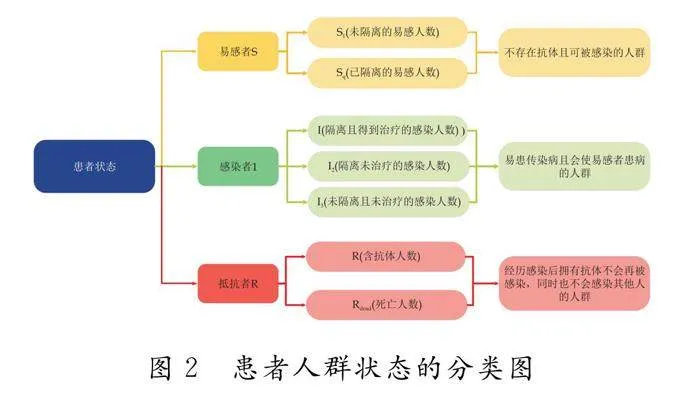
易感者S,主要表现为不存在抗体且可被感染的人群,被感染后也存在感染别人的可能,其中包括未隔离的易感人数S1和已隔离的感染人数Sq;感染者I,主要表现为已患传染病且会使易感者患病的人群,经一段时间患者可通过治疗痊愈或自动痊愈,存在抗体不在患病或者依然有再次被感染的可能,其中包括隔离且得到治疗的感染人数I1、隔离未治疗的感染人数I2和未隔离且未治疗的感染人数或称为无症状人数I3;抵抗者R,主要表现为经历感染后拥有抗体不会再被感染,同时也不会感染其他人的人群,其中包括含抗体人数R1和死亡人数Rdead.患者人群状况示意图如图2所示.
1.2 管控区划分标准与人群状态人数的对应关系
在t时刻,针对无感染风险且不会感染他人的群体,(包括抗体者R1(t)和死者Rdead(t)),所在区域采取无管控措施,该区域被称为0度管控区,记为Area0;针对已隔离但存在感染风险的群体,(包括易感者Sq(t)),所在区域采取温和管控措施,该区域被称为1度管控区,记为Area1;针对未隔离但存在感染风险的群体,(包括易感者S1(t)),所在区域采取较温和管控措施,该区域被称为2度管控区,记为Area2;针对已隔离但对他人仍存在感染风险的群体,(包括感染者I1(t)和I2(t)),所在区域采取严格管控措施,该区域被称为3度管控区,记为Area3;针对未隔离且对他人存在感染风险的群体,(包括感染者I3(t)),所在区域采取极其严格管控措施,该区域被称为4度管控区,记为Area4.管控区划分标准与人群状态人数的对应如图3所示.
2 基于马尔可夫链的 K-SIRD 模型具体算法
基于马尔可夫链的流行病模型预测方案包括三个部分:计算病毒有效繁殖数Re、设计马尔可夫链模型和设计状态转移矩阵模型.
2.1 计算有效传染数Re
假设人员的位置坐标为(x,y),其中x为位置横坐标,y为位置的纵坐标.统计一段时间内两个人的位置发生重合的次数,用以计算不同情况下人员接触的可能性.假设c1为百分数,表示被隔离在同一区域的情况下,两个人发生接触的可能性;c2为百分数,表示在未隔离的情况下,两个人发生接触的可能性.定义符号D(i,j)为非负数,表示第i个人和第j个人之间的距离,其中第i个人和第 j个人的位置坐标分别为xi,yi和 xj,yj,则D(i,j)= (xi-xj)2+(yi-yj)2,m(i,j)为第i个人和第j个人的接触密度,如式(1)所示:
m(i,j)=c1D(i,j)隔离区,第i个人和第j个人的接触密度c2D(i,j)非隔离区,第i个人和第j个人的接触密度
(1)
假设M为某一百分数,表示人员发生交互的可能性,如式(2)所示:
M=1N∑Ni∑Njm(i,j)
(2)
式(2)中:N为某一非负整数,表示某个区域中的总人数.
假设β为百分数,表示COVID-19疫情的传染率;r为百分数,表示COVID-19疫情的治愈率.通过交互的可能性计算传染病的有效传染数.有效传染数如式(3)所示:
Re=β*M-(1-n)*r*N
(3)
式(3)中:n为百分数,表示患者治愈后含有抗体且不再患病的人数比例.
2.2 构造K-SIRD传染病模型
假设ε为百分数,表示隔离的易感者转向未隔离的易感者的比例;根据是否被隔离,将易感者分为隔离的易感者和未隔离的易感者,定义k1为隔离的易感者在易感者总人数的占比,即k1=S1S;1-k1为未隔离的易感者在易感者总人数的占比,即(1-k1)=SqS;ε为隔离的易感者转为未隔离的易感者的占比.根据是否被隔离和治疗,本方案将感染者分为已治疗、隔离未治疗和未隔离未治疗的感染者,定义λ为经受治疗的感染者人数在感染者总人数的占比,即λ=I1I;1-λ为未受治疗的感染者人数在感染者总人数的占比,即(1-λ)=I2+I3I;k2为在隔离情况下,未治疗的感染者人数在未治疗感染者总人数的占比,即k2=I2I2+I3;1-k2为在未隔离情况下,未治疗的感染者人数在未治疗感染者总人数的占比,即(1-k2)=I3I2+I3.定义α为含抗体者人数在抵抗者人数的占比,即α=R1R;1-α为死者人数在抵抗者人数的占比,即1-α=RdeadR.各状态人员人数占比如图4所示.
每日发病病例数估计:本研究采用K-SIRD模型对一段时间内的发病病例数和累计病例数进行拟合,对下一时间段的发病病例数进行预测.假设在t时刻,区域内的总人数为N(t),未隔离的易感人数为S1(t),已隔离的感染人数为Sq(t),隔离且得到治疗的感染人数为I1(t),隔离未治疗的感染人数为I2(t),未隔离且未治疗的感染人数为I3(t),含抗体人数为R1(t),死亡人数为Rdead(t).其微分方程如式(4)所示:
dS1(t)dt=εSq(t)-K1R0(I1(t)+I(t)1+I3(t))S1(t)+Sq(t)N(t)
dSq(t)dt=nr(I1(t)+I(t)1+I3(t))-εSq(t)-(1-K1)R0(I1(t)+I(t)1+I3(t))S1(t)+Sq(t)N(t)
dI1(t)dt=λR0S1(t)+Sq(t)N(t)(I1(t)+I(t)1+I3(t))-(1-n)rI1(t)-nrI1(t)
dI2(t)dt=k2(1-λ)R0S1(t)+Sq(t)N(t)(I1(t)+I(t)1+I3(t))-(1-n)rI2(t)-nrI2(t)
dI3(t)dt=(1-k2)(1-λ)R0S1(t)+Sq(t)N(t)(I1(t)+I(t)1+I3(t))-(1-n)rI3(t)-nrI3(t)
dR1(t)dt=(1-n)r(I1(t)+I(t)1+I3(t))α
dRdead(t)dt=(1-n)r(I1(t)+I(t)1+I3(t))(1-α)
(4)
式(4)中:N(t)为恒定值,且N(t)=S1(t)+Sq(t)+I1(t)+I2(t)+I3(t)+R1(t)+Rdead(t).
2.3 设计状态转移矩阵模型
根据上述设计,管控区划分标准与人群状态人数的对应如下:在t时刻,针对无感染风险且不会感染他人的群体(包括抗体者R1(t)和死者Rdead(t)),所在区域采取无管控措施,记此事件为μ0,该区域被称为0度管控区,记为Area0;针对已隔离但存在感染风险的群体(包括易感者Sq(t)),所在区域采取温和管控措施,记此事件为μ1,该区域被称为1度管控区,记为Area1;针对未隔离但存在感染风险的群体(包括易感者S1(t)),所在区域采取较温和管控措施,记此事件为μ2,该区域被称为2度管控区,记为Area2;针对已隔离但对他人仍存在感染风险的群体(包括感染者I1(t)和I2(t)),所在区域采取严格管控措施,记此事件为μ3,该区域被称为3度管控区,记为Area3;针对未隔离且对他人存在感染风险的群体(包括感染者I3(t)),所在区域采取极其严格管控措施,记此事件为μ4,该区域被称为4度管控区,记为Area4.根据参数拟合结果对不同事件,得到对未来时刻区域管控级别的预测,相关参数拟合的马尔可夫状态转移矩阵模型如图5所示.
其中,t∈[1,7],已知在t时刻,区域管控等级从状态i在下一时刻转移到状态j的概率计算如式(5)所示:
Pij=P(μt+1=μj,|μt=μi)
(5)
由此可得马尔可夫状态概率矩阵P如式(6)所示:
P=P00P01P02P03P04
P10P11P12P13P14
P20P21P22P23P24
P30P31P32P33P34
P40P41P42P43P44
(6)
现已知t时刻研究区域的各状态的人数,根据公式(5)、公式(6)和图5计算当前时刻的区域管控等级,因此,在t+1时刻,对研究区域的传染病所处管控等级的概率预测如式(7)所示:
μk(t+1)=μk(0)*Pt+1
(7)
式(7)中:符号μk(0)和μk(t+1)分别表示研究区域k管控等级的初始状态分布和预测的t+1时刻的管控等级分布,取μk(t+1)预测矩阵中概率分布最大的状态作为管控等级预测结果.若 μk(t+1)=[0,1,0,0,0],则根据预测,该区域在下一时刻采用的管控措施为温和管控,其所研究的区域被确定为1度管控区.
3 实验结果与分析
3.1 位置数据集
使用国家卫生健康委员会(卫健委)官方网站和WHO-中国联合调查组COVID-19报告中获取中国北京2022年11月19日至12月8日的每日报告病例和报告死亡病例数.
3.2 实验设置
基于马尔可夫链的传染病预测模型是在 Windows 11环境下Python3.8.12、pytorch 1.10.0, CUDA 10.0的编程环境下实现的.
3.3 结果及其分析
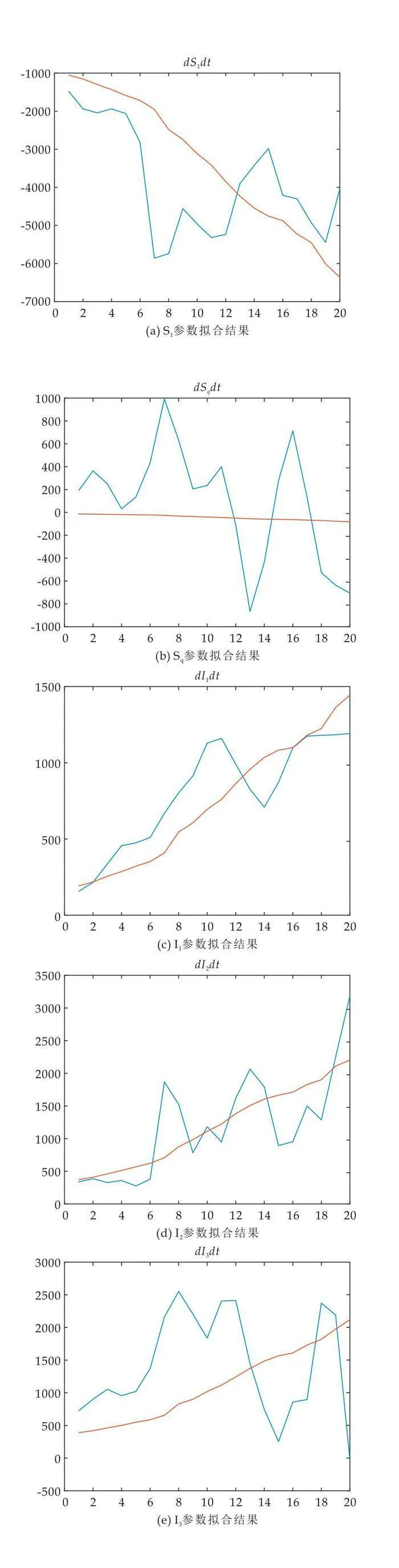
以11月19日中国北京各状态人群的人数设置为初始值对未来14天各状态人数变化进行预测,经多次实验,在各参数满足以下初始值时,得到多组参数的解.选取预测误差值小于1%的一组参数拟合值,如表1所示.其中初始值设定为N=21 886 000,S1=21 867 489,Sq=492, I1=6 581,I2=3 798,I3=2 600,R1=5 030,Rdead=10.本部分内容利用MATLAB软件完成.各参数拟合的折线图如图 6(a)~(g) 所示.
3.3.1 北京市疫情预测
利用拟合的参数,预测了2022年12月2日至2022年12月8日期间北京六个不同状态下的人口数量.预测结果如图7(a)~(f)所示.
由预测结果可以看出模型有良好的预测性能,通过结合疫情传播中人群的隔离率等因素,模型能够准确预测疫情的发展趋势,有较高的准确性和可靠性.这为政策制定者、公共卫生机构和科研人员提供了重要的参考依据,有助于更好地应对新冠疫情的挑战.
中国政府一直高度重视疫情防控工作,采取了多项措施来控制疫情.中国政府在疫情初期就采取了积极的措施来控制疫情,包括采取大规模的社交隔离、加强医疗卫生体系建设、推广健康生活方式等.这些措施有效地减缓了病毒传播的速度,使得北京市2022年11月19日至2022年12月8日死亡人数Rdead较少并较为稳定,其结果统计图如图8所示.
3.3.2 北京市疫情管控等级预测
根据上述参数的拟合结果,构建马尔科夫状态转换矩阵如下:
P=10000
4.5×10-69.8×10-17.5×10-88.3×10-33.1×10-3
4.4×10-44.5×10-40.898.1×10-23.0×10-2
6.6×10-35.5×10-34.0×10-100.620.37
3.2×10-32.7×10-32.0×10-102.3×10-50.99
根据不同条件预测未来的管控等级,当前区域转变为0度管控区所需的时间如表2所示.
根据以上描述,由于中国有效的管理政策,疫情得到了很好的控制.中国政府一贯高度重视疫情防控工作,采取了多项措施控制疫情.在疫情初期,中国政府迅速采取主动措施,包括实施大规模社会隔离,加强医疗卫生体系建设,倡导健康生活方式等.这些措施有效地减缓了病毒的传播,使各地最终从其他管控区域转变为Area0.
4 结论
通过隔离率k1、k2、传染率β、治愈率r、人员间距离D(i,j)等参数的刻画,K-SIRD模型对未来一段时间内疫情发展结果的预测准确度高,适用于COVID-19流行病背景下,针对不同状态人员人数发展趋势的预测.通过MATLAB参数拟合实验对比,实际数据和预测数据在K-SIRD模型下都能很好地捕捉到疫情发展的趋势,证实了该模型的可靠性.同时,考虑到隔离率对疫情传播的影响,根据参数拟合结果构造马尔可夫状态转移矩阵,对当前的疫情区域管控进行预测.实验证明,针对任何级别的管控措施最终都会回归到无管控区域,与理论研究一致,当有效繁殖数Relt;1时,传染病将会逐渐消失.利用该模型对管控区域进行预测,为今后的疫情防控提供了有益的参考.通过对不同因素的分析和研究,有助于制定更加科学合理的防控策略,以提高应对疫情挑战的有效性.
参考文献
[1] Kumar A,Singh R,Kaur J,et al.Wuhan to world:The COVID-19 pandemic[J].Frontiers in Cellular and Infection Microbiology,2021,11:596 201.
[2] He S,Peng Y,Sun K.SEIR modeling of the COVID-19 and its dynamics\.Nonlinear Dynamics,2020,101:1 667-1 680.
[3] Chen J,Wu L,Zhang J,et al.Deep learning-based model for detecting 2019 novel coronavirus pneumonia on high-resolution computed tomography[J].Scientific Reports,2020,10(1):19 196.
[4] Ahmed I,Ahmad M,Rodrigues J J P C,et al.A deep learning-based social distance monitoring framework for COVID-19[J].Sustainable Cities and Society,2021,65:102 571.
[5] World Health Organization.A systematic approach to monitoring and analysing public health and social measures in the context of the COVID-19 pandemic:Underlying methodology and application of the PHSM database and PHSM Severity Index:Updated July 2022[R].World Health Organization,Regional Office for Europe,2022.
[6] Rahman M Z,Akbar M A,Leiva V,et al.An intelligent health monitoring and diagnosis system based on the internet of things and fuzzy logic for cardiac arrhythmia COVID-19 patients[J].Computers in Biology and Medicine,2023,154:106 583.
[7] Zakary O,Rachik M,Elmouki I.On the impact of awareness programs in HIV/AIDS prevention:An SIR model with optimal control[J].International Journal of" Computer Applications in Technology,2016,133(9):1-6.
[8] Rizkalla C,Blanco Silva F,Gruver S.Modeling the impact of Ebola and bushmeat hunting on western lowland gorillas[J].EcoHealth,2007,4:151-155.
[9] Wang X,Shi P,Li J,et al.Privacy-preserving mechanisms of continuous location queries based on LBS:A comprehensive survey[C]//2022 27th International Conference on Automation and Computing(ICAC).Bristol,United Kingdom:IEEE,2022:1-6.
[10] Berge T,Lubuma J M S,Moremedi G M,et al.A simple mathematical model for Ebola in Africa[J].Journal of Biological Dynamics,2017,11(1):42-74.
[11] 成云云,白艳萍,续 婷,等.基于SSA-PSO-GSA-SVR的全球新冠肺炎疫情分析及预测[J].陕西科技大学学报,2022,40(3):192-199,206.
[12] Wang J ,Liu Y ,Liu X ,et al.A modified SIR model for the COVID-19 epidemic in China[J].Journal of Physics:Conference Series,2022,2 148(1):012 002.
[13] Efimov D,Ushirobira R.On an interval prediction of COVID-19 development based on a SEIR epidemic model[J].Annual Reviews in Control,2021,51:477-487.
[14] Gu B.Forecast and analysis of COVID-19 epidemic based on SEIR model[C]//Journal of Physics:Conference Series.IOP Publishing.Busan,South Korea:IEEE,2021:042 050.
[15] Zheng N,Du S,Wang J,et al.Predicting COVID-19 in China using hybrid AI model[J].IEEE Transactions on Cybernetics,2020,50(7):2 891-2 904.
[16] Randolph H E,Barreiro L B.Herd immunity:Understanding COVID-19[J].Immunity,2020,52(5):737-741.
[17] Britton T,Ball F,Trapman P.A mathematical model reveals the influence of population heterogeneity on herd immunity to SARS-CoV-2[J].Science,2020,369(6 505):846-849.
[18] Xu Z,Zhang H,Huang Z.A continuous markov-chain model for the simulation of COVID-19 epidemic dynamics[J].Biology,2022,11(2):190.
[19] Khan M A,Shah S W,Ullah S,et al.A dynamical model of asymptomatic carrier zika virus with optimal control strategies[J].Nonlinear Analysis:Real World Applications,2019,50:144-170.
[20] He S,Tang S,Rong L.A discrete stochastic model of the COVID-19 outbreak:Forecast and control[J].Math.Biosci.Eng.,2020,17(4):2 792-2 804.
[21] Tang B,Bragazzi N L,Li Q,et al.An updated estimation of the risk of transmission of the novel coronavirus (2019-nCov) [J].Infectious Disease Modelling,2020,5:248-255.
[22] Allotey J,Fernandez S,Bonet M,et al.Clinical manifestations,risk factors,and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy:Living systematic review and meta-analysis[J].BMJ,2020,370:m3 320.
[23] Li Y,Zhao R,Zheng S,et al.Lack of vertical transmission of severe acute respiratory syndrome coronavirus 2,China[J].Emerging Infectious Diseases,2020,26(6):1 335.
[24] Toprceanu A,Precup R E.A novel geo-hierarchical population mobility model for spatial spreading of resurgent epidemics[J].Scientific Reports,2021,11(1):14 341.
[25] Cacciapaglia G,Cot C,Sannino F.Multiwave pandemic dynamics explained:How to tame the next wave of infectious diseases[J].Scientific Reports,2021,11(1):6 638.
[26] Menda K,Laird L,Kochenderfer M J,et al.Explaining COVID-19 outbreaks with reactive SEIRD models[J].Scientific Reports,2021,11(1):17 905.
[27] Beira M J,Sebastio P J.A differential equations model-fitting analysis of COVID-19 epidemiological data to explain multi-wave dynamics[J].Scientific Reports,2021,11(1):16 312.
[28] Martsenyuk V,Bernas M,Klos Witkowska A.Two-strain COVID-19 model using delayed dynamic system and big data[J].IEEE Access,2021,9:113 866-113 878.
【责任编辑:蒋亚儒】
