EEF1A1对急性心肌梗死模型大鼠心肌细胞凋亡及Notch/AKT转导途径的影响
2024-12-31朱涛张为民阿不都乃比•麦麦提艾力刘正艾克热木•吐尔逊霍强




摘要" 目的:探讨人类真核翻译延长因子(EEF1A1)对急性心肌梗死(AMI)模型大鼠心肌细胞凋亡及Notch/蛋白激酶B(AKT)转导途径的影响。方法:将30只SD雄性大鼠随机分为假手术组、模型组、干预组,每组10只,模型组、干预组于冠状动脉左前降支结扎建立AMI大鼠模型,对照组仅手术穿线处理不结扎。建模后24 h干预组于心肌梗死区原位注射EEF1A1腺病毒,模型组、对照组注射等量生理盐水。干预72 h 后,心脏彩超测定大鼠心功能,采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)染色法评估心肌细胞凋亡,2,3,5-氯化三苯基四氮唑(TCC)染色法评估心肌梗死面积,采用实时定量聚合酶链式反应(RT-PCR)法测定EEF1A1 mRNA表达量,蛋白免疫印迹法(Western Blot)检测心肌组织EEF1A1蛋白以及Notch/AKT信号通路相关蛋白表达情况。结果:干预前,模型组、干预组左室射血分数(LVEF)明显低于假手术组(P<0.05),而左心室收缩末期内径(LVESD)、左心室舒张末期内径(LVEDD)明显高于假手术组(P<0.05);干预后3 d后,干预组LVEDD、LVESD明显降低,而LVEF明显增加,模型组LVEDD、LVESD 明显增加,而LVEF明显降低,差异均有统计学意义(P<0.05)。干预组心肌组织EEF1A1蛋白及mRNA表达水平高于假手术组、模型组(P<0.05),而模型组心肌组织EEF1A1蛋白及mRNA表达水平高于假手术组(P<0.05)。干预组心肌梗死面积小于模型组(P<0.05)。干预组心肌细胞凋亡率明显高于假手术组(P<0.05),明显低于模型组(P<0.05)。干预组Notch1、Hes1、磷酸化AKT(p-AKT)/AKT相关蛋白表达明显高于模型组、假手术组,模型组Notch1、Hes1、p-AKT/AKT相关蛋白表达均明显高于假手术组(P<0.05)。结论:EEF1A1可抑制AMI大鼠心肌细胞损伤、凋亡,缩小心肌梗死面积,改善心脏功能,其作用机制可能与上调Notch/AKT转导途径有关。
关键词" 急性心肌梗死;人类真核翻译延长因子;细胞凋亡;心脏功能;Notch/AKT转导途径;实验研究
doi:10.12102/j.issn.1672-1349.2024.19.010
Effect of EEF1A1 on Myocardial Cell Apoptosis and Notch/AKT Transduction Pathway in Rats with Acute Myocardial Infarction
ZHU Tao, ZHANG Weimin, Abe Dunabi·Mai Mai Ti Ai Li, LIU Zheng, Ai Ke Re Mu·Tu Er Xun, HUO Qiang
The First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, Xinjiang, China
Corresponding Authornbsp;" HUO Qiang, E-mail: zhup9992@163.com
Abstract" Objective:To explore the effect of homo sapiens eukaryotic translation elongation factor 1 alpha 1(EEF1A1) on myocardial cell apoptosis and Notch/protein kinase B(AKT) transduction pathway in acute myocardial infarction(AMI)" rats model.Methods:Thirty male SD rats were randomly divided into sham operation group,model group,and intervention group,with 10 rats in each group.The rats in model group and intervention group" AMI rat model,established" by ligating the left anterior descending coronary artery,while the control group only underwent surgical threading without ligation.Twenty-four hours after establishment,the rats in intervention group were injected with EEF1A1 adenovirus in situ in the myocardial infarction area,and the rats in model group and control group were injected with the same volume of normal saline.After 72 hours of intervention,the cardiao function was measured by color Doppler ultrasound,the apoptosis of cardiao myocytes was evaluated by Terminal-deoxynucleoitidyl Transferase Mediated Nick End Labeling(TUNEL) staining method,the infarct area was evaluated by 2,3,5-triphenyltetrazolium chloride(TCC) staining method,the expression of EEF1A1 mRNA was measured by real-time quantitative PCR method,and the expression of EEF1A1 protein and Notch/AKT signal pathway related protein in myocardial tissue was detected by Western Blot.Results:Before intervention,left ventricular ejection fraction(LVEF) in the model group and intervention group was significantly lower than that in the sham operation group,while left ventricular end-diastolic dimension(LVEDD) and left ventricular end-systolic diameter(LVESD) were significantly higher than those in sham operation group(P<0.05).After 3 days of intervention,LVEDD and LVESD in intervention group significantly decreased,while LVEF significantly increased,and LVEDD and LVESD in" model group" significantly increased,while LVEF significantly decreased,and the differences were statistically significant(P<0.05).The expression levels of myocardial EEF1A1 protein and mRNA in intervention group were higher than those in sham operation group and" model group(P<0.05),and the expression levels of myocardial EEF1A1 protein and mRNA in model group were higher than those in sham operation group(P<0.05).The myocardial infarct size in intervention group was significantly lower than that in model group(P<0.05).The apoptosis rate of myocardial cells in intervention group was higher than that in sham operation group(P<0.05),and lower than that in model group(P<0.05).The levels of Notch1,Hes1,and phosphorylated AKT(p-AKT)/AKT-related proteins in intervention group were higher than those in model group and sham operation group(P<0.05).The levels of Notch1,Hes1,and p-AKT/AKT-related proteins in model group were higher than those in sham operation group(P<0.05).Conclusion:EEF1A1 can inhibit myocardial cell injury and apoptosis,reduce myocardial infarction area,and improve cardiac function in AMI rats.Its mechanism may be related to the up-regulation of Notch/AKT transduction pathway.
Keywords"""" acute myocardial infarction; eukaryotic translation elongation factor 1 alpha1; cell apoptosis; cardiac function; Notch/protein kinase B transduction pathway; experimental study
基金项目" 国家自然科学基金项目(No.82060907)
作者单位" 新疆医科大学第一附属医院(乌鲁木齐 830054)
通讯作者" 霍强,E-mail:zhup9992@163.com
引用信息" 朱涛,张为民,阿不都乃比·麦麦提艾力,等.EEF1A1对急性心肌梗死模型大鼠心肌细胞凋亡及Notch/AKT转导途径的影响[J].中西医结合心脑血管病杂志,2024,22(19):3519-3523.
尽管介入治疗、溶栓治疗等治疗方法不断发展,但急性心肌梗死(acute myocardial infarction,AMI)致死率仍处较高水平,其中心肌细胞凋亡引起心肌损伤、心室重构,损伤心脏收缩、收缩功能,增加病人不良预后风险,因此,改善AMI病人心肌细胞凋亡具有重要临床意义[1-2]。近年来,临床研究一直重点关注阻断心肌细胞凋亡的有效分子靶点,有助于促进AMI心肌组织损伤修复,降低心力衰竭、死亡风险。Notch/蛋白激酶B(AKT)通路是调控心肌细胞凋亡的重要信号通路,不仅调控哺乳动物胚胎期的心脏发育过程,还能调控心血管系统的生理、病理过程,参与调控受损心肌细胞的修复,调控下游核因子-κB(NF-κB)信号通路而影响心室重构,有助于改善左心室舒张功能以及心室重构[3-4]。人类真核翻译延长因子(eukaryotic translation elongation factor 1 alpha1,EEF1A1)是广泛存在于各种组织、细胞的翻译延长因子,具有多种生物学功能,包括细胞增殖、凋亡、老化、细胞骨架重组以及胚胎形成、蛋白降解等[5-6],有研究表明,EEF1A1在大鼠AMI时出现表达异常,与心肌损伤后蛋白质合成及细胞凋亡等密切关联[7],EEF1A1具有成为AMI治疗靶点的潜力。因此,EEF1A1参与调控心肌细胞凋亡的过程可能与Notch/AKT信号通路有关。本研究通过建立大鼠AMI模型,观察EEF1A1对AMI模型大鼠心肌细胞凋亡、心功能的影响,分析其与Notch/AKT转导途径的关系,从而为治疗AMI提供新的潜在靶点。
1" 材料与方法
1.1" 材料与仪器
选取30只10~12周龄的成年雄性SD大鼠,体质量190~230 g,购自上海西普尔必凯实验动物有限公司。于无特定病原体(SPF)级实验动物中心通风饲养,自由饮食、饮水,室内温度(22±2)℃,相对湿度40%~60%。
EEF1A1过表达质粒构建及其腺病毒(2×1010 PFU /mL)包装、浓缩和纯化来源于上海吉凯基因化学技术有限公司。0.9%氯化钠注射液购自石家庄第四制药厂。磷酸缓冲盐溶液(PBS)、戊巴比妥钠等均购自于Sigma公司。TRIzol试剂购自美国Thermo Fisher Scientific公司。2,3,5-氯化三苯基四氮唑(TCC)试剂购自北京索莱宝科技有限公司。脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司。兔多克隆抗体甘油醛-3-磷酸脱氢酶(GAPDH)、Notch、AKT购自美国CST公司,兔多克隆抗体EEF1A1购自美国 Novus Biologicals 公司,兔抗Notch受体1、磷酸化AKT单克隆抗体购自美国Abcam公司,辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)购自北京博奥森。
心脏超声诊断仪购自美国GE公司;离心机购自美国Thermo公司;分析天平购自梅特勒托利多公司;冰冻切片机购自德国Zeis;全自动生化分析仪购自日本日立;CX23型显微镜购自日本奥林巴斯。
1.2" 方法
大鼠AMI模型的建立:模型组、干预组采用冠状动脉左前降支结扎术进行建模,具体过程为腹腔注射戊巴比妥钠,颈正中开切口,露出气管,气管插管,连接呼吸机。在大鼠左胸第4肋与第5肋间打开胸腔,露出心脏,左心耳和肺动脉圆锥间进针,结扎左冠状动脉前降支处,逐层缝合切口。结扎处变白,心电图监测显示ST段抬高呈弓背向上型,表明AMI模型成功建立。假手术组仅于左冠状动脉前降支处穿线处理,未给予结扎。术后所有大鼠均肌内注射80 000 U青霉素。3组大鼠均于术后给药,干预组于心肌梗死区域的3个位点分别注射10 μL的EEF1A1腺病毒(2×1010 PFU/mL),模型组、假手术组仅以同样的方式给予等体积的生理盐水,72 h后处死大鼠,分离获取心脏,保存于-80 ℃。
1.3" 检测指标
1.3.1" 心功能指标
干预前、干预后72 h检测心功能指标。腹腔注射戊巴比妥钠麻醉处理进行检查,包括左心室射血分数(LVEF)、左心室收缩末期内径(LVESD)、左心室舒张末期内径(LVEDD)。
1.3.2" 心肌梗死面积
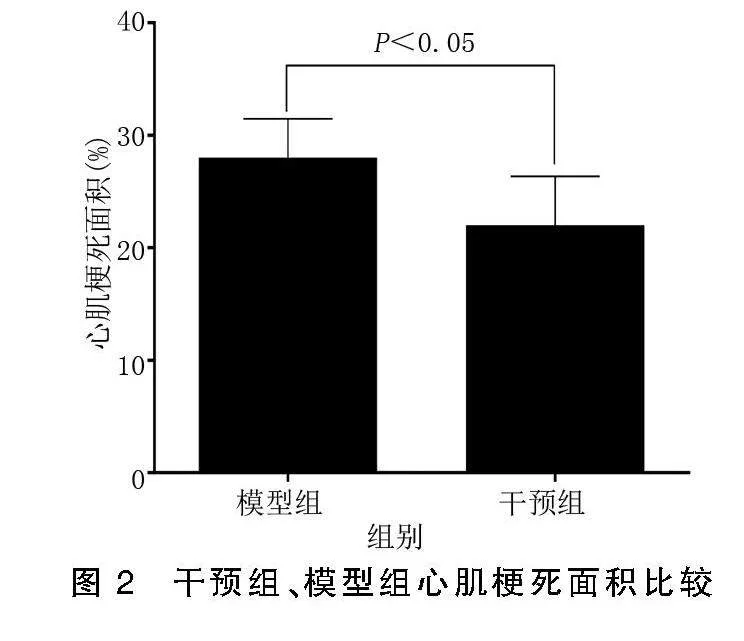
干预后72 h处理大鼠,分离获取心脏组织,采用TCC染色法评估大鼠心肌梗死面积。清理心脏周围血液、血管结构等,多聚甲醛固定,心尖至结扎点间冰冻切片,厚度4 μm,1% TCC染液染色,37 ℃避光孵育15 min,拍照观察,采用Image ProPlus 6.0软件计算心肌梗死面积,心肌梗死区域呈白色,正常心肌区域呈红色。梗死面积百分比=白色区域面积/切面总面积×100%。
1.3.3" 心肌细胞凋亡
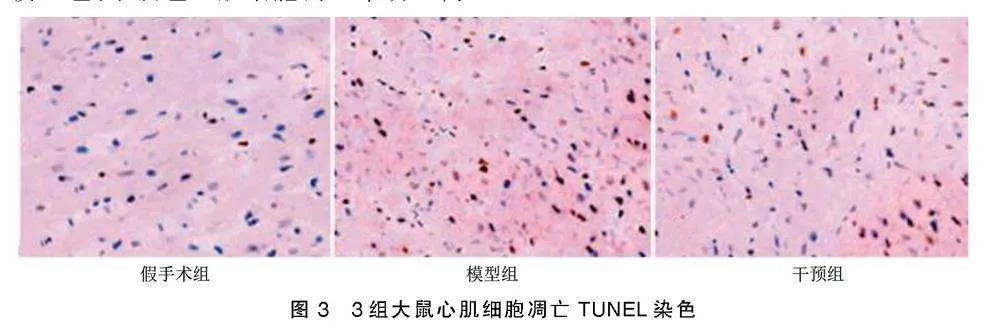
扎线以下部分左心室心肌于多聚甲醛溶液中固定,石蜡包埋,切片,采用TUNEL试剂盒进行检测,每张切片随机选择5个视野,凋亡心肌细胞的细胞核呈棕褐色,记录细胞总数和凋亡数,计算细胞凋亡率。
1.3.4" 心肌组织EEF1A1蛋白以及mRNA表达
采用实时定量聚合酶链式反应(RT-PCR)检测3组大鼠心肌组织EEF1A1蛋白以及mRNA表达。
1.3.5" Notch/AKT信号通路相关蛋白的检测
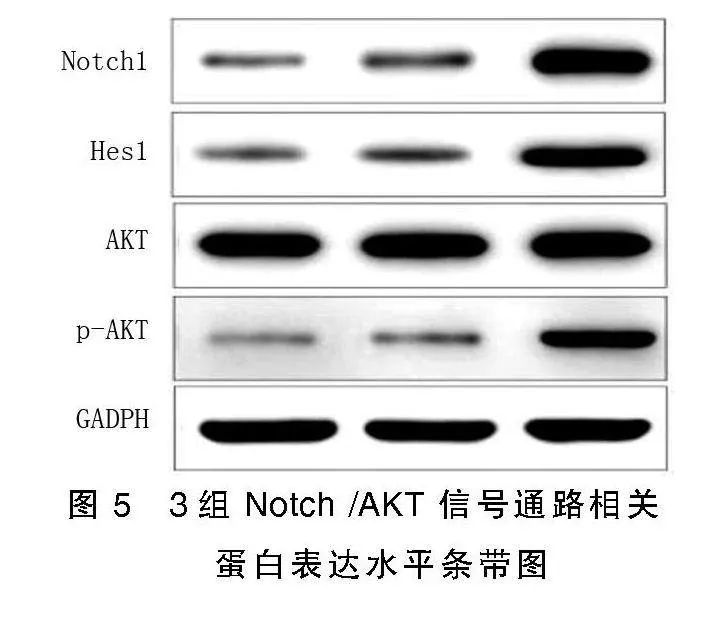
采用蛋白免疫印迹法(Western Blot)测定心肌组织蛋白表达水平,获取心肌组织后研磨处理,RIPA裂解液裂解30 min,12 000 r/min离心10 min,分离获取上清液,二喹啉甲酸(BCA)法测定蛋白含量。取20 μg蛋白,加入10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶中,电泳分离,转膜,封闭1 h,取膜,TBST清洗,抗Notch1(1∶400)、Hes1(1∶400)、AKT(1∶1 000)、磷酸化AKT(p-AKT,1∶1 000)一抗和辣根过氧化物酶标记的二抗孵育,温孵育1 h后,TBST洗涤3次,滴加增强化学发光试剂(enhanced chemiluminescence,ECL)发光液,曝光显影,以GAPDH为内参,目的条带与GAPDH灰度值比值即为各蛋白相对表达量。
1.4" 统计学处理
采用SPSS 19.0软件进行统计学分析。符合正态分布的定量资料以均数±标准差(x±s)表示,组间两两比较应用LSD-t检验,多组间比较采用方差分析。以P<0.05为差异有统计学意义。
2" 结" 果
2.1" 3组大鼠心功能指标比较
干预前,模型组、干预组LVEF明显低于假手术组,而LVEDD、LVESD明显高于假手术组,差异均有统计学意义(P<0.05);干预后3 d,干预组LVEDD、LVESD 明显降低,而LVEF明显增加,模型组LVEDD、LVESD 明显增加,而LVEF明显降低,差异均有统计学意义(P<0.05);假手术组干预后3 d心功能指标无明显变化(P>0.05)。详见表1。
2.2" 3组大鼠心肌组织EEF1A1蛋白以及mRNA表达
3组大鼠心肌组织EEF1A1蛋白及mRNA表达比较,差异均有统计学意义(P<0.001)。干预组大鼠心肌组织EEF1A1蛋白及mRNA表达水平高于假手术组、模型组(P<0.05),而模型组大鼠心肌组织EEF1A1蛋白及mRNA表达高于假手术组(P<0.05)。详见表2、图1。
2.3" 3组大鼠心肌梗死面积比较
假手术组未能检测出明显的心肌梗死,干预组心肌梗死面积小于模型组(P<0.05)。详见图2。
2.4" 3组大鼠心肌细胞凋亡比较
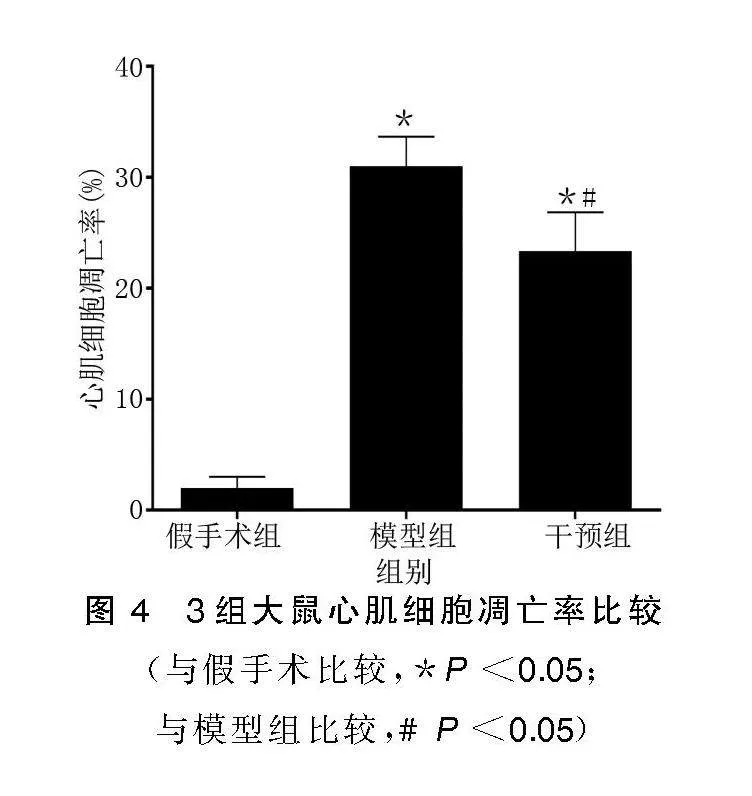
3组大鼠心肌细胞凋亡率比较差异有统计学意义(P<0.05)。模型组、干预组心肌细胞凋亡率明显高于假手术组(P<0.05),干预组心肌细胞凋亡率明显低于模型组(P<0.05)。详见图3、图4。
(与假手术比较,*P<0.05;与模型组比较,#P<0.05)
2.5" 3组大鼠心肌组织Notch /AKT信号通路相关蛋白表达比较
3组大鼠心肌组织Notch/AKT信号通路相关蛋白表达比较,差异均有统计学意义(P<0.001)。干预组Notch1、Hes1、p-AKT/AKT信号通路相关蛋白表达量明显高于模型组、假手术组(P<0.05),模型组Notch1、Hes1、p-AKT/AKT信号通路相关蛋白表达均明显高于假手术组(P<0.05)。详见图5、表3。
3" 讨" 论
AMI的病理机制为冠状动脉粥样硬化狭窄、斑块破裂、血栓形成,导致冠状动脉急性、持续性缺血缺氧,进而引起心肌细胞死亡[8]。心肌细胞凋亡是心肌梗死进展至心力衰竭的关键过程,心肌细胞持续性缺血缺氧会刺激氧化应激反应,破坏线粒体膜通透性和损伤线粒体DNA,并触发细胞色素C进入细胞质,结合凋亡蛋白相关激酶,从而诱导细胞凋亡[9]。EEF1A1广泛表达于机体各个组织和器官,含量仅次于肌钙蛋白,参与蛋白翻译延伸,具有广泛的生物学效应,如调控细胞的分裂、增殖、凋亡等生物学过程,切断微管并参与细胞周期中的微管重组,与肌动蛋白结合,参与锚定β-肌动蛋白mRNA,有研究发现,EEF1A1在心肌细胞凋亡及蛋白降解等方面具有重要调控作用[10-11]。顾红娟等[7]研究发现,AMI模型大鼠心肌组织中EEF1A1表达异常,可能参与调控心肌梗死后左室重构,为研究左室重构的病理生理机制提供线索,可能指导AMI治疗靶点的研究。
本研究于大鼠冠状动脉左前降支进行结扎构建了AMI模型,心电图监测显示ST段抬高呈弓背向上型,表明模型成功建立。本研究结果显示,模型组LVEF明显低于假手术组,而LVEDD、LVESD明显高于假手术组(P<0.05),且模型组大鼠心脏出现大面积心肌梗死,心肌细胞凋亡率也明显高于假手术组,表现出明显的心功能下降。为了进一步研究EEF1A1在AMI过程中的效果,本研究中,干预组于心肌组织原位注射EEF1A1过表达腺病毒,干预组EEF1A1蛋白、mRNA表达量明显提高,且LVEF明显高于模型组,LVEDD、LVESD明显低于模型组,表明提高心肌组织EEF1A1表达水平可改善AMI大鼠心功能。同时,研究发现AMI大鼠经过EEF1A1处理后,心肌梗死面积明显缩小,心肌细胞凋亡率明显降低,进一步提示EEF1A1过表达能抑制心肌细胞凋亡,改善心肌梗死症状。既往研究也证实EEF1A1高表达可抑制与Caspase相关的细胞凋亡,同样在骨骼肌细胞成熟分化过程中EEF1A1持续表达,而在血清诱导的细胞凋亡过程中EEF1A1表达明显降低,当使用腺病毒转染EEF1A1后,可促进肌管合成,延缓细胞凋亡[12-13],结合本研究结果进一步证实EEF1A1在心肌细胞凋亡中发挥保护作用,可延缓心肌组织损伤,缩小心肌梗死面积,对于治疗AMI具有重要意义。
Notch/AKT转导途径是调控心肌细胞凋亡的重要信号通路,激活该通路可诱导血管生成,改善心肌细胞血流供应,从而抑制心肌细胞凋亡[14]。有研究表明,Notch/AKT转导途径参与心脏发育、瓣膜及肌小梁的形成,其中Notch1受体在心脏中多见,且动物实验也证实敲除Notch1基因则加重AMI模型小鼠心肌肥厚反应,上调Notch1表达可缓解心肌损伤,从而发挥心肌细胞保护作用[15-16]。本研究发现,AMI模型大鼠Notch/AKT转导途径相关mRNA表达量均明显高于假手术组,分析认为AMI大鼠持续性的心肌损伤诱导Notch/AKT信号通路表达代偿性上调,同时AMI大鼠给予EEF1A1后,Notch/AKT信号通路表达进一步上调,表明EEF1A1可激活Notch/AKT信号通路,从而促进心肌细胞的生长、增殖,阻止细胞凋亡,降低心肌组织损伤程度,故而病理结果显示,干预组大鼠心肌纤维、横纹损伤程度明显低于模型组。在乳腺癌、肝癌等肿瘤细胞模型中也证实,EEF1A1高表达可促进细胞生长、增殖,抑制细胞凋亡,其作用机制与上调磷酸化磷脂酰肌醇-3激酶(PI3K)/AKT/哺乳动物雷帕霉素靶蛋白(mTOR)、AKT/NF-κB等信号通路有关[17]。同时有研究表明,Notch信号通路可激活P13K/AKT通路而抗细胞凋亡,还能直接调控多种细胞凋亡相关因子(Bax、Bcl-2、Caspase- 3等)的表达,从而抑制心肌细胞凋亡[18]。基于以上研究结果,进一步证实上调EEF1A1的表达能激活Notch/AKT转导途径,从而促进心肌细胞再生,减少细胞凋亡,有助于改善AMI大鼠心肌梗死、心室重构,利于心功能的恢复。
综上所述,EEF1A1可抑制AMI大鼠心肌细胞损伤、凋亡,缩小心肌梗死面积,改善心脏功能,其作用机制可能与上调Notch/AKT转导途径有关。
参考文献:[1]" KAPUR N K,THAYER K L,ZWECK E.Cardiogenic shock in the setting of acute myocardial infarction[J].Methodist DeBakey Cardiovascular Journal,2020,16(1):16-21.
[2]" DAMLUJI A A,VAN DIEPEN S,KATZ J N,et al.Mechanical complications of acute myocardial infarction:a scientific statement from the American Heart Association[J].Circulation,2021,144(2):e16-e35.
[3]" HASHMI S,AHMAD H R.Molecular switch model for cardiomyocyte proliferation[J].Cell Regeneration,2019,8(1):12-20.
[4]" KACHANOVA O,LOBOV A,MALASHICHEVA A.The role of the Notch signaling pathway in recovery of cardiac function after myocardial infarction[J].International Journal of Molecular Sciences,2022,23(20):12509.
[5]" GAO C,GONG J L,CAO N,et al.Lipid-independent activation of a muscle-specific PKCα splicing variant[J].American Journal of Physiology Heart and Circulatory Physiology,2022,323(4):H825-H832.
[6]" DUMAN M,VAQUIA,NOCERA G,et al.EEF1A1 deacetylation enables transcriptional activation of remyelination[J].Nature Communications,2020,11(1):3420.
[7]" 顾红娟,贡郡丽.Eef1a1及JUP蛋白在心肌梗死后左室重构大鼠心肌中的表达[J].中国实验诊断学,2012,16(10):1780-1782.
[8]" HENRY T D,TOMEY M I,TAMIS-HOLLAND J E,et al.Invasive management of acute myocardial infarction complicated by cardiogenic shock:a scientific statement from the American heart association[J].Circulation,2021,143(15):e815-e829.
[9]" YANG J H,HUANG X W,HU F D,et al.LncRNA ANRIL knockdown relieves myocardial cell apoptosis in acute myocardial infarction by regulating IL-33/ST2[J].Cell Cycle,2019,18(23):3393-3403.
[10]" GIOVANNONI I,BARRESI S,ROSSI S,et al.Pediatric lipoblastoma with a novel EEF1A1-PLAG1 fusion[J].Genes,Chromosomes amp; Cancer,2021,60(7):525-526.
[11]" BOSUTTI A,DAPAS B,GRASSI G,et al.High eEF1A1 protein levels mark aggressive prostate cancers and the in vitro targeting of eEF1A1 reveals the eEF1A1-actin complex as a new potential target for therapy[J].International Journal of Molecular Sciences,2022,23(8):4143.
[12]" ZHANG Z Q,LIN W C,LI X Q,et al.Critical role of eukaryotic elongation factor 1 alpha 1 (EEF1A1) in avian reovirus sigma-C-induced apoptosis and inhibition of viral growth[J].Archives of Virology,2015,160(6):1449-1461.
[13]" CAO S Q,SMITH L L,PADILLA-LOPEZ S R,et al.Homozygous EEF1A2 mutation causes dilated cardiomyopathy,failure to thrive,global developmental delay,epilepsy and early death[J].Human Molecular Genetics,2017,26(18):3545-3552.
[14]" 张浩,左和平,刘泽岩,等.过表达ADAM10通过Notch/Akt信号通路抑制急性心肌梗死大鼠心肌细胞凋亡[J].安徽医科大学学报,2020,55(6):937-942.
[15]" 陶洁,熊永红,田浩,等.Notch1/Hes1信号通路在高糖心肌细胞缺氧复氧损伤中的作用[J].中华麻醉学杂志,2021,41(4):450-454.
[16]" 晋金兰,邓哲彤,吕荣贵,等.Notch和核因子-κB信号通路在心肌梗死大鼠心肌细胞中的表达变化[J].中华心血管病杂志,2017,45(6):507-512.
[17]" FAN A H,ZHAO X J,LIU H,et al.eEF1A1 promotes colorectal cancer progression and predicts poor prognosis of patients[J].Cancer Medicine,2023,12(1):513-524.
[18]" ZHENG J H,ZHANG S F,WANG T T.Expression of Notch-1 and nuclear factor-κB signal pathway in myocardial cells of coronary heart disease rats[J].Experimental and Therapeutic Medicine,2019,17(3):1587-1592.
(收稿日期:2023-03-21)
(本文编辑郭怀印)
