卵巢-附件肿块超声评分系统的研究进展
2024-11-20范林霞周慧丽




摘要:超声是诊断卵巢-附件肿块最常用的影像学方式,但由于长期以来缺乏统一的超声图像描述标准、肿块图像各异及对操作者经验的依赖,导致术前对肿块良恶性的鉴别、亚分类及恶性风险评估有一定难度。因此,研究者先后开发了多种超声评分系统,对肿块的超声检查、报告书写等进行规范化描述,提出风险预测模型及恶性风险分类,给出临床管理建议,以期提升超声诊断的规范化、同质化,提高术前诊断肿块的准确率,为临床医师正确解读超声报告及进一步诊疗提供有益指导。本文就卵巢-附件肿块的恶性肿瘤风险指数模型、国际卵巢肿瘤研究分析组织开发的几种模型、妇科影像报告与数据系统及卵巢-附件超声报告和数据系统等的超声研究进展作一综述。
关键词:卵巢-附件肿块;评分系统;超声诊断
Research progress of the ultrasound scoring system of ovarian-adnexal mass
FAN Linxia, ZHOU Huili
Department of Ultrasound Obstetrics and Gynecology, The First Affiliated Hospital of Xinjiang Medical University (The First Clinical Medical College of Xinjiang Medical University) /Xinjiang Key Laboratory of Ultrasound Medicine, Urumqi 830054, China
Abstract: Ultrasound is the most commonly used imaging modality for the diagnosis of ovarian-adnexal masses. However, due to the long-standing lack of uniform standards for describing ultrasound images, the variability of mass images, and the reliance on operator experience, these factors lead to difficulties in preoperative identification, subclassification, and malignancy risk assessment of the masses. Therefore, researchers have successively developed a variety of ultrasound scoring systems to standardize the description of ultrasound examinations and the writing of mass reports, propose risk prediction models and malignant risk classifications, and provide clinical management suggestions, in order to enhance the standardization and homogenization of ultrasound diagnosis, improve the accuracy of preoperative diagnosis of masses, and offer useful guidance to clinicians in correctly interpreting ultrasound reports and further diagnosis and treatment. This article provides a review of ultrasound research advances in the risk of malignancy index, several models developed by the International Ovarian Tumor Analysis, the gynecologic imaging reporting and data system, and the ovarian-adnexal reporting and data system.
Keywords: ovarian-adnexal mass; scoring system; ultrasound diagnosis
卵巢-附件肿块是来源于卵巢、输卵管或其周围结缔组织的肿块[1] 。其中卵巢癌是对全球女性健康构成重大威胁的疾病之一,是妇科恶性肿瘤中最致命的疾病之一[2],因早期临床表现缺乏特异性,70%以上被诊断时已进展至晚期[3]。据统计[4],I期卵巢癌患者五年生存率达90%以上,III期为27%,IV期则低至13%。在中国,其死亡率位于女性生殖系统恶性肿瘤之首,目前手术和化疗是治疗卵巢恶性肿瘤的主要方式,术前准确评估肿块性质有利于患者的分层治疗[5]。由此,早期检出卵巢癌可有效降低死亡率,指导临床制定治疗方案,改善患者预后,提高生活质量。超声是诊断卵巢-附件肿块良恶性的首选影像学方式,但肿块的超声图像存在“同病异图或异病同图”现象[6]、超声报告不规范及受检查医师经验限制,超声诊断存在一定局限性。因此,为规范卵巢-附件肿块影像学特征,提升超声诊断的规范化与同质化,学者提出多个超声评分系统,以期提高超声医师诊断准确率,加强超声医师与临床医师间沟通并为临床诊疗提供参考依据。然而,评分系统虽然多种多样但各有其不足,因此目前仍在持续更新细化内容,本文就其研究进展进行综述。
1 "恶性肿瘤风险指数模型(RMI)
RMI于1990年被首次提出[7],该模型是联合超声指标(U)、绝经状态(M)及血清癌抗原125(CA125)等综合预测卵巢肿瘤良恶性的数学模型,多位学者对RMI计算公式进行改良[8-10],提出RMI2、RMI3、RMI4模型,其中RMI2、RMI3改变了RMI1的评分标准,RMI4评分标准中加入肿块最大径(S)。
1.1 "RMI具体应用方法
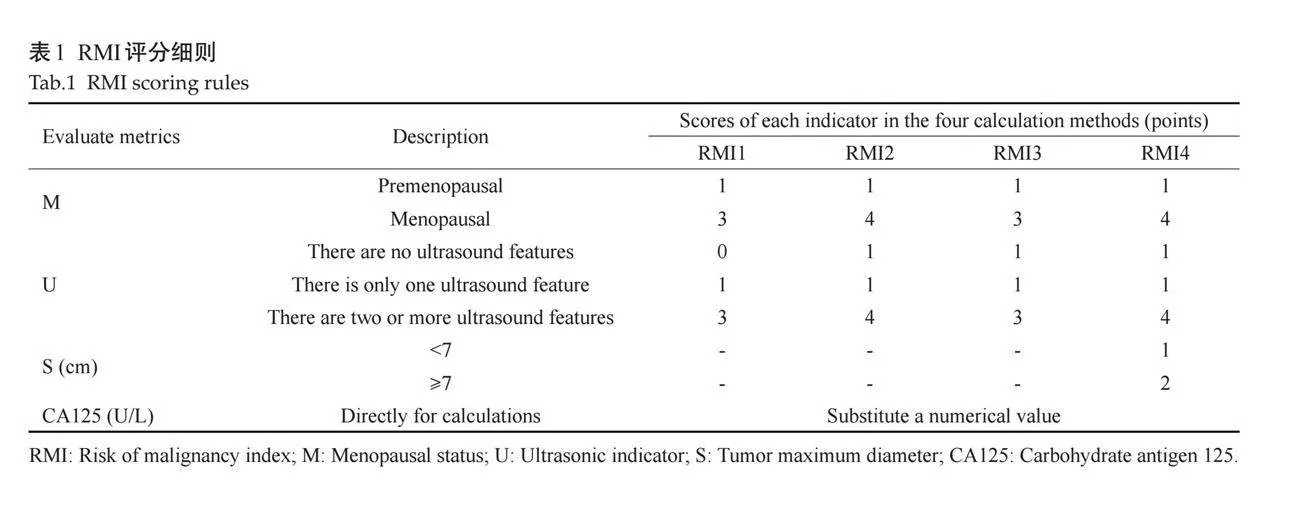
RMI的评分细则包含U、M、血清CA125和S这4个指标,并赋予各指标相应分值(表1)。其中U包括:双侧发病、多房囊性、盆腹腔有游离液体、有实性区域、有腹盆腔转移征象;M包括:绝经后状态(子宫切除后年龄≥50岁或距离末次月经≥1年的患者)和绝经前状态(其他患者);CA125指患者术前1周内测得的血清CA125数值;S分为lt;7 cm和≥7 cm。RMI计算方法:RMI1=U×M×CA125;RMI2=U×M×CA125;RMI3=U×M×CA125;RMI4=U×M×CA125×S。
1.2 "RMI良恶性判定
恶性肿瘤的阈值水平:RMI1、RMI2、RMI3模型的界值均为200,RMI4模型界值为450[10]。
1.3 "RMI临床应用
RMI广泛应用于卵巢-附件肿块良恶性的诊断,其效能优于单一肿瘤标记物的筛查。有研究提出改良RMI=(U+R)×M×CA125×S对肿块的诊断价值更高,其结合了肿瘤血流阻力指数(RI)[11]。也有学者认为,4种不同RMI模型诊断效能是否差异较大,以及哪种模型诊断效能最优尚未统一[12]。RMI对上皮性肿瘤高度敏感,但对早期的非上皮性肿瘤、交界性肿瘤和卵巢癌敏感性较低[13]。此外,RMI肿瘤标记物仅考虑CA125,但其缺乏特异性会影响RMI的评估结果[14]。同时,RMI模型缺乏对恶性肿瘤风险的评估[15]。因而,RMI模型需进一步完善。
2 "国际卵巢肿瘤研究分析组织(IOTA)
2002年,IOTA规范描述了卵巢-附件肿块的超声术语、定义、形式及方法,是文献中最可靠的基于证据的共识,为后续各种超声评分系统的建立奠定了基础[16]。IOTA指出,高年资超声医师依据个人经验诊断效能最高,即应用IOTA建立的模型进行诊断时,其诊断结果与依据个人经验诊断结果不一致时,基于个人经验的诊断价值更高;低年资的超声医师经过训练,对肿块的诊断效能提高[17, 18]。20年来,IOTA先后开发了众多诊断模型,主要包括:逻辑回归模型、IOTA三步法则、简单法则风险预测模型及ANDEX模型。
2.1 "逻辑回归模型
2005年,IOTA提出了逻辑回归模型[19],是IOTA对卵巢-附件肿块超声模型开发与探索的初步成果,包含LR1和LR2两种模型,两者均已配置于高端超声诊断仪,可用于临床超声诊断,LR1的建立过程包含了12个独立影响因素,LR2的建立过程包含了6个变量(变量筛选于LR1模型的影响因素)(表2)。其中,LR2较LR1应用广泛。
2.1.1 "LR2模型具体应用方法 " 从多个切面和角度存储图像,显示病灶所有的关键声像学特征,使用超声诊断仪内置的LR2模型分析图像内容,输入上述LR2的6个变量计算肿块恶性风险(以百分比显示)[19]。
2.1.2 "LR2模型良恶性判定 " LR2模型以10%作为截断值,≥10%肿块为恶性,lt;10%则为良性。
2.1.3 " LR2模型临床应用 " 有研究指出,用LR1和LR2模型诊断卵巢-附件肿块良恶性的敏感度分别为97.1%和94.9%,特异度分别为77.3%和76.7%,可以作为初步筛查卵巢癌的方法[20]。有学者认为[21],不同年资医师用LR2模型诊断肿块良恶性的一致性良好,Kappa值为0.669。LR2模型可以帮助低年资医生进行诊断[19]。然而,LR2受运算方程限制,在依据LR2分析肿块图像时,由于缺乏某些特征,难以从诊断模型中获得理想的诊断结果[22]。
2.2 "IOTA三步法则
2.2.1 "具体应用方法及良恶性判定 " 2012年,有学者提出了IOTA三步法则来诊断卵巢-附件肿块性质[23]。
第1步,即时简易诊断:基于6个简单的超声特征以及血清CA125评估肿块良恶性,诊断标准:仅存在良性特征为良性,仅存在恶性特征为恶性,其余肿块均进行第二步判断良恶性(表3)。
第2步,简单法则(SR):同时存在或不存在简易诊断中良性和恶性特征的肿块用SR进行评估[24],包含5个良性特征和5个恶性特征(表3),诊断标准为:有任何一个良性特征,没有恶性特征的为良性;有任何一个恶性特征,没有良性特征的为恶性;良恶性特征均有或均没有,则为不确定性。
第3步,依据妇科超声专家的主观诊断来判定良恶性:对SR中不确定性肿块由超声专家进行诊断。
2.2.2 "三步法则临床应用 " 单独用SR诊断卵巢-附件肿块的敏感度为92.19%、特异度为92.31%,其诊断肿块性质的结果与病理结果一致性良好(Kappa=0.833)[25]。然而,SR仅适用76%~89%的肿块(有明显良恶性特征),对不符合SR典型特征的病变不适用(如腹膜囊肿、输卵管积水、纤维瘤等),需妇科超声专家主观诊断肿块良恶性[12, 19, 20, 24]。有研究用三步法则的前两步诊断时,敏感度和特异度分别为95.1%和80.0%,用完整三步法则进行诊断时,敏感度和特异度分别为92.5%和97.7%[26]。同时,其诊断肿块结果与主观诊断的结果类似[23]。IOTA三步法则不仅适用于低年资医生,对于临床教学也有重要意义。大多数的晚期及转移性卵巢癌可以用这种方法诊断,但假阴性病例大多是交界性或早期侵袭性卵巢癌,未来应该侧重研究如何提高交界性和早期侵袭性卵巢癌的诊断能力,并且进一步研究三步法则是否优于前两步的诊断价值[27]。
2.3 "简单法则风险预测模型(SRR)
2016年,有学者在SR的基础上提出了SRR[28],解决了SR不适用于所有肿块的问题且对丰富血流信号的定义更加明确,SRR根据SR中的10个超声特征计算卵巢-附件肿块的恶性风险。
2.3.1 "SSR模型具体应用方法 " 良性超声特征(B特征):单房性囊肿;实性成分最大径lt;7 mm;肿物后方伴有声影;lt;10 cm的光滑多房性囊肿;无血流信号,CS=1;恶性超声特征(M特征):不规则实性肿物;腹腔积液;≥4个乳头状突起;≥10 cm的不规则多房囊实性肿物;丰富血流信号,CS=4。
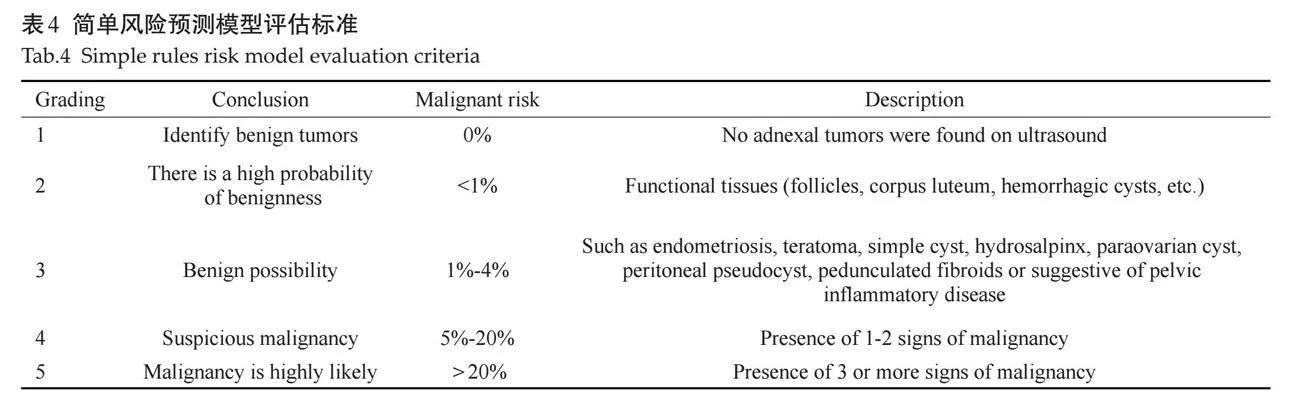
SSR模型风险计算可在线获取,将卵巢-附件肿块分为非常低风险、低风险、中等风险、高风险、非常高风险这5级,不同等级的诊断标准见(表4)。
2.3.2 "SSR模型良恶性判定 " SSR模型最佳截断值为gt;3级,SRR1-3级归为良性,SRR4-5级归为恶性[28]。
2.3.3 "SSR模型临床应用 "有研究发现,其诊断卵巢-附件肿块的敏感度和特异度分别为86.23%、82.85%;SSR区分肿块良恶性的AUC为0.941[6]。用三步法则诊断且第2步用SSR代替SR时,敏感度增加(98.4% vs 95.2%)[26]。另外,一项前瞻性研究表明该模型还可以用来估计每一个附件肿块的恶性的风险,对不同患者进行个性化的管理[29]。
2.4 "ADNEX模型
2014年,IOTA开发出ADNEX模型[30],分为有CA125和无CA125两种模式[30],两种模式都能有效地鉴别卵巢-附件肿块的良恶性[31],并且在术前对肿瘤进行亚分类,更有利于临床医生对不同卵巢-附件肿块制定个性化的诊疗方案。
2.4.1 "ADNEX模型具体应用方法 " ADNEX模型包含9项指标(表5),该模型可在网上和移动的应用程序中获得,输入指标后,ADNEX模型会为某个卵巢-附件肿块提供恶性肿瘤亚型的风险评估。
2.4.2 "ADNEX模型临床应用 " ADNEX模型诊断卵巢-附件肿块的敏感度为93.3%,特异性为77.8%,诊断价值高[32]。该模型不仅能诊断肿块良恶性,还是目前唯一可以在术前进行肿瘤亚分类的模型[30]。该模型将卵巢-附件肿块分为5种亚型:良性肿瘤,交界性肿瘤,Ⅰ期、Ⅱ~Ⅳ期及转移性卵巢癌。其对不同亚分类的肿块鉴别诊断能力不同[32]:在区分大多数肿块亚分类方面表现良好(AUC为0.61~0.99),特别是在区分II~IV期卵巢癌和良性肿块时AUC为0.99;然而,在区分I期卵巢癌和交界性肿瘤的AUC为0.61,II~IV期卵巢癌和转移性卵巢癌的AUC为0.78,在这些肿瘤鉴别方面效果不佳。但研究认为,纳入CA125可以提高模型的诊断效能[33]。该模型在术前进行肿瘤亚分类有重要的临床意义,可使部分育龄期患者能够进行保存生育功能的手术,也能帮助其他患者选择最合适的手术方法,或者在转移的情况下追溯其原发病灶[31]。
纳入CA125的ADNEX模型能够提高II~IV期卵巢癌与转移性卵巢癌的鉴别效能,但不能提高I期卵巢癌与II~IV期卵巢癌、I期卵巢癌与转移性卵巢癌的鉴别效能。研究指出,超声医师的经验判断在临床工作中仍然发挥着重要作用,特别是对输卵管感染性疾病的诊断(其部分特征与恶性卵巢-附件肿块的乳头结构或多房的特征相似)[34]。此模型还需要特定的软件以及人工输入相应的指标,目前多用于可疑交界或恶性病变的分类,以协助制定最佳治疗方案[12]。因此该模型仍需进一步完善。ADNEX模型若能结合绝经状态、其他肿瘤指标、血流参数等临床指标及检查方法,将医师经验应用于该模型的未来更新中,进一步详细规范肿块的良恶性特征参数,有望提高各亚分类的鉴别效能及卵巢恶性肿瘤与非特异性感染疾病的诊断效能[14, 35]。
3 "妇科影像报告与数据系统(GI-RADS)
有学者于2009年建立了GI-RADS,该系统分类方法简单易行,对肿块良恶性诊断价值较高[36]。不仅规范了超声报告,同时减少了超声医师和临床医生之间沟通的误差,有助于临床医师选择合适的诊疗方案。
3.1 "GI-RADS模型具体应用方法
对肿块进行分类,评估其恶性风险(表6)。其中恶性征象:乳头状突起≥7 mm;分隔/壁厚≥3 mm;存在中心性血流(血流分布于分隔、乳头状突起、实性区域或实性肿瘤的中心区域);血流阻力指数(RI)lt;0.50;实性成分≥50%;腹腔积液。
3.2 "GI-RADS模型临床应用
GI-RADS不仅能根据超声特征诊断疾病,还可以评估肿块恶性风险概率[37]。有研究指出,GI-RADS对肿块良恶性诊断的敏感度为92.7%,特异度为93.6%[38]。不同年资医师用GI-RADS诊断肿块的一致性较好(Kappa=0.896)[39]。GI-RADS为超声科医生提供了一个科学的分类方法,对肿块诊断价值较高。但是,GI-RADS系统中的恶性特征作为分类的重要依据,而并非恶性肿块的特征性表现,一些出血性囊肿可探及周边环状或半环状血流信号且阻力指数较低;畸胎瘤、异位妊娠超声图像复杂,暂不采用GI-RADS分类系统进行评估;一些特殊情况需要结合临床检验指标综合判断[37]。此外,GI-RADS分类过于依赖超声医师的经验,因不同医生对血流信号的描述存在差异,导致误诊占比较大[12, 37]。此外,恶性肿块在绝经后妇女(62.2%)中高于绝经前妇女(37.8%)[39],因此绝经状态可能是影响该模型诊断卵巢-附件肿块的重要因素之一,也可加入研究中。
4 "卵巢-附件超声报告和数据系统(O-RADS)
2020年美国放射学会提出O-RADS[40],该系统规范了病变描述,提出了典型良性病变;减少了不同超声医师间对病变描述及报告的差异,标准化的术语也便于与临床医师沟通,并且为不同风险等级的患者提供了相应的管理方式。2022年11月,美国放射学会更新了O-RADS,进一步澄清了管理概念和词汇术语,细化了风险分层类别,加强了管理建议。
4.1 "2022版O-RADS分类具体应用方法
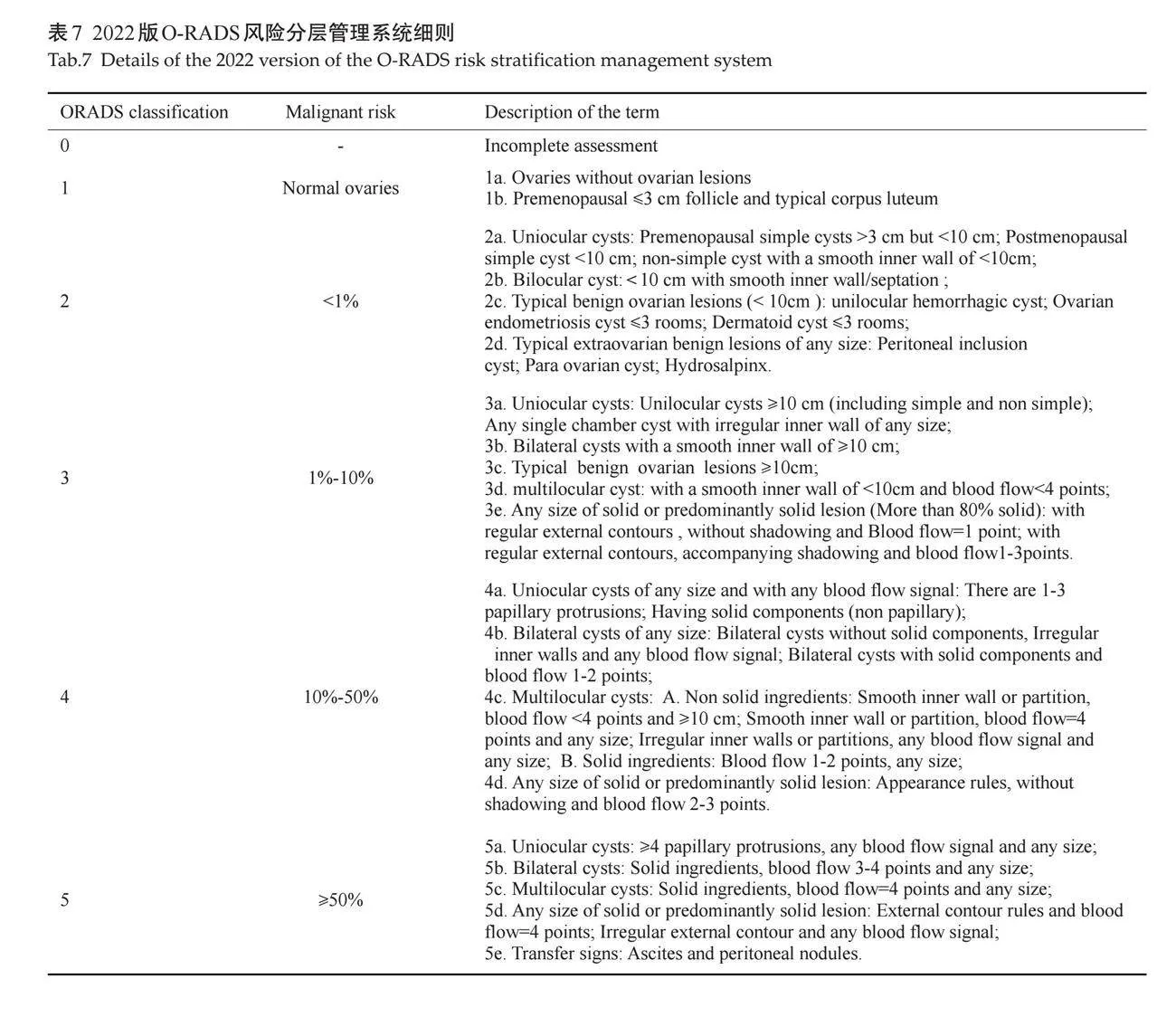
O-RADS评估细则[41](表7)。
4.2 "2022版O-RADS分类主要更新点
4.2.1 "临床应用方面 " 适用于卵巢、疑似涉及卵巢、输卵管的病变以及卵巢旁囊肿;不适用于盆腔炎性疾病、异位妊娠、正常卵巢扭转的部分急诊患者,以及明确为非卵巢/非输卵管起源的病变等;双侧和多发性病变多数情况下以O-RADS评分最高的病变指导管理;为绝经状态不确定或子宫切除的患者提供了指导;其他。
4.2.2 "内容方面 " O-RADS 0类:因技术因素不能确定病灶特征的附件肿块;O-RADS 1类:正常卵巢、卵泡及强调形态学及多普勒特征的黄体;O-RADS 2~5类中增加了“双房”,降低了双房囊肿的恶性风险;规范了典型卵巢良性病变:其中包含单房的典型出血性囊肿;≤3房的典型的皮样囊肿和卵巢子宫内膜异位囊肿;O-RADS 3~5类的实性病变中增加了声影,提高实性病变的特异性。
4.3 O-RADS分类临床应用
O-RADS分类覆盖面更广泛,可重复性更强,有利于超声医师之间、超声医师与临床医师之间沟通。研究指出,O-RADS分类对卵巢-附件肿块良恶性鉴别的敏感性和特异性分别为90.60%、81.90%[42]。O-RADS分类还可以对不同病理类型的卵巢-附件肿块进行鉴别诊断,其鉴别性索-间质肿瘤、上皮-间叶肿瘤、生殖细胞肿瘤的AUC分别为0.926、0.963及0.923[43]。研究表明[44],不同年资超声医师用O-RADS分类诊断卵巢-附件肿块的一致性较好(Kappa值为0.795),O-RADS诊断恶性肿块的敏感性高于医师的主观判断[45]。
O-RADS分类有较好的诊断效能,但其诊断依赖于医师的主观判断。研究指出,在外部轮廓、内部回声及血流信号3个方面,不同年资超声医师的判读可能存在差异,导致同一肿块的分类不同[44]。目前国内外针对2022版O-RADS超声分层和管理系统的研究较少,后续需要进行更多(回顾性、前瞻性、大样本、多中心性等)试验,以研究超声专家和非超声专家间的使用是否有差异性以及不同年资医师诊断一致性是否有所提高。
5 "前景与展望
上述评分系统中,ADNEX模型包含超声和临床指标,IOTA SR和O-RADS系统相对简单,准确度高,已广泛应用于临床工作中[12]。其中,O-RADS分类是目前唯一包含所有风险类别和管理方案的系统[40],研究指出[12]该模型具有最高的敏感度及较高的一致性,能够减少或消除既往超声报告的模糊性,对临床诊疗有重要意义。但临床工作中使用该分类还需超声医师与临床医师共同学习,其中存在部分有歧义的细节有待完善:囊壁和分隔的鉴别、实性成分与血凝块及畸胎瘤部分成分的鉴别、血流信号评分的判定、不同组织来源的紧邻肿块的判断、炎性病灶(非特异性炎症)的鉴别诊断等。目前O-RADS分类旨在提高卵巢-附件肿块的诊断灵敏度,避免卵巢恶性肿瘤的漏诊[12]。近年来有文献报道[46],O-RADS联合超声造影对肿块的诊断效能比单独使用O-RADS或超声造影更高。此外,国外的O-RADS分类系统及管理建议与中国医疗现状间存在一些不匹配之处,国外分类系统复杂给临床工作带来诸多不便,因此学者们可以借鉴甲状腺结节或乳腺结节的分类系统在平衡分类准确性和临床易用性的前提下,结合中国国情和医疗现状,建立规范完整的适合中国的卵巢-附件肿块超声评分系统。
此外,超声医师用上述评分系统进行诊断时有一定的主观性。随着人工智能在医学中的发展,可将其广泛应用于卵巢-附件肿块的诊治中。研究指出,人工智能联合医学影像在诊断卵巢癌方面已经表现出良好的性能[47]。未来可以应用卵巢-附件肿块的超声图像及肿瘤指标,基于深度学习算法构建诊断卵巢-附件肿块良恶性的模型,并开发特定的诊断模型应用软件置入超声仪器内,达到即时诊断的效果,将人工智能与超声评分系统及超声医师广泛高效地结合,帮助医师发现更细节的超声特征、建立更规范精准的辅助标准、降低对医师经验的依赖性,达到超声精准诊断卵巢-附件肿块的效果,从而更好的服务于临床诊疗[48]。
参考文献:
[1] " 张国楠, 刘 "红. 附件包块的诊治策略[J]. 中国实用妇科与产科杂志, 2020, 36(12): 1129-31.
[2] "Lhotova K, Stolarova L, Zemankova P, et al. Multigene panel germline testing of 1333 Czech patients with ovarian cancer[J]. Cancers, 2020, 12(4): 956.
[3] " Torre LA, Trabert B, DeSantis CE, et al. Ovarian cancer statistics, 2018[J]. CA a Cancer J Clin, 2018, 68(4): 284-96.
[4] "Menon U, Gentry-Maharaj A, Burnell M, et al. Ovarian cancer population screening and mortality after long-term follow-up in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial[J]. Lancet, 2021, 397(10290): 2182-93.
[5] " 卢雯平, 白 "萍, 田小飞, 等. 卵巢癌中西医结合诊疗指南[J]. 中国医药, 2024, 19(5): 641-8.
[6] " 曾 "艳, 祝凤翠, 宋化雨, 等. 妇科影像报告-数据系统、简单法则风险预测对卵巢癌的诊断价值[J]. 中国优生与遗传杂志, 2022, 30(6): 1024-7.
[7] "Jacobs I, Oram D, Fairbanks J, et al. A risk of malignancy index incorporating CA 125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer[J]. Br J Obstet Gynaecol, 1990, 97(10): 922-9.
[8] "Tingulstad S, Hagen B, Skjeldestad FE, et al. Evaluation of a risk of malignancy index based on serum CA125, ultrasound findings and menopausal status in the pre-operative diagnosis of pelvic masses[J]. Br J Obstet Gynaecol, 1996, 103(8): 826-31.
[9] Tingulstad S, Hagen B, Skjeldestad FE, et al. The risk-of-malignancy index to evaluate potential ovarian cancers in local hospitals[J]. Obstet Gynecol, 1999, 93(3): 448-52.
[10]Yamamoto Y, Yamada R, Oguri H, et al. Comparison of four malignancy risk indices in the preoperative evaluation of patients with pelvic masses[J]. Eur J Obstet Gynecol Reprod Biol, 2009, 144(2): 163-7.
[11] "李小利, 潘 "志, 刘传金, 等. 改良恶性风险指数联合哥本哈根指数鉴别诊断卵巢肿瘤良恶性的价值[J]. 临床超声医学杂志, 2022, 24(6): 469-72.
[12] "秦绪颖, 王瑞国, 王 "稳, 等. 卵巢肿瘤良恶性风险评估方法学中国专家共识(2024年版)[J]. 中国实用妇科与产科杂志, 2024, 40(3): 312-20.
[13] "马士红, 李晓琴, 施燕芸. 四种恶性风险指数对卵巢肿瘤良恶性鉴别的诊断价值[J]. 中华医学超声杂志: 电子版, 2020, 17(11): 1108-13.
[14] 和 "平, 吴青青, 孙丽娟, 等. 对比观察ADNEX模型、简单规则风险估计模型及恶性风险指数诊断卵巢良恶性肿瘤[J]. 中国医学影像技术, 2019, 35(1): 104-7.
[15] Timmerman D, Planchamp F, Bourne T, et al. ESGO/ISUOG/IOTA/ESGE Consensus Statement on pre‑operative diagnosis of ovarian tumors[J]. Int J Gynecol Cancer, 2021, 31(7): 961-82.
[16] Timmerman D, Valentin L, Bourne TH, et al. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group[J]. Ultrasound Obstet Gynecol, 2000, 16(5): 500-5.
[17] Valentin L, Hagen B, Tingulstad S, et al. Comparison of 'pattern recognition'and logistic regression models for discrimination between benign and malignant pelvic masses: a prospective cross validation[J]. Ultrasound Obstet Gynecol, 2001, 18(4): 357-65.
[18]Zhang XY, Meng X, Dou T, et al. Diagnostic accuracy of transvaginal ultrasound examination for assigning a specific diagnosis to adnexal masses: a meta‑analysis[J]. Exp Ther Med, 2020, 20(6): 265.
[19] Timmerman D, Testa AC, Bourne T, et al. Logistic regression model to distinguish between the benign and malignant adnexal mass before surgery: a multicenter study by the International Ovarian Tumor Analysis Group[J]. J Clin Oncol, 2005, 23(34): 8794-801.
[20] "Nunes N, Ambler G, Foo X, et al. Prospective evaluation of IOTA logistic regression models LR1 and LR2 in comparison with subjective pattern recognition for diagnosis of ovarian cancer in an outpatient setting[J]. Ultrasound Obstet Gynecol, 2018, 51(6): 829-35.
[21] "张会萍, 周毓青. 卵巢肿瘤超声评价方法的进展和临床应用[J]. 肿瘤影像学,2024, 33(02) :194-199.
[22] "王 "硕, 王玲玲, 郑秀兰. IOTA超声诊断模型在卵巢肿瘤诊断方面的应用进展[J]. 现代肿瘤医学, 2022, 30(8): 1491-5.
[23] Ameye L, Timmerman D, Valentin L, et al. Clinically oriented three‑step strategy for assessment of adnexal pathology[J]. Ultrasound Obstet Gynecol, 2012, 40(5): 582-91.
[24] "Timmerman D, Testa AC, Bourne T, et al. Simple ultrasound-based rules for the diagnosis of ovarian cancer[J]. Ultrasound Obstet Gynecol, 2008, 31(6): 681-90.
[25] "田 "彩, 李海燕, 刘 "洁, 等. IOTA超声简易标准诊断附件肿瘤良恶性的价值[J]. 河北医药, 2023, 45(22): 3432-6.
[26] "Hidalgo JJ, Ros F, Aubá M, et al. Prospective external validation of IOTA three-step strategy for characterizing and classifying adnexal masses and retrospective assessment of alternative two‑step strategy using simple‑rules risk[J]. Ultrasound Obstet Gynecol, 2019, 53(5): 693-700.
[27] "Alcázar JL, Pascual MA, Graupera B, et al. External validation of IOTA simple descriptors and simple rules for classifying adnexal masses[J]. Ultrasound Obstet Gynecol, 2016, 48(3): 397-402.
[28] "Timmerman D, van Calster B, Testa A, et al. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis Group[J]. Am J Obstet Gynecol, 2016, 214(4): 424-37.
[29] Solanki V, Singh P, Sharma C, et al. Predicting malignancy in adnexal masses by the international ovarian tumor analysis-simple rules[J]. J Midlife Health, 2020, 11(4): 217-23.
[30] "van Calster B, van Hoorde K, Valentin L, et al. Evaluating the risk of ovarian cancer before surgery using the ADNEX model to differentiate between benign, borderline, early and advanced stage invasive, and secondary metastatic tumours: prospective multicentre diagnostic study[J]. BMJ, 2014, 349: g5920.
[31] "Sayasneh A, Ferrara L, de Cock B, et al. Evaluating the risk of ovarian cancer before surgery using the ADNEX model: a multicentre external validation study[J]. Br J Cancer, 2016, 115(5): 542-8.
[32] Chen H, Qian L, Jiang M, et al. Performance of IOTA ADNEX model in evaluating adnexal masses in a gynecological oncology center in China[J]. Ultrasound Obstet Gynecol, 2019, 54(6): 815-22.
[33] "倪仲馨, 陈 "慧. ADNEX模型鉴别转移性与原发性卵巢癌的诊断效能研究[J]. 诊断学理论与实践, 2023, 22(6): 573-8.
[34] "刘真真, 石志敏, 徐钟慧, 等. IOTA ADNEX模型与简单法则对附件区疑难病变的诊断价值[J]. 中华医学超声杂志(电子版), 2020, 17(11) :1084-9.
[35] "Szubert S, Wojtowicz A, Moszynski R, et al. External validation of the IOTA ADNEX model performed by two independent gynecologic centers[J]. Gynecol Oncol, 2016, 142(3): 490-5.
[36] Amor F, Vaccaro H, Alcázar JL, et al. Gynecologic imaging reporting and data system: a new proposal for classifying adnexal masses on the basis of sonographic findings[J]. J Ultrasound Med, 2009, 28(3): 285-91.
[37] "Amor F, Alcázar JL, Vaccaro H, et al. GI-RADS reporting system for ultrasound evaluation of adnexal masses in clinical practice: a prospective multicenter study[J]. Ultrasound Obstet Gynecol, 2011, 38(4): 450-5.
[38] Basha MAA, Metwally MI, Gamil SA, et al. Comparison of O-RADS, GI-RADS, and IOTA simple rules regarding malignancy rate, validity, and reliability for diagnosis of adnexal masses[J]. "Eur Radiol, 2021, 31(2): 674-84.
[39] Basha MAA, Refaat R, Ibrahim SA, et al. Gynecology Imaging Reporting and Data System (GI‑RADS): diagnostic performance and inter-reviewer agreement[J]. Eur Radiol, 2019, 29(11): 5981-90.
[40] "Andreotti RF, Timmerman D, Strachowski LM, et al. O-RADS US risk stratification and management system: a consensus guideline from the ACR ovarian‑adnexal reporting and data system committee[J]. Radiology, 2020, 294(1): 168-85.
[41] "Strachowski LM, Jha P, Phillips CH, et al. O-RADS US v2022: an update from the American college of radiology's ovarian‑adnexal reporting and data system US committee[J]. Radiology, 2023, 308(3): e230685.
[42] "Jha P, Gupta A, Baran TM, et al. Diagnostic performance of the ovarian-adnexal reporting and data system (O-RADS) ultrasound risk score in women in the United States[J]. JAMA Netw Open, 2022, 5(6): e2216370.
[43] "卢颖澜, 吴青青, 和 "平, 等. 卵巢-附件报告和数据系统(O-RADS)定性诊断卵巢肿瘤效能[J]. 中国医学影像技术, 2022, 38(9): 1367-70.
[44] "谢映鲜, 王钰丹, 沈若霞, 等. 不同观察者基于卵巢-附件影像报告和数据系统诊断卵巢附件肿块的一致性研究[J]. 医学影像学杂志, 2024, 34(2): 91-4.
[45] "Zhou S, Guo YY, Wen LM, et al. Comparison of the diagnostic efficiency between the O-RADS US risk stratification system and doctors' subjective judgment[J]. BMC Med Imaging, 2023, 23(1): 190.
[46] "杨 "琳, 张 "勇, 穆晓晶, 等. 卵巢-附件影像报告和数据系统联合超声造影鉴别卵巢良恶性肿瘤的临床价值[J]. 肿瘤影像学, 2023, 32(3): 291-7.
[47] "Xu HL, Gong TT, Liu FH, et al. Artificial intelligence performance in image‑based ovarian cancer identification: a systematic review and meta-analysis[J]. EClinicalMedicine, 2022, 53: 101662.
[48]Park SH, Han K. Methodologic guide for evaluating clinical performance and effect of artificial intelligence technology for medical diagnosis and prediction[J]. Radiology, 2018, 286(3): "800-9.
(编辑:林 "萍)
