四维自动右心室定量分析技术在评价肺切除术后右心功能的应用
2024-11-20刘红娇李卫虹杨冬妹

摘要:目的 "利用四维自动右心室定量分析技术(4D Auto RV)评价肺切除术后患者的早期右心室容积和功能变化情况。方法 选取2021年1月~2022年12月在中国科学技术大学附属第一医院行胸腔镜下肺结节肺切除术的患者51例,其中单纯肺段或肺楔形切除25例,肺叶切除26例。在进行肺切除的术前和术后1月内行超声心动图检查,利用4D Auto RV技术评估肺切除术后右心室容积和功能的变化,右心室容积参数包括右室舒张末期容积(EDV)、右室收缩末期容积(ESV)、每搏输出量等。右心室功能参数包括右心室射血分数(RVEF)、三尖瓣环纵向位移(TAPSE)、面积变化分数(FAC)及右心室整体纵向应变(RV-GPLS)、游离壁侧纵向应变(RV-FWPLS)。结果 胸腔镜下肺切除术后早期右心室容积增加,具体表现为手术前后的EDV、ESV发生变化(Plt;0.05),每搏输出量在手术前后的变化无统计学意义(Pgt;0.05)。右心室功能参数FAC、RV-GPLS、RV-FWPLS在手术前后的差异有统计学意义(Plt;0.05),其对手术引起的右心室功能改变较敏感,而RVEF和TAPSE在手术前后的变化差异无统计学意义(Pgt;0.05)。单纯肺段/楔形切除术与肺叶切除术两种手术切除范围对患者术后右心容积和功能参数变化差异无统计学意义(Pgt;0.05)。结论 肺切除术后早期阶段,尽管患者可能未表现出明显的临床症状,但通过4D Auto RV技术发现术后右心室扩张,早期出现右心室轻度功能障碍,表现为FAC、RV-GPLS和RV-FWPLS减低。
关键词:超声心动图新技术;肺切除术;右心室功能;斑点追踪
The application of application four‑dimensional automatic right ventricular quantitative analysis in the evaluation of right heart function after pulmonary resection
LIU Hongjiao, LI Weihong, YANG Dongmei
Department of Echocardiography, The First Affiliated Hospital of the University of Science and Technology of China, Hefei 230002, China
Abstract: Objective To employ the advanced four‑dimensional automated right ventricular quantification (4D Auto RV) technique as a tool for evaluating the early postoperative alterations in RV volume and function among patients who have undergone lung resection surgery. Methods A total of 51 patients who underwent thoracoscopic lung resection for pulmonary nodules in the First Affiliated Hospital of University of Science and Technology of China from January 2021 to December 2022 were selected, including 25 patients with simple segmental or wedge resection and 26 patients with lobectomy. Echocardiography was performed before and within 1 month after lung resection,and the change a in right ventricular volume and function after lung resection were assessed using the 4D Auto RV technique. Right ventricular volume parameters included end-diastolic volume (EDV), end-systolic volume (ESV), and stroke volume (SV). Right ventricular function parameters included right ventricular ejection fraction (RVEF), tricuspid annular plane systolic excursion (TAPSE), fractional area change (FAC), and right ventricular longitudinal strain values [global longitudinal strain (RV‑GPLS), free wall longitudinal strain (RV‑FWPLS)]. Results Following early stages post-thoracoscopic lung resection, there was a significant increase in right ventricular volume, manifesting as statistically significant changes in both EDV and ESV before and after surgery (Plt;0.05). However, the change in stroke volume pre- and post-surgery did not reach statistical significance (Pgt;0.05). Upon further analysis of right ventricular functional parameters, there were significant statistical changes in FAC, RV-GPLS, and RV-FWPLS before and after surgery (Plt;0.05), indicating that these parameters were more sensitive to the alterations in right ventricular function induced by the surgery. The changes in RVEF and TAPSE did not achieve statistical significance pre- and post-surgery (Pgt;0.05). The differences in post‑operative right ventricular volume and functional parameter changes between patients undergoing either limited resection such as segmentectomy/wedge resection versus lobectomy were not statistically significant (Pgt;0.05). Conclusion In the phase following lung resection, despite the possible absence of overt clinical symptoms, the utilization of 4D Auto RV technology has revealed a phenomenon of right ventricular dilation, indicative of early onset of mild right ventricular dysfunction. This dysfunction manifests as decrements in FAC, RV-GPLS and RV-FWPLS.
Keywords: new technology of echocardiography; lung resection; right ventricular function; speckle tracking
肺循环和右心功能紧密关联,肺切除术后右心功能的变化对患者预后具有重要影响。右心室功能障碍的发生可能会显著增加患者术后住院并发症的风险,同时还可能增加患者的死亡率,从而对患者的整体康复和生存质量构成严重威胁[1-3],因此准确评估肺切除术后患者的右心功能具有重要的临床意义。目前常用的二维超声心动图评估参数少,缺乏可靠的、能够实时且全面的参数来监测右心功能的动态变化[4-6]。本研究采用最新的四维自动右心室定量分析技术(4D Auto RV),该技术可对右心室实时三维立体成像,动态监测右心室功能变化,克服传统二维超声心动图在右心功能评估中的局限性[7, 8]。有研究采用该技术评估肺动脉高压、心肌病等患者的右心功能,表现出明显优势[9, 11];但目前尚未有采用该技术评估肺切除术后右心功能的研究资料。本研究旨在利用4D Auto RV技术评估胸腔镜下肺切除患者的右心功能变化,以期为胸外科术后管理提供科学依据,减少并发症,改善患者预后,并推动胸外科微创技术和术后康复管理方面的进步。
1 "资料与方法
1.1 "一般资料
选取2021年1月~2022年12月在中国科学技术大学附属第一医院行电视辅助胸腔镜手术(VATS)下肺结节肺切除术患者共51例,其中男23例,女28例,年龄28~74(56.8±11.5)岁。本研究通过医院伦理委员会审批(审批号:2023-RE-427)。纳入标准:临床诊断肺结节拟行VATS的患者。排除标准:排除心肌病、瓣膜病、先天性心脏病,图像显示质量不佳者。
1.2 "前期研究准备
选择36例患者分别在两种不同型号的检查仪器上完成图像采集,进行后处理,检验一致性。仪器型号和后处理软件分别为:飞利浦Eipc 7c超声诊断仪和4D Auto RV技术、GE 95超声诊断仪和心脏超声影像定量系统(QAS)。
1.3 "仪器及操作流程
飞利浦Eipc 7c超声检查仪器,X5‑1探头(1~5 MHz)。术前和术后1月行超声心动图检查,按照标准化方案进行图像采集[11]。其中右心的三维图像选择右室聚焦的心尖四腔心切面,启动3D,打开HMQ模式,获取full volume图像。图像采集完成后进行后处理成像,4D Auto RV技术是使用斑点追踪技术跟踪整个心脏周期。根据动态表面模型进行三维容积的数值计算,得出右心容积和功能的相关参数,包括右室舒张末期容积(EDV)、EDVi、右室收缩末期容积(ESV)、ESVi、每搏输出量(SV)和右心室射血分数(RVEF)。此外,表面模型与右室聚焦的四腔心切面相交,从相同的几何形状中获得标准的二维测量值,包括右心室整体纵向应变(RV-GPLS)、右心室游离壁侧纵向应变(RV-FWPLS)、三尖瓣环纵向位移(TAPSE)、右心室面积变化分数(FAC)。
1.4 "手术方法
拟行VATS肺切除术,按照手术实际的切除范围分为肺叶切除、肺段切除和/或肺楔形切除。
1.5 "统计学分析
运用MedCalc软件绘制Bland-Altman图,计算测量结果差值的95%一致性界限(LoA)和95% CI,评价两种方法的一致性。采用SPSS25.0软件进行统计学分析,计量资料以均数±标准差表示,采用配对t检验比较手术前后的数据,采用独立样本t检验比较两种手术方式的差异。以Plt;0.05为差异有统计学意义。
2 "结果
2.1 "手术结果
无患者死亡,术后均未出现严重并发症。术中单纯肺段或肺楔形切除25例,肺叶切除26例(包括同侧肺叶、肺段切除3例,双侧肺叶肺段切除1例)。切除肺病变组织的病理结果:其中肺癌45例,良性病变6例。术后2例患者辅助化疗,1例出现少许心包积液,1例出现心动过速,合并房性早搏,4例患者出现一过性肺动脉高压。
2.2 "前期研究一致性检验结果
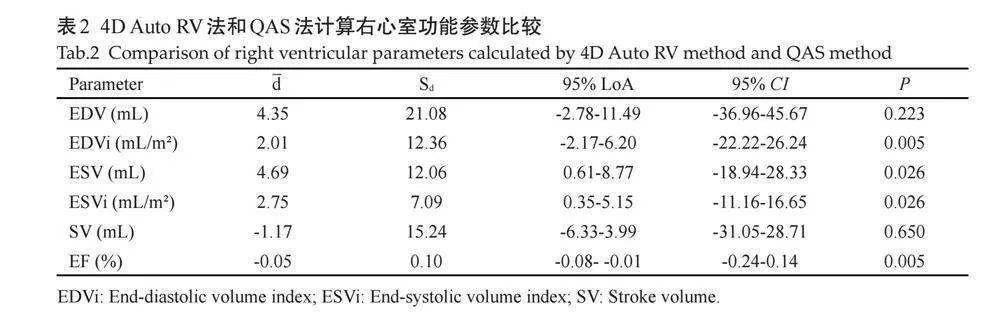
2.2.1 "使用两种不同型号仪器检测右心功能参数 " 36例患者分别采用4D Auto RV法和QAS法测量右心室容积参数结果(表1)。
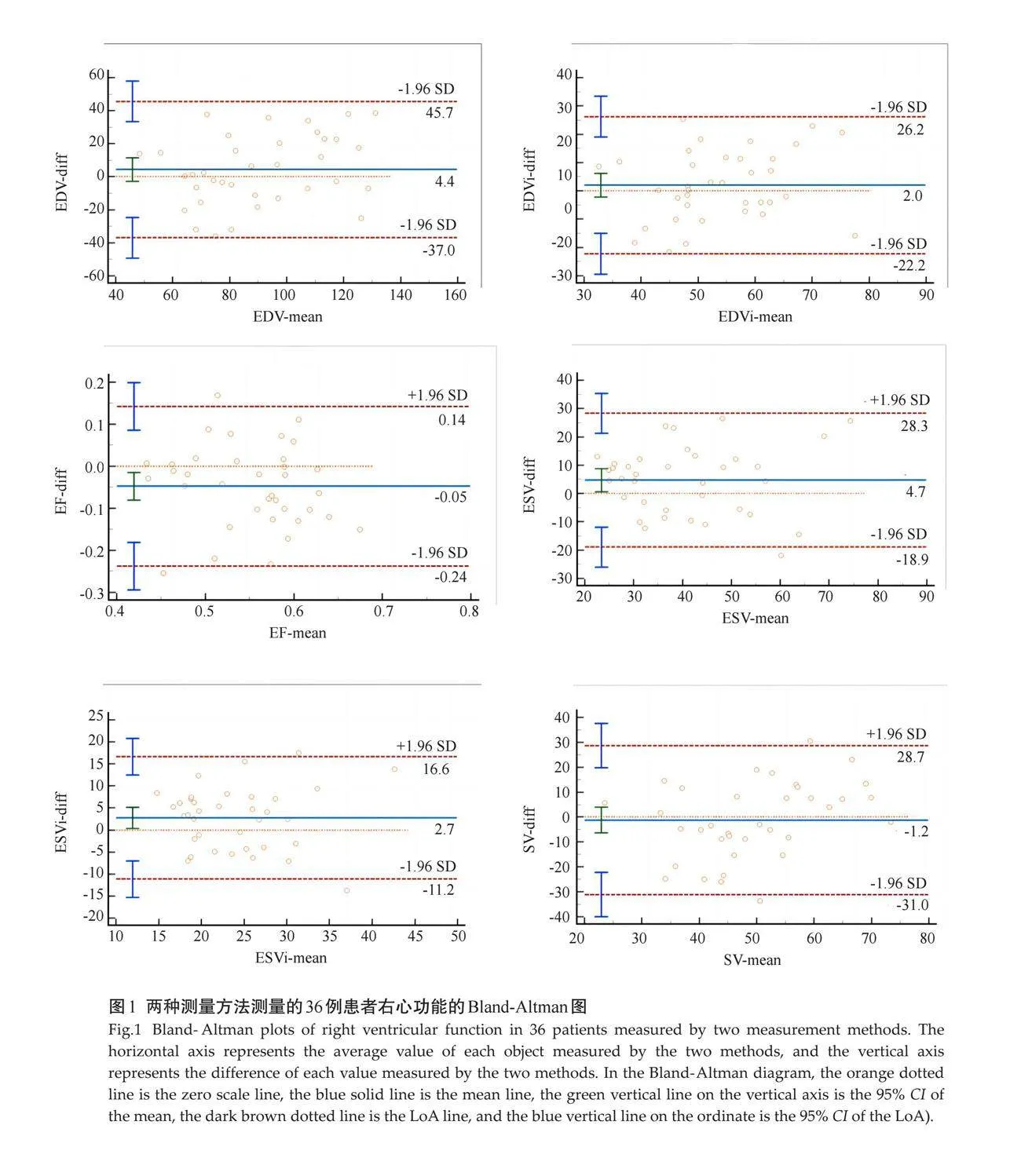
2.2.2 "两种方法计算的右心功能参数比较 " Bland-Altman图显示EDV、EDVi没有点超出LoA 95% CI;ESV有1例在LoA之外(2.8%),ESVi、SV和EF各有2例在LoA之外(5.6%),但所有的测值均没有落在LoA的95% CI之外。LoA的95% CI均位于专业上允许的最大差异线之内,两种方法测定结果一致性较好。点的分布均匀离散,回归线与零刻度平行,未发现明显的规律性,数据满足Bland-Altman分析的条件。综合分析数据结果,两种方法测量值的差异无统计学意义(表2、图1)。
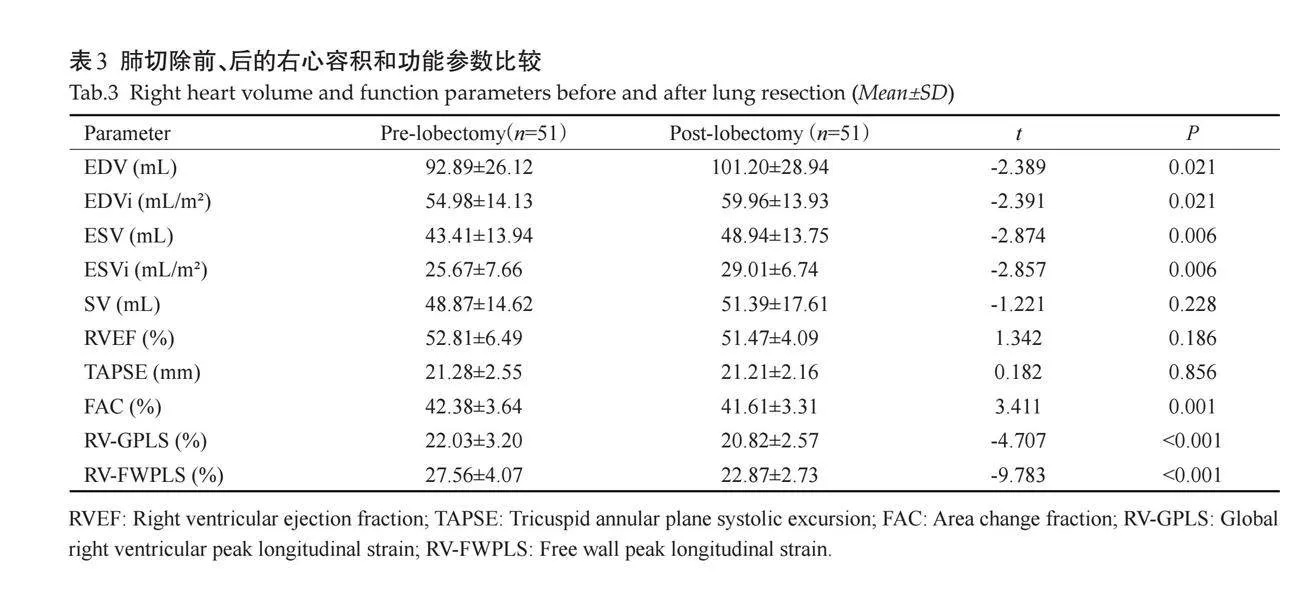
2.3 "肺切除手术前、后右心容积和功能参数比较
手术前后EDV、EDVi、ESV、ESVi的差异有统计学意义(Plt;0.05),SV的差异无统计学意义(Pgt;0.05)。手术前后FAC、RV-GPLS、RV-FWPLS的差异有统计学意义(Plt;0.05),RVEF和TAPSE的差异无统计学意义 " " " " (Pgt;0.05,表3)。
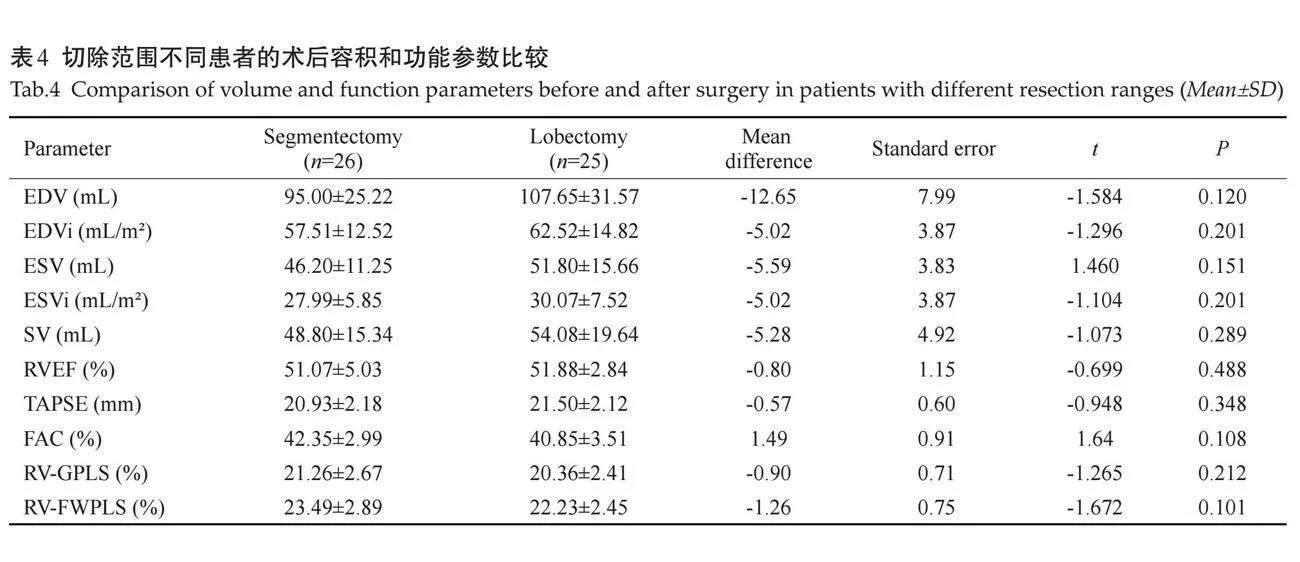
2.4 "切除范围不同患者术后容积和功能参数比较
根据肺组织实际切除范围的不同分为单纯肺段或肺楔形切除术组(统称为肺段切除组)和肺叶切除术组,两组手术后容积和功能参数差异无统计学意义(Pgt;0.05,表4)。
3 "讨论
右心室功能作为心胸外科手术预后的关键因素,其表现对术后早期恢复及长期生存质量均有显著影响。此外,肺部手术后的患者也面临右心室功能障碍的风险。多项研究资料显示,肺切除术后右心室射血分数RVEF显著降低15%~25%,右心功能的变化加剧了术后并发症的潜在风险,临床医生需要关注与重视并发症的识别与预防[12, 13]。
本研究采用超声心动图领域最新技术进行深入分析,在研究初期阶段,通过对比试验,系统分析了两种不同仪器及其配套的分析软件在量化右心容积和功能指标方面的表现,结果显示两种仪器与分析软件在评估右心功能时展现出高度的一致性,均可认为有效且可靠的评价右心功能。其中QAS系统计算结果依赖于关键点位的信息,检查人员要在固定体位下获得全部图像,并逐个确认关键点位信息,操作相对繁琐,故未采用该方法。
与既往研究一致,本研究显示肺切除术后右心室扩张,表现为EDV和ESV增加,而SV保持相对稳定[2, 14]。这提示在右心室后负荷的急剧上升的背景下,右心室心肌通过Frank-Starling机制(即心室舒张末期容积增加导致心肌初长度增加,从而增强心肌收缩力)有效维持了每搏输出量的稳定,避免心输出量下降[4]。
本研究显示术后FAC、RV-GPLS及RV-FWPLS降低,RVEF和TAPSE相对稳定,反映右心室收缩功能可能存在轻度的功能障碍。有研究显示术后RVEF稳定,但TAPSE变化显著,从术前24 mm下降至术后18 mm[2]。而本研究术后TAPSE无明显变化,分析原因,可能由于切除范围以及手术方式差异所致,该研究资料为开胸手术下大肺切除,本研究采用VATS下小范围肺切除手术。另外,可以认为FAC和RV-GPLS和RV-FWPLS在检测RV功能变化上更为敏感。既往有研究对比超声心动图评估右心室功能参数和心脏磁共振(CMR)发现,TAPSE、S'和RV-GPLS与RVEF(CMR)具有良好的相关性,RV-FWPLS和 RVFAC 与 RVEF(CMR)之间存在密切相关性[15]。这也与另一研究[16]一致,该研究显示肺切除术后, RV-GPLS和RV-FWPLS相较于传统RV收缩功能评估参数,不仅能更有效地预测RV功能障碍,且与CMR测量的RVEF具有高度相关性。本研究显示相对于其它评。研究发现,右心室纵向应变在全肺切除组更加明显,应变值可比术前降低50%以上[17]。另有研究显示,全肺切除术后出现肺动脉高压且伴有不良临床预后[18]。本研究观察到术后仅有少数患者出现一过性肺动脉高压,在后续观察中恢复正常,这可能也与手术切除范围有关。有研究显示,切除不超过1个肺叶通常会导致早期功能障碍,随后恢复[19]。肺功能的永久性功能损失很小(≤10%),运动能力仅略有下降或无变化。另一方面,全肺切除术会导致早期永久性肺动脉损失约33%,运动能力损失约20%。因此,本研究肺切除术后尽管存在后负荷增加,但右心室尚能通过适应性机制维持泵血功能。
在胸外科领域,关于小肺癌的最佳切除范围,即肺段切除术与肺叶切除术之间的选择,长期以来一直是学术争论的焦点[20-23]。值得注意的是,现有研究资料中鲜有深入探讨这两种术式对术后右心容积和功能参数影响的直接对比。鉴于此,本研究进一步通过对比分析两种不同术式患者右心容积和功能参数的动态变化情况,以评估不同范围肺组织切除对右心功能的潜在影响。本研究结果显示,尽管两组患者在手术切除的肺组织范围上存在差异,但术后右心容积及功能参数的对比并未出现显著差异,可能归因于以下几点:首先,两组中切除的肺叶组织量均相对较少,因此术后肺毛细血管网络的总体减少并不显著,这有助于维持足够的肺动脉灌注压;其次,剩余肺组织的代偿能力较强,能够有效缓解因部分肺组织缺失而可能引发的血流动力学变化;最后,微创技术的应用与围术期管理的优化也可能对减轻右心功能损伤起到了积极作用[5, 24, 25]。
有研究显示胸外科手术围手术期发病率可高达15%~42%[26, 27],常伴随右心功能障碍风险[28]。一项关于肺切除术后的大样本资料显示,术后需入住重症监护病房的总体发生率为2.3%[29]。然而,本研究患者在整个围手术期未出现明显右心功能障碍(FAC、TAPSE和RVEF均在正常范围内),且无一例需转入重症监护室。对比研究对象可发现,本研究患者大多以肺结节入院,年龄较轻,术前心脏大小和功能评估均在正常范围内,且排除了部分图像质量受影响的肺心病患者。而该研究中高龄患者多、存在潜在的心肺合并症且行开胸手术的患者较多。有研究表明,开胸手术组相比VATS手术,对右心室功能的损害更显著[30, 31]。因此,在胸外科手术患者的围术期管理中,应充分考虑患者的个体差异,采取针对性的预防措施。虽然患者术后耐受性良好,但是右心功能参数FAC、RV-GPLS和RV-FWPLS均有所减低,提示术后早期出现轻微功能障碍,临床可能要继续关注,警惕合并症导致病情加重。
综上所述,肺切除术后早期阶段,尽管患者可能未表现出明显的临床症状,但右心室扩张,术后早期出现右心室轻度功能障碍,表现为FAC、RV-GPLS和RV-FWPLS减低。在小肺癌的治疗策略中,无论是选择肺段切除术还是肺叶切除术,对术后右心功能的直接影响可能相对有限。本研究的局限性在于研究术后1月内的右心结构和功能变化情况,由于患者术后表现良好,因此在随后的3月、6月复查中逐渐失访,未获取完整的远期随访资料。未来研究应扩大样本量、加强长期随访,以提供更准确、可靠的临床指导。
参考文献:
[1] " Glass A, McCall P, Arthur A, et al. Pulmonary artery wave reflection and right ventricular function after lung resection[J]. Br J Anaesth, 2023, 130(1): e128-e136.
[2] " Giustiniano E, Nisi F, Piccioni F, et al. Right ventricle response to major lung resection (the RIVER study)[J]. J Cardiovasc Echogr, 2023, 33(2): 76-82.
[3] " Tanita T, Tomoyasu M, Deguchi H, et al. Review of preoperative functional evaluation for lung resection using the right ventricular hemodynamic functions[J]. Ann Thorac Cardiovasc Surg, 2004, 10(6): 333-9.
[4] " Venuta F, Sciomer S, Andreetti C, et al. Long‑term Doppler echocardiographic evaluation of the right heart after major lung resections[J]. Eur J Cardiothorac Surg, 2007, 32(5): 787-90.
[5] " 杨文荣, 李 "庄, 李爱民, 等. 肺叶切除术对局部非小细胞肺癌患者右心功能与生活质量的影响[J]. 大理大学学报, 2020, 5(4): 5.
[6] " Chen JF, Song DD, Sun ZY, et al. Effects of lung resection on heart structure and function: a tissue Doppler ultrasound survey of 43cases[J]. Biomed Rep, 2024, 20(1): 11.
[7] " Wu VCC, Takeuchi M. Three-dimensional echocardiography: current status and real-life applications[J]. Acta Cardiol Sin, 2017, 33(2): 107-18.
[8] " Penso M, Ranalletta RA, Pepi M, et al. Comparison between automatic and semiautomatic system for the 3D echocardiographic multiparametric evaluation of RV function and dimension[J]. J Clin Med, 2022, 11(15): 4528.
[9] " Wu WC, Liu BY, Huang M, et al. The role of four-dimensional automatic right ventricular quantification technology to determine RV function and hemodynamics in patients with pulmonary hypertension compared with right heart catheterization[J]. Front Cardiovasc Med, 2021, 8: 628610.
[10] "杨曼曼, 崔存英, 张 "瑞, 等. 四维自动右心室定量分析技术评价扩张型心肌病患者右心室功能[J]. 中华超声影像学杂志, 2023, 32(6): 485-92.
[11] Wharton G, Steeds R, Allen J, et al. A minimum dataset for a standard adult transthoracic echocardiogram: a guideline protocol from the British Society of Echocardiography[J]. Echo Res Pract, 2015, 2(1): G9-G24.
[12] "McCall PJ, Arthur A, Glass A, et al. The right ventricular response to lung resection[J]. J Thorac Cardiovasc Surg, 2019, 158(2): 556-65. e5.
[13] Reed CE, Dorman BH, Spinale FG. Mechanisms of right ventricular dysfunction after pulmonary resection[J]. Ann Thorac Surg, 1996, 62(1): 225-32.
[14] Elrakhawy HM, Alassal MA, Shaalan AM, et al. Impact of major pulmonary resections on right ventricular function: early postoperative changes[J]. Heart Surg Forum, 2018, 21(1): E009-E017.
[15] Focardi M, Cameli M, Carbone SF, et al. Traditional and innovative echocardiographic parameters for the analysis of right ventricular performance in comparison with cardiac magnetic resonance[J]. Eur Heart J Cardiovasc Imaging, 2015, 16(1): 47-52.
[16] McCall P, Soosay A, Kinsella J, et al. The utility of transthoracic echocardiographic measures of right ventricular systolic function in a lung resection cohort[J]. Echo Res Pract, 2019, 6(1): 7-15.
[17] Wang ZH, Yuan JJ, Chu W, et al. Evaluation of left and right ventricular myocardial function after lung resection using speckle tracking echocardiography[J]. Medicine, 2016, 95(31): e4290.
[18] Potaris K, Athanasiou A, Konstantinou M, et al. Pulmonary hypertension after pneumonectomy for lung cancer[J]. Asian Cardiovasc Thorac Ann, 2014, 22(9): 1072-9.
[19] Bolliger CT, Perruchoud AP. Functional evaluation of the lung resection candidate[J]. Eur Respir J, 1998, 11(1): 198-212.
[20] Charloux A, Quoix E. Lung segmentectomy: does it offer a real functional benefit over lobectomy?[J]. Eur Respir Rev, 2017, 26(146): 170079.
[21] "Nomori H, Shiraishi A, Cong Y, et al. Differences in postoperative changes in pulmonary functions following segmentectomy compared with lobectomy[J]. Eur J Cardiothorac Surg, 2018, 53(3): 640-7.
[22] Sachs E, Jackson V, Al‑Ameri M, et al. Uniportal video‑assisted thoracic surgery: segmentectomy versus lobectomy-early outcomes[J]. Eur J Cardiothorac Surg, 2024, 65(4): ezae127.
[23]Saji H, Okada M, Tsuboi M, et al. Segmentectomy versus lobectomy in small‑sized peripheral non‑small‑cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open‑label, phase 3, randomised, controlled, non-inferiority trial[J]. Lancet, 2022, 399(10335): 1607-17.
[24] "杨兴玲, 王晓伟, 金 "海. 非小细胞肺癌的外科治疗之全肺切除术[J]. 中华胸心血管外科杂志, 2020, 36(11): 694-700.
[25] "左正琴, 许志刚, 程春霞, 等. 床旁超声在肺癌切除术后心功能评估及肺部并发症诊治中的应用研究[J]. 临床肺科杂志, 2021, 26(9): 1420-4.
[26] Kolashov A, Lotfi S, Spillner J, et al. Evaluation of myocardial work changes after lung resection‑the significance of surgical approach: an echocardiographic comparison between VATS and thoracotomy[J]. Gen Thorac Cardiovasc Surg, 2024, 72(8): 542-50.
[27] "贾咏梅, 付义敏, 赵 "华. 心脏彩超测定Tei指数用于胸腔镜下与开胸肺叶切除术后心肌功能的临床评估[J]. 海南医学院学报, 2016, 22(5): 499-502.
[28] Maaliki N, Verdecia J, Fasen M, et al. Accelerated right heart failure due to lung resection in the setting of chronic respiratory failure[J]. J Cardiol Cases, 2022, 25(1): 42-5.
[29] "Koshino Y, Villarraga HR, Orban M, et al. Changes in left and right ventricular mechanics during the Mueller maneuver in healthy adults: a possible mechanism for abnormal cardiac function in patients with obstructive sleep apnea[J]. Circ Cardiovasc Imaging, 2010, 3(3): 282-9.
[30] Wei X, Yu HF, Dai W, et al. Patient‑reported outcomes of video-assisted thoracoscopic surgery versus thoracotomy for locally advanced lung cancer: a longitudinal cohort study[J]. Ann Surg Oncol, 2021, 28(13): 8358-71.
[31]Homma T, Shimada Y, Tanabe K. Decreased postoperative complications, neuropathic pain and epidural anesthesia-free effect of uniportal video-assisted thoracoscopic anatomical lung resection: a single-center initial experience of 100 cases[J]. J Thorac Dis, 2022, 14(9): 3154-66.
(编辑:林 "萍)
