拉帕替尼联合微波热疗治疗HER2阳性晚期乳腺癌的疗效
2024-07-07朱月丰宋建文戴妍妍
朱月丰 宋建文 戴妍妍
[摘要] 目的 研究拉帕替尼联合微波热疗治疗人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性晚期乳腺癌患者的疗效。方法 选取2019年1月至2020年1月于湖州市中心医院就诊的HER2阳性晚期乳腺癌患者134例,根据抽签法将其分为对照组和观察组,每组各67例。两组均使用拉帕替尼治疗,观察组患者在此基础上联合微波热疗治疗。比较两组患者治疗前后的肿瘤标志物[糖类抗原153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)、组织多肽抗原(tissue peptide antigen,TPA)]、循环肿瘤细胞(circulating tumor cell,CTC)数量、波形蛋白表达和生存质量,统计两组患者的临床疗效及生存状态。结果 治疗后,两组患者的CA153、CEA、TPA、CTC数量、波形蛋白表达均显著低于本组治疗前,生存质量评分均显著高于本组治疗前(P<0.05);观察组患者的CA153、CEA、TPA、CTC数量、波形蛋白表达均显著低于对照组,生存质量评分显著高于对照组(P<0.05)。观察组患者的治疗总有效率显著高于对照组(χ2=5.350,P=0.021)。两组患者的不良反应比较差异均无统计学意义(P>0.05)。随访24个月,观察组患者的总生存期、无进展生存期均显著长于对照组,24个月累积生存率显著高于对照组(P<0.05)。结论 拉帕替尼联合微波热疗治疗HER2阳性晚期乳腺癌效果良好,可改变波形蛋白表达抑制疾病进展,延长患者的生存期。
[关键词] 拉帕替尼;微波热疗;人类表皮生长因子受体2;晚期乳腺癌;波形蛋白;生存期
[中图分类号] R737.9 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.16.002
Efficacy of lapatinib combined with microwave hyperthermia in the treatment of HER2-positive advanced breast cancer
ZHU Yuefeng, SONG Jianwen, DAI Yanyan
Department of Breast Surgery, Huzhou Central Hospital, Huzhou 313000, Zhejiang, China
[Abstract] Objective To investigate the efficacy of lapatinib combined with microwave hyperthermia in the treatment of human epidermal growth factor receptor 2 (HER2) positive advanced breast cancer. Methods A total of 134 patients with HER2-positive advanced breast cancer treated in Huzhou Central Hospital from January 2019 to January 2020 were selected and divided into control group and observation group according to the lottery method, with 67 cases in each group. Both groups were treated with lapatinib, and the patients of observation group was treated with microwave hyperthermia on this basis. Tumor markers [carbohydrate antigen 153 (CA153), carcinoembryonic antigen (CEA), tissue peptide antigen (TPA)], the number of circulating tumor cells (CTC), vimentin expression and quality of life were compared between two groups before and after treatment. The clinical efficacy and survival status of two groups were analyzed. Results After treatment, CA153, CEA, TPA, the number of CTC and vimentin expression in two groups were significantly lower than before treatment, and the quality of life score was significantly higher than before treatment (P<0.05). CA153, CEA, TPA, the number of CTC and vimentin expression in observation group were significantly lower than those in control group, and the quality of life score was significantly higher than that in control group (P<0.05). The total effective rate of observation group was significantly higher than that of control group (χ2=5.350, P=0.021). There was no significant difference in adverse reactions between two groups (P>0.05). After 24 months of follow-up, the overall survival and progression-free survival of observation group were significantly longer than those of control group, and the 24-month cumulative survival rate was higher than that of control group (P<0.05). Conclusion Lapatinib combined with microwave hyperthermia has a good effect in the treatment of HER2-positive advanced breast cancer, which can change vimentin expression, inhibit disease progression and prolong the survival of patients.
[Key words] Lapatinib; Microwave hyperthermia; Human epidermal growth factor receptor 2; Advanced breast cancer; Vimentin; Survival time
2020年全球乳腺癌新发病例约170万例,发病率达24.3%,其中以人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌发病率最高[1-2]。目前已相继研制出多个HER2靶向药物,曲妥珠单抗作为一线抗HER2阳性乳腺癌药物具有一定效果,但其毒性和耐药性一直是临床所面临的挑战[3]。继曲妥珠单抗之后拉帕替尼作为HER2靶向药物应用于临床,可阻止乳腺癌的转移和进展[4]。微波热疗通过微波产生的热量加热肿瘤局部直接或间接杀伤肿瘤细胞[5]。研究显示乳腺癌的进展与循环肿瘤细胞(circulating tumor cell,CTC)进入外周循环密切相关,波形蛋白作为CTC表型基因,在乳腺癌迁移中具有促进作用[6]。本研究将拉帕替尼与微波热疗用于患者治疗,并以波形蛋白表达状况作为观察指标,为临床HER2阳性晚期乳腺癌患者治疗方案的选择提供参考。
1 资料与方法
1.1 一般资料
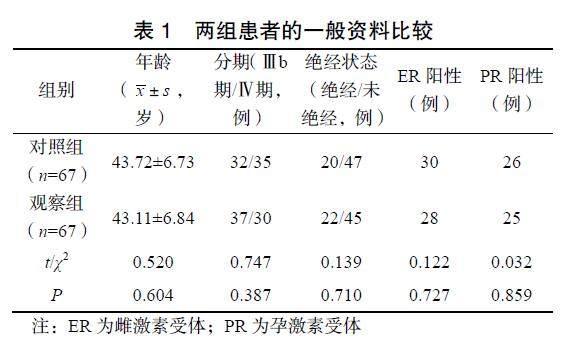
选取2019年1月至2020年1月于湖州市中心医院就诊的HER2阳性晚期乳腺癌患者134例。纳入标准:①经病理确诊为HER2阳性晚期乳腺癌;②年龄≥18岁;③女性;④TNM分期为Ⅲb~Ⅳ期;⑤未合并其他部位原发肿瘤;⑥单侧病变;⑦曲妥珠单抗耐药;⑧晚期治疗线数超过三线者。排除标准:①疾病急剧恶化,预计生存期<90d者;②药物过敏者;③先天免疫系统障碍者;④依从性较差者。根据抽签法将其分为对照组和观察组,每组各67例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。患者及家属均知晓并签署知情同意书,本研究经湖州市中心医院伦理委员会批准(伦理审批号:YTL20190689)。
1.2 治疗方法
所有患者第1~28天口服拉帕替尼(注册证号:国药准字HJ20171251,生产厂商:Glaxo Operations UK Limited,规格:0.25mg)1250mg/(次·d),28d为1个疗程,服用4个疗程。观察组患者在此基础上联合微波热疗,使用HG-2000I型微波热疗机,上下极板正对病灶中心加热热疗,靶区温度39~41℃,若患者出现不适,调整靶区温度,1h/次,2次/周,7d为1个疗程,连续4个疗程。
1.3 指标观察
1.3.1 乳腺癌相关肿瘤标志物 分别抽取患者治疗前、治疗4个疗程后静脉血3ml,3000转/min离心10min分离血清,使用酶联免疫吸附测定法检测乳腺癌相关糖类抗原153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)、组织多肽抗原(tissue peptide antigen,TPA)等肿瘤标志物水平。
1.3.2 CTC数量及波形蛋白 分别于患者治疗前、治疗4个疗程后采集静脉血7ml,分离单个核细胞,制备为细胞悬液,加Fc受体阻断剂、上皮细胞黏附分子偶联微珠,分选上皮细胞黏附分子阳性细胞,样本使用抗CD45、上皮细胞黏附分子、细胞角蛋白抗体标记,CD45-/上皮细胞黏附分子+/细胞角蛋白+的细胞定义为CTC,计算CTC数量。使用反转录聚合酶链反应检测其表型波形蛋白表达量,获得细胞RNA,反应体系:引物序列1μl,TaqMan 10μl,cDNA 1.33μl,加无核酸酶水至20μl,45个循环,使用2-??Ct计算波形蛋白表达量。
1.3.3 临床疗效 治疗4个疗程后根据实体瘤疗效标准[7]评价两组患者的临床疗效。完全缓解:病灶完全消失,且至少维持4周;部分缓解:病灶两径乘积减少50%以上,至少维持4周;疾病稳定:病灶两径乘积减少25%;疾病进展:达不到上述标准或有新病灶。总有效率=(完全缓解例数+部分缓解例数)/总例数×100%。
1.3.4 不良反应 统计患者的恶心呕吐、发热、腹泻、贫血等不良反应发生情况。
1.3.5 生存质量 采用汉化版乳腺癌生存质量量表[8]评价患者治疗前、治疗4个疗程后的生存质量,该量表采用5级评分法,评分越高提示生存质量越好。
1.3.6 随访 患者疗程结束后,每3个月进行1次电话或门诊随访,共随访8次,统计总生存期、无进展生存期、24个月累积生存率。
1.4 统计学方法
采用SPSS 22.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差(![]() )表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,使用Log-Rank检测进行生存期分析。P<0.05为差异有统计学意义。
)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,使用Log-Rank检测进行生存期分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的CTC数量、波形蛋白表达比较
治疗前,两组患者的CTC数量、波形蛋白表达比较差异均无统计学意义(P>0.05);治疗4个疗程后,两组患者的CTC数量、波形蛋白表达均显著低于本组治疗前(P<0.05),且观察组患者的CTC数量、波形蛋白表达均显著低于对照组(P<0.05),见表2。
2.2 两组患者的乳腺癌相关肿瘤标志物比较
治疗前,两组患者的CA153、CEA、TPA水平比较差异均无统计学意义(P>0.05);治疗4个疗程后,两组患者的CA153、CEA、TPA水平均显著低于本组治疗前(P<0.05),且观察组患者的上述指标均显著低于对照组(P<0.05),见表3。
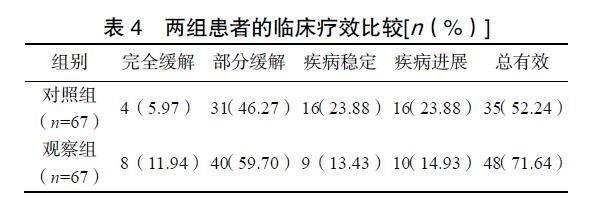
2.3 两组患者的临床疗效比较
观察组患者的治疗总有效率显著高于对照组(χ2=5.350,P=0.021),见表4。
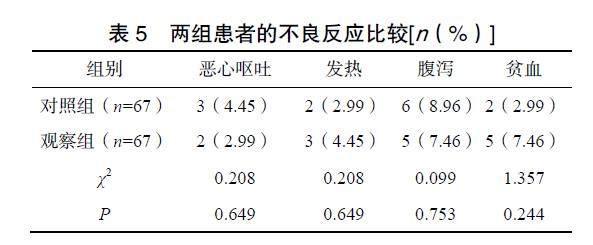
2.4 两组患者的不良反应比较
两组患者的不良反应比较差异均无统计学意义(P>0.05),见表5。
2.5 两组患者的生存质量比较
治疗前,两组患者的生存质量比较差异无统计学意义(P>0.05);治疗4个疗程后,两组患者的生存质量评分均显著高于本组治疗前(P<0.05),且观察组患者的生存质量评分显著高于对照组(P<0.05),见表6。
2.6 两组患者的生存情况比较
随访24个月,对照组3例患者失访,观察组5例患者失访。观察组患者的总生存期、无进展生存期均显著长于对照组(P<0.05),24个月累积生存率显著高于对照组(P<0.05),见表7。
3 讨论
虽然目前乳腺癌的诊疗手段已取得一定的进步,但仍有部分患者在确诊时已为晚期。HER2阳性乳腺癌侵袭性强,大多预后较差,这可能与HER2的促癌细胞增殖、分化作用有关[9-11]。既往常将曲妥珠单抗用于HER2阳性乳腺癌的治疗,但易发生曲妥珠单抗耐药,而拉帕替尼与曲妥珠单抗作用机制不同,可通过抑制HER2和表皮生长因子受体活性降低HER2阳性乳腺癌耐药风险[12-13]。研究认为拉帕替尼通过阻断HER2、表皮生长因子受体表达及配体非依赖性信号传导、依赖性信号传导影响病灶微环境,抑制肿瘤细胞的扩散转移[14-16]。临床已证实拉帕替尼可延长HER2阳性乳腺癌患者的生存期[17-18]。本研究发现,经4个疗程拉帕替尼干预后,患者的肿瘤标志物水平降低,CTC数量减少,提示拉帕替尼具有抑制HER2阳性乳腺癌细胞增殖的作用。
微波热疗具有操作简单、定向杀灭肿瘤细胞、不良反应少等优点,目前已广泛用于多种恶性肿瘤的辅助治疗。微波热疗过程中,电磁微波透过组织后引起细胞内分子、离子快速运动,升高细胞局部温度改变细胞生存环境,达到杀灭肿瘤细胞的目的[19-20]。微波热疗除具有杀灭肿瘤细胞的作用外,还可作用于免疫系统,逆转免疫损伤,提高患者免疫力,增强机体抗肿瘤能力[21-23]。本研究结果显示,与单纯使用拉帕替尼治疗的患者相比,使用微波热疗联合拉帕替尼治疗的患者肿瘤标志物水平降低更显著,且生存期明显延长。究其原因:微波热疗通过局部加热杀灭肿瘤细胞,起到抗肿瘤进展的作用,从而表现为肿瘤标志物水平降低,生存周期延长;在HER2阳性晚期乳腺癌患者使用拉帕替尼的基础上加用微波热疗可进一步增强拉帕替尼的作用。
HER2阳性晚期乳腺癌复发率高、转移性强,此类患者生存期较短。CTC在肿瘤转移过程中发挥重要的作用[24]。CTC具有半衰期短、释放后易被消除等特点,在肿瘤组织不稳定和外界刺激下脱离原发病灶,成功逃避免疫监视渗透到靶器官中,在靶器官定植后促进肿瘤转移[25]。研究发现CTC由特定细胞、多种基因组和多种表型共同组成,而非单一细胞种群,可经上皮间质转化进入循环系统[26]。而波形蛋白作为重要的上皮间质转化因子,是细胞骨架结构形成的重要成分,在介导CTC定植靶器官中具有重要意义[27]。既往研究表明乳腺癌中波形蛋白随临床分期的增加和病灶转移升高,是促进复发转移的重要原因[28]。本研究发现,观察组患者的CTC数量明显减少,波形蛋白表达量显著降低,说明微波热疗联合拉帕替尼可通过抑制CTC上皮间质转化而减少靶器官定植,进而发挥抑制乳腺癌进展的作用。与单一拉帕替尼治疗相比,拉帕替尼联合微波热疗并未增加不良反应事件,提示拉帕替尼联合微波热疗在HER2阳性晚期乳腺癌治疗中安全可行。
综上所述,HER2阳性晚期乳腺癌患者使用拉帕替尼联合微波热疗效果理想,可减少CTC数量,改变波形蛋白表达,起到抑制疾病进展、延长患者生存期的作用。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BREDIN P, WALSHE J M, DENDULURI N. Systemic therapy for metastatic HER2-positive breast cancer[J]. Semin Oncol, 2020, 47(5): 259–269.
[2] ANDERSSON A, LARSSON L, STENBECK L, et al. Spatial deconvolution of HER2-positive breast cancer delineates tumor-associated cell type interactions[J]. Nat Commun, 2021, 12(1): 6012.
[3] 郭智慧, 周庆, 蒋安科, 等. 曲妥珠单抗在HER-2阳性乳腺癌新辅助化疗中的应用及对肿瘤标志物和免疫功能的影响[J]. 肿瘤药学, 2019, 9(1): 98–102.
[4] 段海波, 胡倩, 林颖欣, 等. 曲妥珠单抗联合拉帕替尼及多西紫杉醇一线治疗HER-2阳性晚期乳腺癌的安全性和有效性[J]. 现代肿瘤医学, 2020, 28(18): 3159–3163.
[5] 黄红莉, 董桂玉, 牛立志. 曲妥珠单抗联合微波热疗治疗HER-2阳性晚期乳腺癌的临床疗效分析[J]. 现代肿瘤医学, 2020, 28(17): 2985–2989.
[6] 欧阳航, 陈德波, 骆时木, 等. 乳腺癌晚期患者循环肿瘤细胞表型Vimentin mRNA与AKT1 mRNA水平表达对临床疗效评估的价值研究[J]. 现代检验医学杂志, 2021, 36(5): 73–76, 82.
[7] 杨学宁, 吴一龙. 实体瘤治疗疗效评价标准-RECIST[J]. 循证医学, 2004, 4(2): 85–90, 111.
[8] 万崇华, 张冬梅, 汤学良, 等. 乳腺癌患者生命质量测定量表(FACT-B)中文版的修订[J]. 中国心理卫生杂志, 2003, 17(5): 298–300.
[9] CECSA M G, VIAN L, CRIST?V?O-FERREIRA S, et al. HER2-positive advanced breast cancer treatment in 2020[J]. Cancer Treat Rev, 2020, 88(1): 102033.
[10] EMENS L A, ESTEVA F J, BERSFORD M, et al. Trastuzumab emtansine plus atezolizumab versus trastuzumab emtansine plus placebo in previously treated, HER2- positive advanced breast cancer (KATE2): A phase 2, multicentre, randomised, double-blind trial[J]. Lancet Oncol, 2020, 21(10): 1283–1295.
[11] LEON-FERRE R A, HIEKEN T J, BOUGHEY J C. The landmark series: Neoadjuvant chemotherapy for triple- negative and HER2-positive breast cancer[J]. Ann Surg Oncol, 2021, 28(4): 2111–2119.
[12] XU B, YAN M, MA F, et al. Pyrotinib plus capecitabine versus lapatinib plus capecitabine for the treatment of HER2-positive metastatic breast cancer (PHOEBE): A multicentre, open-label, randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2021, 22(3): 351–360.
[13] AHMED S, MOHAMED H T, EI-HUSSEINY N, et al. IL-8 secreted by tumor associated macrophages contribute to lapatinib resistance in HER2-positive locally advanced breast cancer via activation of Src/ STAT3/ERK1/2-mediated EGFR signaling[J]. Biochim Biophys Acta Mol Cell Res, 2021, 1868(6): 118995.
[14] 贠泽蕙, 李惠平. 激素受体阳性/人表皮生长因子受体2阳性晚期乳腺癌的多靶向治疗研究进展[J]. 癌症进展, 2021, 19(18): 1852–1857, 1867.
[15] HADDAD T C, HE J, O'SULLIVAN C C, et al. Randomized phase Ⅱ trial of capecitabine and lapatinib with or without IMC-A12 (cituxumumab) in patients with HER2-positive advanced breast cancer previously treated with trastuzumab and chemotherapy: NCCTG N0733 (Alliance)[J]. Breast Cancer Res Treat, 2021, 188(2): 477–487.
[16] XIE Y, GE R, SANG D, et al. Real-world data of lapatinib and treatment after lapatinib in patients with previously treated HER2-positive metastatic breast cancer: A multicenter, retrospective study[J]. Cancer Med, 2020, 9(9): 2981–2988.
[17] CHINTALARAMULU N, VADIVELU R, NGUYEN N T, et al. Lapatinib inhibits doxorubicin induced migration of HER2-positive breast cancer cells[J]. Inflammopharmacology, 2020, 28(5): 1375–1386.
[18] 王素娥, 董林, 胡晓娜. 拉帕替尼与卡培他滨对HER-2阳性乳腺癌患者的疗效与安全性分析[J]. 实用癌症杂志, 2021, 36(2): 293–296, 300.
[19] YU M, PAN H, CHE N, et al. Microwave ablation of primary breast cancer inhibits metastatic progression in model mice via activation of natural killer cells[J]. Cell Mol Immunol, 2021, 18(9): 2153–2164.
[20] ZHOU W, YU M, MAO X, et al. Landscape of the peripheral immune response induced by local microwave ablation in patients with breast cancer[J]. Adv Sci (Weinh), 2022, 9(17): e2200033.
[21] DOLAT K, RAHMAN A U, KUMAM P, et al. Thermal analysis of different shape nanoparticles on hyperthermia therapy on breast cancer in a porous medium: A fractional model[J]. Heliyon, 2022, 8(8): e10170.
[22] CHICHE? A, BURCHARDT W, CHYREK A J, et al. Thermal boost combined with interstitial brachytherapy in early breast cancer conserving therapy-initial group long-term clinical results and late toxicity[J]. J Pers Med, 2022, 12(9): 1382.
[23] 唐静. 乳腺癌中循环肿瘤细胞侵袭及转移中枢神经系统研究进展[J]. 重庆医学, 2022, 51(13): 2321–2325.
[24] 樊霞, 付景林, 刘静. 外周血液中循环肿瘤细胞和循环游离DNA检测在乳腺癌患者中的应用[J]. 诊断病理学杂志, 2021, 28(1): 47–50, 54.
[25] 王思远, 顾佳鑫, 周毅. 循环肿瘤细胞在乳腺癌诊治中的应用[J]. 医学综述, 2021, 27(1): 105–109, 115.
[26] WINTER M, MEIGNAN S, V?LKEL P, et al. Vimentin promotes the aggressiveness of triple negative breast cancer cells surviving chemotherapeutic treatment[J]. Cells, 2021, 10(6): 1504.
[28] FAN J Q, LI Y J, WEI Z J, et al. Binding-induced fibrillogenesis peptides recognize and block intracellular vimentin skeletonization against breast cancer[J]. Nano Lett, 2021, 21(14): 6202–6210.
[29] TASHIREVA L A, SAVELIEVA O E, GRIGORYEVA E S, et al. Heterogeneous manifestations of epithelial- mesenchymal plasticity of circulating tumor cells in breast cancer patients[J]. Int J Mol Sci, 2021, 22(5): 2504.
(收稿日期:2024–02–02)
(修回日期:2024–05–20)
