93例胰腺导管腺癌患者的临床预后分析
2021-01-27高杨张升宁张熙冰莽源祎李立冉江华
高杨,张升宁,张熙冰,莽源祎,李立,冉江华
(昆明市第一人民医院,昆明医科大学附属甘美医院肝胆胰血管外科,云南省器官移植研究所,云南 昆明 650000)
胰腺导管腺癌(胰腺癌,pancreatic ductal adenocarcinoma,PDAC)是恶性程度最高的肿瘤之一。在西方国家恶性肿瘤中致死率居第4位,目前仍呈上升趋势[1]。在我国发病率也逐年上升,且总体预后不佳。目前,国内外相关研究对胰腺癌的治疗仍存在一定争议,但是外科手术仍有可能是患者获得长期存活的唯一方式。如果手术结合辅助化疗,5年生存率可达20%~25%[2]。本研究旨在探讨胰腺癌患者接受手术治疗的效果,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2012年1月至2017年1月昆明市第一人民医院肝胆胰血管外科收治并进行手术,最终病理检查为胰腺导管腺癌的患者93 例,所有患者均行手术治疗并进行随访,随访患者无瘤生存期(DFS),总生存期(OS)等,排除由于各种原因未行手术或术后失访的患者。患者年龄37~82 岁;男56 例,女37 例。相关因素包括临床分期[临床分期根据美国癌症联合委员会(AJCC)第7版胰腺癌肿瘤-淋巴结-转移(TNM)分类法[3]],术后病检肿瘤分化情况,是否达到R0切除,术中是否规范淋巴结清扫,术前、术后CA199 水平。根据血清 CA199 将患者分为3 组:≤37 U/L为正常值组(正常值参考水平,≤37 U/L),37~120 U/L(3 倍正常值)为轻度升高组,>120 U/L为显著升高组。
1.2 随访 门诊随访或住院复查随访。记录是否有肿瘤复发、是否死亡、死亡时间等。计算生存期(overall survival,OS)和无瘤生存期(disease free survival,DFS),随访截止至2018年6月1日。
1.3 统计学方法 采用SPSS 16.0 统计学软件进行数据分析,年龄及生存时间以中位数表示,以“”表示,生存期及无瘤生存期的比较采用独立样本t检验和单因素方差分析;等级变量用Spearman 非参数相关分析;生存期分析采用Kaplsn-Meier法;生存期及无瘤生存期风险因素采用COX多因素回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床资料 93 例胰腺癌患者的基本情况及随访结果见表1。
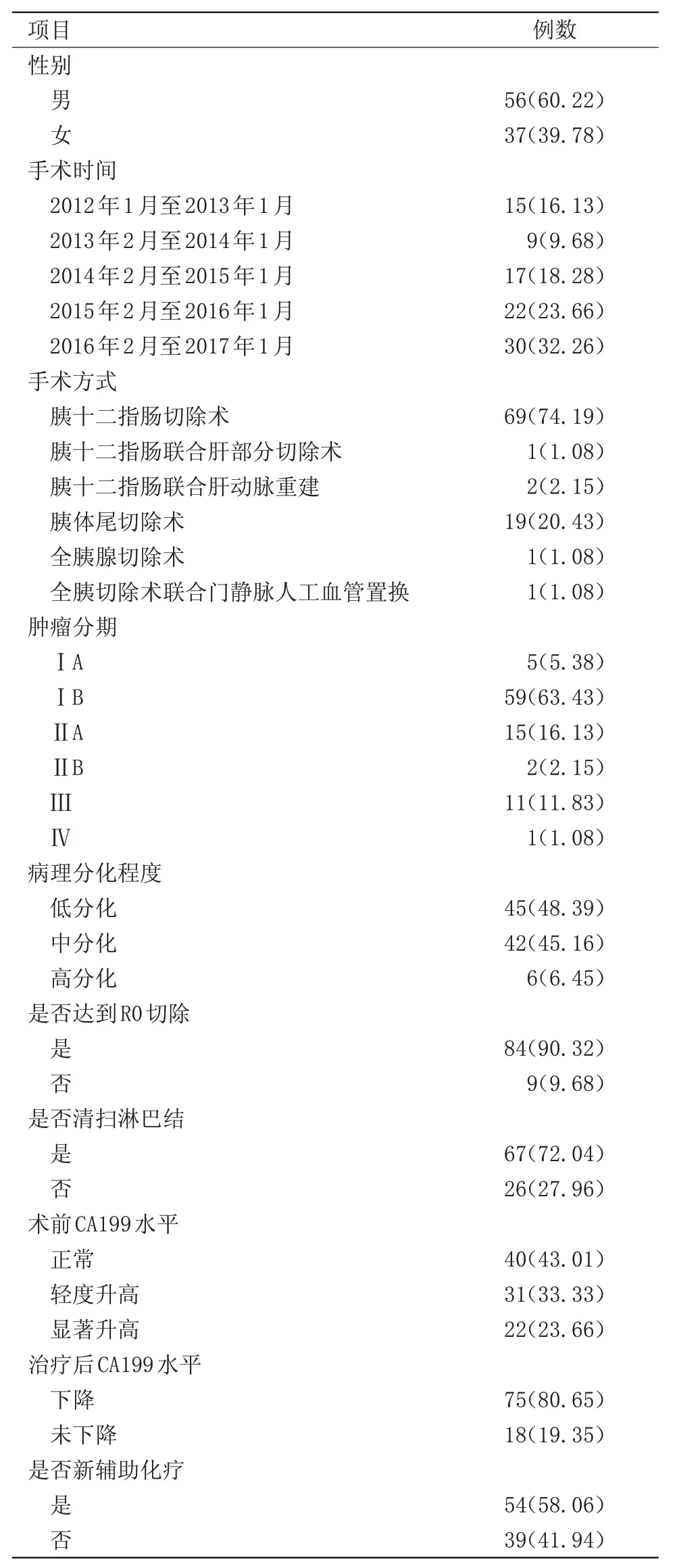
表1 基本资料[n(%)]Table 1 Basic data[n(%)]
2.2 患者生存情况 93 例患者术后随访至2018年6月1日,死亡76 例(84.94%),目前仍生存17 例(18.28%),最长生存时间超过60个月。中位总生存期(median overall survival,mOS)为16.5 个月(95%CI:11~22 个月),中位无瘤生存 期(median disease free survival,mDFS)14 个月(95%CI:6~18 个月),1年生存率为70.97%,无瘤生存率为59.13%,2年生存率为31.18%,无瘤生存率为22.58%,见表2,图1~2。
2.3 肿瘤分期与患者生存时间及肿瘤复发时间的单因素分析 不同肿瘤分期中位生存期比较差异有统计学意义(P=0.027)。不同肿瘤分期中位无瘤生存期比较差异有统计学意义(P=0.035),见表3。

表2 总体生存率、无瘤生存率的随访分析Table 2 Follow-up analysis of overall survival rate and tomour-free survival rate
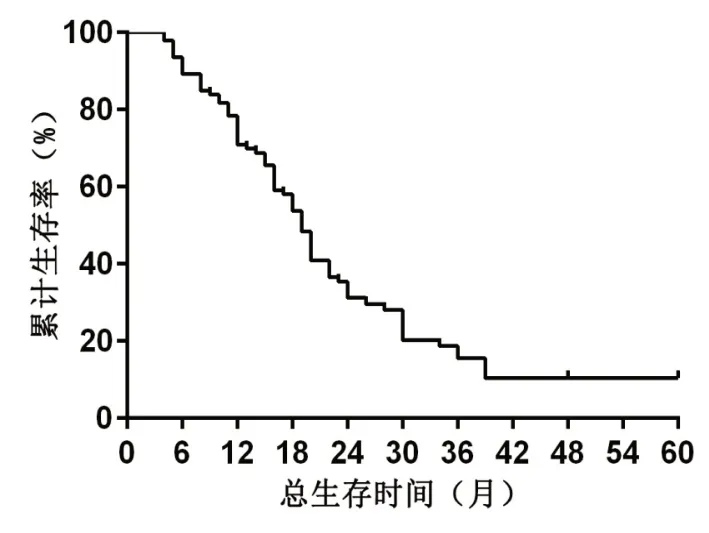
图1 总体生存率Figure 1 Overall survival rate
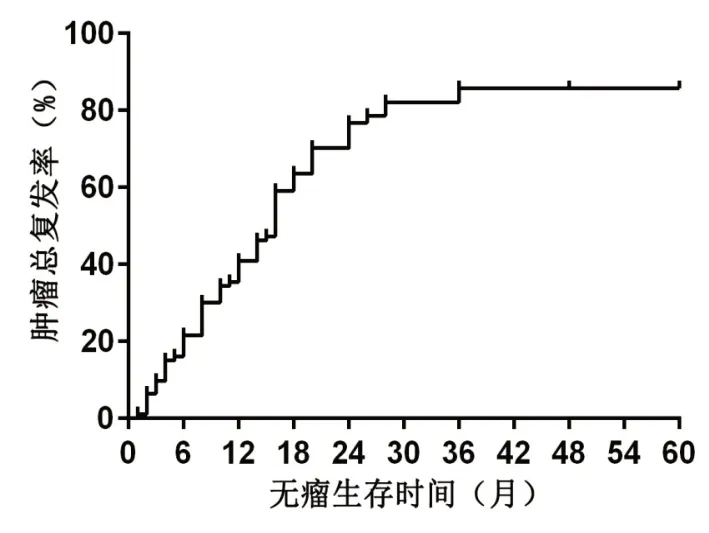
图2 无瘤生存率Figure 2 Tumor-free survival rate
表3 肿瘤分期对患者生存期及无瘤生存期的影响Table 3 Influence of tumor stage on survival and tumor-free survival of patients

表3 肿瘤分期对患者生存期及无瘤生存期的影响Table 3 Influence of tumor stage on survival and tumor-free survival of patients
注:与ⅠB分期比较,aP<0.05;与ⅡB分期比较,bP<0.05
无瘤生存期18.80±23.17 18.90±10.72 15.47±10.91 8.55±8.80 7.00±1.41ab 8 2.410 0.035肿瘤分期ⅠAⅠBⅡAⅡBⅢⅣF值例数5 59 15 2 11 1 P值生存期23.60±20.51 22.34±10.02 18.93±10.42 12.00±0.00 11.55±9.33ab 10 2.878 0.027
2.4 病理分化程度与生存期及无瘤生存期的单因素分析低分化、中分化、高分化肿瘤中位生存期比较差异有统计学意义(P=0.001);低分化、中分化、高分化肿瘤中位无瘤生存期比较差异有统计学意义(P=0.000),见表4。
表4 病理分化程度对生存期及无瘤生存期的影响Table 4 Effects of pathological differentiation on survival and tumorfree survival

表4 病理分化程度对生存期及无瘤生存期的影响Table 4 Effects of pathological differentiation on survival and tumorfree survival
注:与低分化比较,aP<0.05;与高分化比较,bP<0.05
无瘤生存期11.71±6.65 21.14±13.74ab 23.67±11.48 9.472 0.000病理分化程度低分化中分化高分化F值P值例数45 42 6生存期16.04±7.15 23.38±12.69ab 29.50±12.06 8.081 0.001
2.5 术前CA199水平与患者生存期及无瘤生存期的单因素分析 术前CA199 水平正常者、轻度升高者、显著升高者中位生存期比较差异有统计学意义(P=0.045)。术前CA199水平正常者、轻度升高者、显著升高者中位无瘤生存期比较差异有统计学意义(P=0.031),见表5。
表5 术前CA199水平对生存期及无瘤生存期的影响(,月)Table 5 Influence of preoperative CA199 level on survival and tumorfree survival(,month)
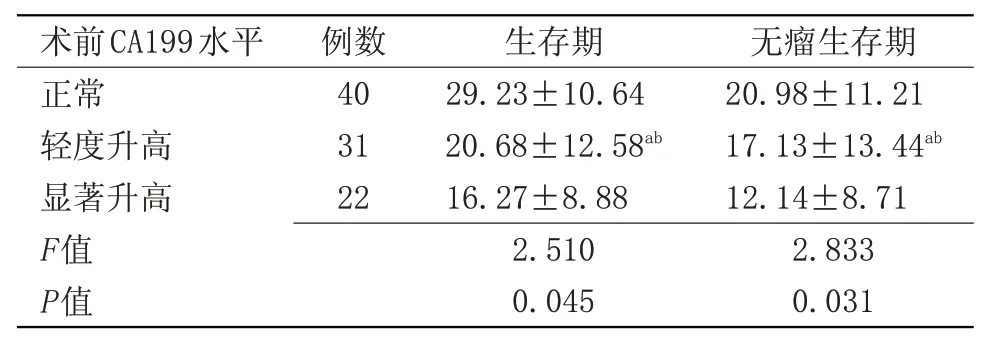
表5 术前CA199水平对生存期及无瘤生存期的影响(,月)Table 5 Influence of preoperative CA199 level on survival and tumorfree survival(,month)
注:与正常水平比较,aP<0.05;与显著升高水平比较,bP<0.05
无瘤生存期20.98±11.21 17.13±13.44ab 12.14±8.71 2.833 0.031术前CA199水平正常轻度升高显著升高F值P值例数40 31 22生存期29.23±10.64 20.68±12.58ab 16.27±8.88 2.510 0.045
2.6 治疗后CA199改变与患者生存期及无瘤生存期的单因素分析 治疗后CA199下降者中位生存期为(25.23±9.54)个月,治疗后CA199 未下降者中位生存期为(18.68±8.48)个月,差异有统计学意义(P=0.031)。治疗后CA199 下降者中位无瘤生存期为(16.67±10.11)个月,治疗后CA199下降者中位无瘤生存期为(13.15±8.94)个月,差异有统计学意义(P=0.039),见表6。
表6 CA199变化情况对生存期及无瘤生存期的影响(,月)Table 6 Influence of CA199 changes on survival and tumor-free survival(,month)

表6 CA199变化情况对生存期及无瘤生存期的影响(,月)Table 6 Influence of CA199 changes on survival and tumor-free survival(,month)
无瘤生存期16.67±10.11 13.15±8.94-2.105 0.039治疗后CA199变化下降未下降t值P值例数75 18生存期25.23±9.54 18.68±8.48-2.218 0.031
2.7 R0 切除与患者生存期及无瘤生存期的单因素分析达到R0 切除术者中位生存期为(20.37±11.26)个月,未达到R0切除术者中位生存期为(18.89±9.74)个月,差异有统计学意义(P=0.028)。达到R0 切除术者中位无瘤生存期为(19.85±11.92)个月,未达到R0切除术者中位无瘤生存期为(15.78±9.86)个月,差异有统计学意义(P=0.035),见表7。
表7 R0切除对生存期及无瘤生存期的影响Table 7 Effects of R0 resection on survival and tumor-free survival

表7 R0切除对生存期及无瘤生存期的影响Table 7 Effects of R0 resection on survival and tumor-free survival
无瘤生存期19.85±11.92 15.78±9.86-2.359 0.035是否R0切除是否t值例数84 9 P值生存期20.37±11.26 18.89±9.74-2.379 0.028
2.8 淋巴结清扫与患者生存期及无瘤生存期的单因素分析淋巴结清扫者中位生存期为(25.58±11.41)个月,未做淋巴结清扫者中位生存期为(18.15±10.31)个月,差异有统计学意义(P=0.003)。淋巴结清扫者中位无瘤生存期为(23.73±2.82)个月,未做淋巴结者中位无瘤生存期为(14.03±10.09)个月,差异有统计学意义(P=0.000),见表8。
表8 淋巴结清扫对生存期及无瘤生存期的影响(,月)Table 8 Effects of lymph node dissection on survival and tumor-free survival(,month)

表8 淋巴结清扫对生存期及无瘤生存期的影响(,月)Table 8 Effects of lymph node dissection on survival and tumor-free survival(,month)
无瘤生存期23.73±2.82 14.03±10.09-3.849 0.000是否淋巴结清扫是否t值例数67 26 P值生存时间25.58±11.41 18.15±10.31-3.026 0.003
2.9 新辅助化疗与患者生存期及无瘤生存期的单因素分析 进行新辅助化疗者中位生存期为(24.79±10.35)个月,未进行新辅助化疗者中位生存期为(16.93±10.49)个月,差异有统计学意义(P=0.001)。进行新辅助化疗者中位无瘤生存期为(22.18±11.77)个月,未进行新辅助化疗者中位无瘤生存期为(12.81±10.04)个月,差异具有统计学意义(P=0.000),见表9。
表9 新辅助化疗对生存期及无瘤生存期的影响(,月)Table 9 Effects of neoadjuvant chemotherapy on survival and tumorfree survival(,month)
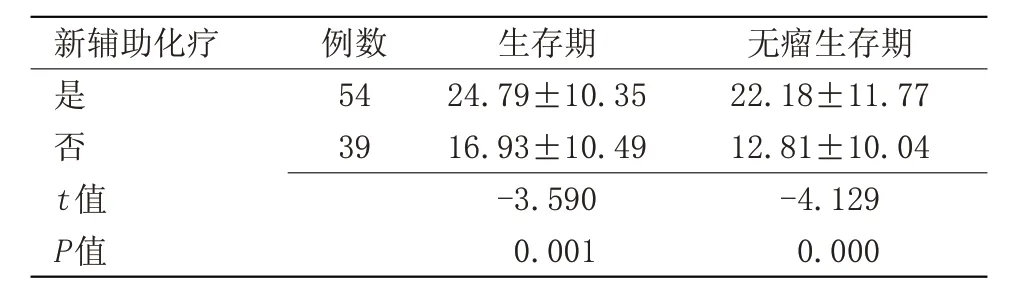
表9 新辅助化疗对生存期及无瘤生存期的影响(,月)Table 9 Effects of neoadjuvant chemotherapy on survival and tumorfree survival(,month)
无瘤生存期22.18±11.77 12.81±10.04-4.129 0.000新辅助化疗是否t值例数54 39 P值生存期24.79±10.35 16.93±10.49-3.590 0.001
2.10 影响患者生存时间及肿瘤复发时间的多因素分析将影响因素,对患者生存期及无瘤生存期进行相关性分析,发现肿瘤分期、病理分化程度、术前CA199 水平、术后CA199是否下降、是否R0 切除、是否淋巴结清扫、是否新辅助化疗因素均与患者生存期和无瘤生存期有关(P<0.05),见表10。将上述差异有统计学意义的因素作为自变量,进行COX回归多因素分析,探讨影响生存期和无瘤生存期的独立预后风险因素。COX回归多因素分析结果显示,以上因素均对患者的生存时间和无瘤生存期有影响,可作为独立因素的影响患者预后(P<0.05),见表11~12。
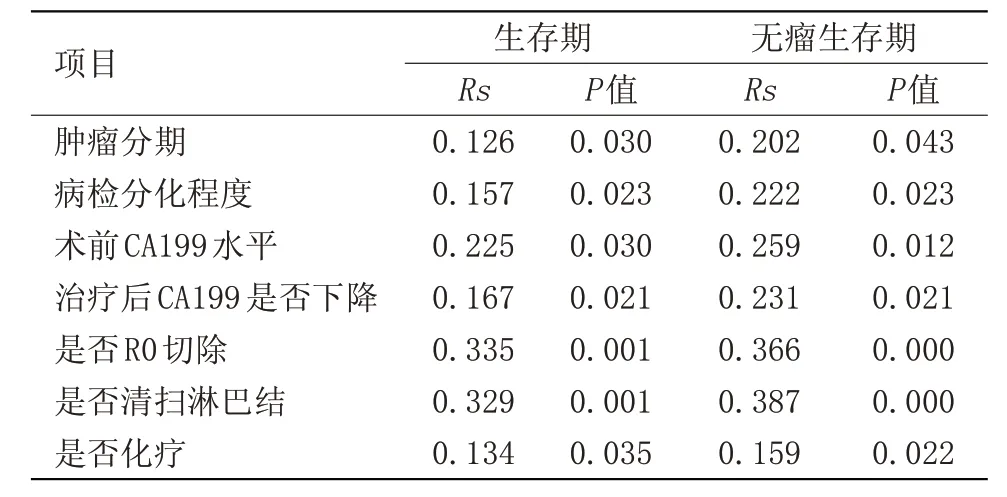
表10 患者生存及肿瘤复发时间的影响因素的相关性分析Table 10 Correlation analysis of factors influencing survival and tumor recurrence time of patients
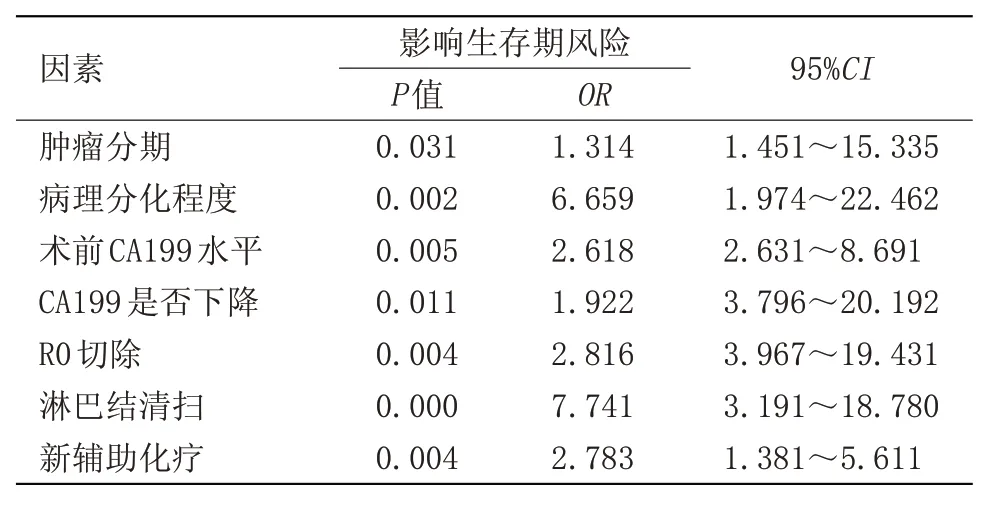
表11 影响生存期的独立风险因素Table 11 Independent risk factors influencing survival

表12 影响无瘤生存期的独立风险因素Table 12 Independent risk factors influencing tumor-free survival
3 讨论
近年来,胰腺外科已有巨大的发展,甚至可以切除边界性可切除的胰腺导管腺癌(borderline resectable pancreatic ductal adenocarcinoma,BR-PDAC)。与手术相应的新辅助治疗(neoadjuvant treatment)也有较大的进步,手术结合辅助化疗是PDAC 患者可能获得长期生存的唯一手段。
3.1 R0 切除与淋巴结清扫 手术的目的是实施根治性切除,保证达到R0 切除。胰头癌患者应该行标准的胰十二指肠切除术,需完整切除沟突系膜,清扫淋巴结范围应包括5、6、8a、12b1、12b2、12c、13a、13b、14a、14b、17a、17b 组淋巴结。对于胰体尾癌应该行胰体尾切除术,清扫淋巴结范围包括10、11、18 组淋巴结。如果肿瘤全胰腺侵犯,需行全胰切除术。由于技术原因本院2012年1月至2014年1月期间进行的胰腺手术未行规范的淋巴结清扫,R0切除不可靠,患者术后无瘤生存期及生存时间明显较短,此后由于技术的不断改进,手术技术提高实行可靠的R0 切除并规范进行淋巴结清扫,患者预后明显优于未做规范淋巴结清扫的患者。
3.2 血管切除重建与预后 在胰腺癌中,门静脉和肠系膜上静脉侵犯较常见,也是过去导致手术不能完成的主要原因之一。胰腺外科过去30年的发展,使门静脉,肠系膜上静脉切除重建得到广泛的应用并被推荐[4]。有研究显示,门静脉肠系膜上静脉的切除并未增加手术并发症发生率和死亡率[5-7],且肿瘤学的结果与进行标准胰腺癌根治术的患者一致[8]。
与肿瘤对静脉的侵犯比较,胰腺癌对腹腔动脉和肠系膜上动脉的侵犯是肿瘤侵蚀性非常高的标准。对胰腺癌已经侵犯腹腔动脉和肠系膜上动脉的患者进行手术仍是个别情况[9-13]。胰腺癌手术中对肠系膜上动脉,腹腔动脉的评估十分重要,如果肠系膜上动脉被侵犯超过180°或/和腹腔动脉被侵犯,是不可切除的。如果肠系膜上动脉被侵犯小于180°或/和侵犯部分肝动脉则是BR-PDAC的范畴[14]。对于由动脉侵犯被定义BR-PDAC的患者均应行外科探查手术,探查中应该遵循“动脉优先”的原则评估肠系膜上动脉和腹腔动脉的情况确定是否行根治性切除[15-17]。
3.3 联合多脏器切除 进展的胰腺癌可能侵犯临近的脏器、结肠、胃、左侧肾上腺、小肠、左肾等,胰腺癌根治术要求全部或部分切除被侵犯的器官。2014年ISGPS 将胰腺癌联合多脏器切除纳入扩大根治术的标准[18]。
本研究结果显示,对于胰腺癌患者无论是动脉侵犯、静脉侵犯,还是胰腺外脏器的侵犯,只要可能切除,有必要在条件允许的情况下进行手术探查,根治性胰腺癌切除手术对提高生活质量和延长生存期均具有重要意义。
3.4 新辅助治疗与预后 目前,仍没有新辅助治疗对可切除的胰腺炎有效的证据[19]。对于侵犯静脉或侵犯临近脏器的BR-PDAC,如果能够确认可达到R0 切除,并不推荐新辅助治疗,IPSG推荐这两类患者先进行手术切除[14]。但是,目前仍有许多研究表明,新辅助治疗对胰腺癌有积极意义。新辅助治疗对胰腺癌的有利方面可能是新辅助治疗能对BRPDAC 患者手术效果进行筛选,可提高R0 切除术率和降低局部复发率[20-32]。对于不能切除的胰腺癌,应推荐新辅助治疗[14]。因此,新辅助治疗在胰腺癌治疗的研究中已成为热点,可能改变将来的治疗方式。
综上所述,胰腺癌是一种恶性程度较高的实体肿瘤,由于肿瘤的解剖位置特殊与生物学特性,会发生血管侵犯及淋巴结转移。对以往手术技术而言,手术切除率低,术后复发转移率高。随着胰腺外科的发展,术前的精准评估,血管外科技术在手术中的应用,明显提高了手术的切除率,患者生存期也有所延迟长。特别是近几年新辅助治疗在胰腺癌中的应用,给胰腺癌患者带来了曙光。总之,胰腺癌治疗应以手术为主进行多学科的综合治疗。
