铜绿假单胞菌重组酶聚合酶扩增检测方法研究
2024-06-23王晓庆贺燕袁凤君欧阳庆
王晓庆 贺燕 袁凤君 欧阳庆
摘 要:基于铜绿假单胞菌中高度保守的外毒素A基因设计特异性引物,建立并优化重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)条件,并评价该方法的灵敏度和抗干扰能力。结果显示,RPA反应体系能够在40 ℃等温条件下,20 min内实现对目标基因的扩增,检出铜绿假单胞菌的灵敏度为102 CFU·mL-1,抗干扰能力与GB 8538—2022相一致。经培养优化后,铜绿假单胞菌的最低检出限可达
10 CFU·mL-1,且重复性良好。本研究探索的铜绿假单胞菌RPA扩增检测方法操作简单、反应迅速、抗干扰能力强,为食品中铜绿假单胞菌的快速识别提供了新的方向与参考。
关键词:重组酶聚合酶扩增;铜绿假单胞菌;快速检测
Study on a Recombinase Polymerase Amplification Assay for Rapid Detection of Pseudomonas aeruginosa
WANG Xiaoqing1,2, HE Yan1,2*, YUAN Fengjun1,2, OUYANG Qing1,2
(1.Key Laboratory of Food Safety Monitoring and Early Warning of Hunan Province, Changsha 410117, China;
2.Hunan Institute of Commodity Quality Inspection, Changsha 410117, China)
Abstract: Based on the highly conserved exotoxin A gene in Pseudomonas aeruginosa, specific primers were designed to establish and optimize the amplification conditions of recombinase polymerase amplification (RPA), the sensitivity and anti-interference ability of the method were evaluated. The results showed that the RPA reaction system could achieve the amplification of the target gene within 20 minutes under the isothermal condition of 40 ℃, and the sensitivity of detecting Pseudomonas aeruginosa was 102 CFU·mL-1, and the anti-interference ability was consistent with GB 8538—2022. After culture optimization, the minimum detection limit of Pseudomonas aeruginosa could reach 10 CFU·mL-1, and the repeatability was good. The RPA amplification detection method of Pseudomonas aeruginosa established in this study has the advantages of simple operation, rapid response and strong anti-interference ability, which provides a new direction and reference for the rapid detection of Pseudomonas aeruginosa in food.
Keywords: recombinase polymerase amplification; Pseudomonas aeruginosa; rapid detection
近年来,随着现代化进程的加快,包装饮用水因其便利、不含杂质等优点,颇受消费者的青睐。随着消费量不断上升,桶装水中铜绿假单胞菌的检出率一直居高不下,成为食品安全和公共卫生的重要隐患[1],也成为消费者和诸多研究者们重点关注的问题。鉴于铜绿假单胞菌具有较大的危害性,加拿大、美国、巴西、欧洲各国及世界卫生组织等国家和国际组织对饮用水中铜绿假单胞菌含量进行了限定,限定标准为每250 mL不得检出[2]。我国也制定了《食品安全国家标准 包装饮用水》(GB 19298—2014),该标准对铜绿假单胞菌限量指标做了明确规定,并要求每批次成品出厂前进行铜绿假单胞菌检测,且每
250 mL样品中不得检出铜绿假单胞菌(采用二级取样方案,n=5,c=0,m=0,单位为CFU/250 mL)[3]。
一旦检出,则判定该产品为不合格。
检测铜绿假单胞菌的方法有多种,目前最常用的是国家标准方法,需要进行分离培养及后续的生化鉴定,操作时间长,过程相对复杂导致检测效率低。随着分子技术的迅猛发展,实时荧光PCR技术已被广泛应用于铜绿假单胞菌等食源性致病菌的检测[4]。但是,荧光PCR技术需要设施完善的实验室条件、精准控温的荧光PCR仪以及经验丰富的操作人员,很大程度上限制了该方法在现场及基层的应用。因此,如何快速、简便、有效检出铜绿假单胞菌越来越受到学者们的关注。
作为一种新型恒温核酸扩增技术,重组酶聚合酶核酸扩增(Recombinase Polymerase Amplification,RPA)反应模式与PCR相似,不同的是RPA不需要初始的加热变性步骤,而是利用重组酶形成引物复合物识别特异性位点,在37~42 ℃条件下,30 min内便可完成目的片段的特异性扩增。近年来,RPA技术由于其反应迅速、操作方便及设备要求低等明显优势,在医学诊断、动植物病原学以及食源性致病菌的分子检测领域得到了快速发展[5]。
1 材料与方法
1.1 材料与设备
1.1.1 实验菌株
铜绿假单胞菌(ATCC 27853)、荧光假单胞菌(ATCC 13525)、大肠埃希氏菌(AATCC 25922)标准菌株,均来源于美国菌种保藏中心。
1.1.2 仪器与试剂
HVA-85高压灭菌锅(日本平山Hirayama);MIR-254培养箱(日本三洋电机株式会社);EZ-Fit六联不锈钢过滤系统(默克密理博);CFX96 Touch荧光定量PCR仪(美国伯乐Bio-Rad)。
铜绿假单胞菌RPA恒温荧光检测试剂盒(安普未来生物科技有限公司);细菌基因组提取试剂盒(天根生化科技有限公司);0.45 ?m滤膜(美国Millipore公司);营养琼脂、脑心浸出液营养肉汤(Brain-Heart Infusion Broth,BHI)、胰蛋白胨大豆琼脂(Tryptone Soy Agar,TSA)、CN琼脂均购自北京陆桥技术有限责任公司,且在有效期内使用。
1.2 实验方法
1.2.1 细菌培养
将铜绿假单胞菌、荧光假单胞菌、大肠埃希氏菌等标准菌株从超低温冰箱中取出,划线接种至营养琼脂小斜面进行活化,(36±1)℃培养18~24 h。连续转接2代,恢复菌种活力。
挑取活化好的纯菌落接种于BHI培养基,(36±1)℃培养18~24 h。将培养的菌悬液取出后于3 000 r·min-1离心5 min,弃上清,加入相同体积的无菌生理盐水,振荡混匀,重复操作2次后,加入生理盐水,混匀即菌悬液。分别对菌悬液进行
10倍系列稀释,选取适宜稀释倍数的菌悬液1 mL加入无菌平皿中,每个浓度梯度3个平板,倾注TSA培养基,培养后计数,计算3块平板上菌落平均值,确定各菌悬液的菌浓度。
1.2.2 细菌基因组DNA的提取
使用细菌基因组提取试剂盒进行铜绿假单胞菌、荧光假单胞菌、大肠埃希氏菌标准菌株DNA的提取,按试剂盒说明书进行操作。提取获得的所有基因组置于-20 ℃冰箱中保存备用。
1.2.3 RPA恒温扩增检测方法
按照RPA实时荧光检测试剂盒说明书进行操作。根据待测样本、阴性对照、阳性对照的数量准备冻干粉,每个干粉反应管加入37.5 μL E buffer,待干粉完全溶解后,加入10 μL核酸模板,再加入2.5 μL B buffer(对于多个反应,可将B buffer加至反应管的盖子内侧),转移至扩增区。将反应管上下颠倒8~
10次使各组分充分混合,混匀后,将反应液快速离心至管子底部,反应管放入荧光检测设备中并记录样本放置顺序开始扩增。荧光检测程序:恒温39~
42 ℃,每30 s采集一次FAM通道荧光值,共40个循环。结果判定,阳性对照有典型“S”形扩增曲线,且Ct值≤35;阴性对照未检出,无Ct值,则实验成立,否则实验无效。在实验成立条件下,有明显扩增曲线且Ct值≤35,判断为阳性;若35<Ct≤40,则为可疑,复检后结果仍为35<Ct≤40且曲线呈“S”形,可判断为阳性,否则为阴性;未出现“S”形扩增曲线,无Ct值,判断为阴性。
1.2.4 RPA检测方法的灵敏度
以检出铜绿假单胞菌标准菌株最低浓度评价RPA反应的灵敏度。取经过计数的不同稀释度的菌悬液1 mL分别添加到250 mL桶装水样中(样品预先按照GB 8538—2022检测,未检出铜绿假单胞菌),用拍击式均质器连续均质1~2 min混匀,用孔径为0.45 ?m的滤膜过滤,将滤膜转移至CN平板上(36±1)℃培养48 h,观察计数。同时另取1 mL样品稀释液按1.2.2提取基因组作为DNA模板,进行RPA扩增反应。
1.2.5 RPA检测方法的准确度
RPA检测方法的准确度可以理解为该方法检测目标微生物的抗干扰能力。在GB 8538—2022和RPA技术最低检出限基础上分别按1倍、2倍、
10倍、100倍浓度添加荧光假单胞菌、大肠埃希氏菌菌悬液以及荧光假单胞菌和大肠埃希氏菌混合菌悬液,充分混合,按国家标准方法和提取基因组模板进行RPA检测,比较两种方法的抗干扰能力,评价RPA检测方法的准确度。
1.2.6 RPA检测方法的优化
在RPA方法最低检出限基础上,将102 CFU·mL-1
铜绿假单胞菌菌悬液分别进行2倍、5倍、10倍、100倍稀释,培养6 h后取菌悬液提取基因组进行RPA扩增检测。探讨菌浓度与培养时间的相关规律,优化检测方法。
2 结果与分析
2.1 菌悬液浓度
如图1所示,过夜培养的菌悬液经平板计数,计算获得铜绿假单胞菌、荧光假单胞菌的浓度、大肠埃希氏菌的浓度分别为3×108 CFU·mL-1、4×108 CFU·mL-1、3×109 CFU·mL-1。
2.2 RPA检测方法的灵敏度
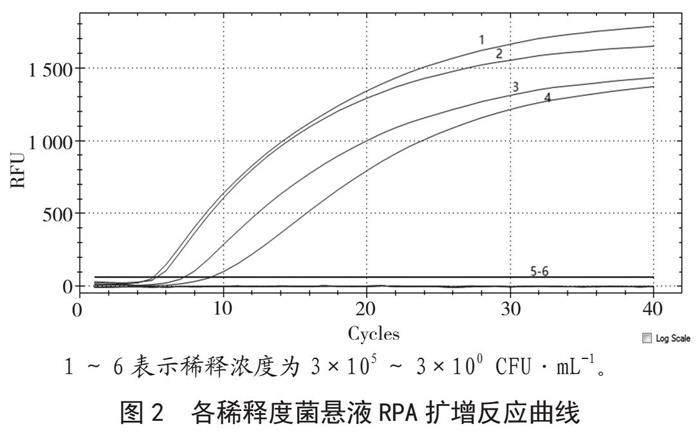
分别取不同浓度的铜绿假单胞菌菌悬液提取基因组作为模板,进行RPA扩增检测。RPA扩增反应结果如图2所示,当浓度≥102 CFU·mL-1时,可得到单一扩增曲线且Ct值<35,而当菌悬液浓度<102 CFU·mL-1时,未出现S型扩增曲线,无Ct值,表明该方法检测铜绿假单胞菌的最低检出限为102 CFU·mL-1。重复检测3次均取得一致性结果。
1~6表示稀释浓度为3×105~3×100 CFU·mL-1。
图2 各稀释度菌悬液RPA扩增反应曲线
2.3 RPA检测方法的准确度
荧光假单胞菌、大肠埃希氏菌是常见的与铜绿假单胞菌同时存在于水体中的微生物,本实验在
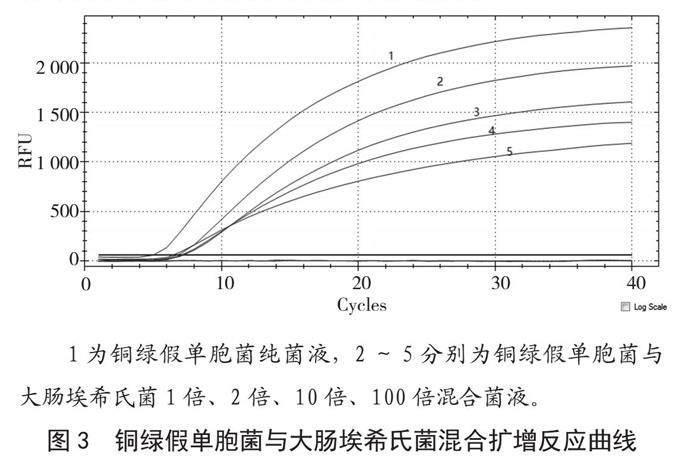
102 CFU·mL-1铜绿假单胞菌菌悬液中按1倍、2倍、10倍、100倍浓度分别添加荧光假单胞菌、大肠埃希氏菌菌悬液、荧光假单胞菌和大肠埃希氏菌混合菌悬液,然后按照GB 8538—2022进行常规检测和提取基因组进行RPA扩增反应,结果见图3、图4、图5。从扩增结果中可以清晰地看出,改变菌种添加种类及比例的混合菌悬液经RPA扩增反应后,均可得到特异性的单一扩增曲线,且Ct值<35,重复检测3次均取得一致性结果,表明该方法与传统国家标准方法同样具有很好的抗干扰能力。
1为铜绿假单胞菌纯菌液,2~5分别为铜绿假单胞菌与大肠埃希氏菌1倍、2倍、10倍、100倍混合菌液。
图3 铜绿假单胞菌与大肠埃希氏菌混合扩增反应曲线
2.4 RPA检测方法的优化
将最低检出限的铜绿假单胞菌菌悬液分别进行
2倍、5倍、10倍、100倍稀释,培养6 h后进行RPA扩增检测。扩增结果表明,最低检出限的铜绿假单胞菌菌悬液经2倍、5倍、10倍稀释液后培养
6 h,通过RPA方法进行检测可获得单一扩增曲线,且Ct值<35(图6),重复检测3次均取得一致性结果。由此可以看出,经过一定时间培养使目标微生物增殖,可提高RPA扩增方法的灵敏度。
1为铜绿假单胞菌纯菌液,2~5分别为铜绿假单胞菌与荧光假单胞菌1倍、2倍、10倍、100倍混合菌液。
图4 铜绿假单胞菌与荧光假单胞菌混合扩增反应曲线
1为铜绿假单胞菌纯菌液,2~5分别为铜绿假单胞菌与大肠埃希氏菌、荧光假单胞菌1倍、2倍、10倍、100倍混合菌液。
图5 铜绿假单胞菌与大肠埃希氏菌、荧光假单胞菌混合扩增反应曲线
1~4分别为102 CFU·mL-1铜绿假单胞菌2倍、5倍、10倍、100倍稀释培养。
图6 不同稀释倍数菌悬液培养后RPA扩增反应曲线
3 结论与讨论
铜绿假单胞菌生存能力强、适应力强、分布范围广、对营养需求低,可通过气溶胶或水流进行传播,对公众健康存在很大的安全隐患。近年来,成品水中铜绿假单胞菌检出的现象时有发生。因此,如何快速识别水中铜绿假单胞菌污染情况,对保障公众饮水安全尤为重要。RPA扩增技术作为一门新型分子检测技术,目前不仅在医学诊断和动植物疫病防御方面应用较多,也逐步延伸至食源性致病菌检测方面[6]。本研究根据铜绿假单胞菌保守序列设计引物探针,初步建立了铜绿假单胞菌特异性快速检测的RPA方法,该方法能够在40 ℃等温条件下,
20 min内实现对目标基因组的扩增且具有良好的灵敏性和特异性。与ANUJ等[7]建立的real-time PCR法灵敏性一致。
总之,本研究建立的RPA检测方法特异性强、灵敏性高、操作简便、反应高效,不需要装备完善的实验室设备条件,可实现现场检测,为生产企业出厂检验和食品监管部门提供了一种快速准确筛查铜绿假单胞菌的有效工具,更为人们饮水安全提供了有效保障。
参考文献
[1]张淑红,吴清平,徐晓可,等.桶装水中铜绿假单胞菌检测方法的比较[J].现代食品科技,2011,27(11):1403-1405.
[2]王娟,颜瑛,罗玉彬,等.江西省矿泉水和包装饮用水中铜绿假单胞菌污染情况分析[J].中国卫生检验杂志,2017,27(3):419-421.
[3]张晓丽.(瓶)桶装饮用水中铜绿假单胞菌污染情况分析[J].低碳世界,2017(22):18-19.
[4]张淑红,吴清平,徐晓可,等.桶装水中铜绿假单胞菌检测方法的比较[J].现代食品科技,2011,27(11):
1403-1405.
[5]施奕,徐昌平,余蓓蓓,等.重组酶聚合酶扩增技术研究进展[J].病毒学报,2020,36(3):522-532.
[6]周鹤,张国利,傅志丰,等.桶装水铜绿假单胞菌污染原因及检测方法[J].检验检疫学刊,2019,29(6):135-137.
[7]ANUJ S N,WHILEY D M,KIDD T J,et al.Identification of Pseudomonas aeruginosa by a duplex real-time polymerase chain reaction assay targeting the ecfX and the gyrB genes[J].Diagn Microbiol Infect Dis,2009,63(2):127-131.
