白蛋白结合型紫杉醇联合卡铂一线治疗晚期非小细胞肺癌的临床研究
2024-06-21艾鹏胜
艾鹏胜


【摘要】 目的 观察白蛋白结合型紫杉醇(nab-paclitaxel,Nab-P)联合卡铂一线治疗晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的疗效及淋巴细胞亚群的变化。方法 选取武平县医院收治的120例晚期NSCLC患者,按照随机数字表法分为对照组和试验组,各60例。对照组采用吉西他滨联合卡铂方案治疗,试验组采用Nab-P联合卡铂方案治疗。比较2组化疗前后血清鳞状细胞癌相关抗原(squamous cell carcinoma antigen,SCC)、细胞角蛋白19片段抗原21-1(cytokeratin fragment antigen 21-1,CYFRA21-1)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、T细胞亚群、临床疗效、化疗期间不良反应、无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)情况。结果 化疗后,试验组血清SCC、CYFRA21-1、TGF-β1和CD8+水平均低于对照组(P<0.05),血清CD3+、CD4+、CD4+/CD8+水平均高于对照组(P<0.05)。试验组客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)均高于对照组,PFS、OS长于对照组(P<0.05)。试验组血小板减少、粒细胞减少、肌肉/关节痛发生率低于对照组(P<0.05)。结论 Nab-P联合卡铂一线治疗晚期NSCLC疗效显著,可降低血清肿瘤标志物水平,对免疫系统影响小,且不良反应少。
【关键词】 卡铂;白蛋白结合型紫杉醇;非小细胞肺癌;淋巴细胞亚群
文章编号:1672-1721(2024)16-0016-04 文献标志码:A 中国图书分类号:R734.2
NSCLC是肺癌的常见类型,其发生率远高于其他类型肺癌[1]。近年来,尽管NSCLC临床治疗已取得较大进步,但晚期NSCLC患者病死率仍居高不下。化疗可抑制癌症进展,延长患者生命,目前已成为晚期无驱动基因突变NSCLC的主要疗法。其中,双药含铂方案是治疗晚期NSCLC的标准疗法[2]。杀灭肿瘤细胞,解除免疫功能抑制并纠正其紊乱状态,有助于改善患者预后。本研究将吉西他滨与Nab-P分别联合卡铂一线化疗方案应用于晚期NSCLC的临床治疗,比较其疗效,并探究对淋巴细胞亚群的影响。
1 资料与方法
1.1 一般资料
选取武平县医院于2015年1月—2020年12月收治的120例晚期NSCLC患者,按照随机数字表法分为对照组和试验组,各60例。对照组中男性36例,女性24例;年龄46~71岁,平均(58.66±6.04)岁;鳞癌57例,腺癌3例;卡氏评分70~89分,平均(76.89±5.13)分。试验组中男性40例,女性20例;年龄45~70岁,平均(58.42±6.13)岁;鳞癌55例,腺癌5例;卡氏评分70~90分,平均(76.84±5.10)分。2组一般资料比较,差异无统计学意义(P>0.05),具可比性。本研究经医院医学伦理委员会批准[批号:院字(2014)10号],患者及其家属知情并签署知情同意书。
纳入标准:经细胞学、组织学和影像学检查诊断为晚期NSCLC;肿瘤分期Ⅳ期;卡氏评分≥70分;预期生存期>6个月;一线初治者;病灶可测量或评价;有化疗适应证。
排除标准:合并其他癌症者;有放化疗史者;其他方式治疗者;合并重症内科疾病者;肝肾功能异常者;骨髓造血功能异常者;依从性差者。
1.2 方法
对照组采用吉西他滨联合卡铂方案治疗。吉西他滨1 000 mg/m2,第1天、第8天;卡铂ACU4-5,第1天。3周为1周期,共8周期。
试验组采用Nab-P联合卡铂方案治疗。卡铂同对照组。Nab-P 260 mg/m2,第1天,或130 mg/m2,第1天、第8天。3周为1周期,共8周期。
1.3 观察指标
(1)比较第1周期化疗前(以下称化疗前)及第8周期化疗结束后(以下称化疗后)2组SCC、CYFRA21-1、TGF-β1水平。(2)比较化疗前后2组血清T细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+水平。(3)观察2组化疗后的临床疗效。疗效评价标准参考实体瘤疗效评价标准(mRECIST)[3],包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。其中,CR为靶病灶完全消失,且无新病灶出现,维持4周及以上;PR为靶病灶的最大径总和减少30%及以上,维持4周及以上;SD为靶病灶的最大径总和减少未达30%或增加未达20%;PD为有新病灶出现,或靶病灶的最大径总和增加20%及以上。ORR=CR率+PR率,DCR=CR率+PR率+SD率。(4)观察2组化疗期间不良反应发生情况,按照CTCAE V5.0[4]评价。(5)随访1年,观察2组PFS和OS情况。
1.4 统计学方法
用SPSS 19.0统计学软件分析数据,计量资料以x±s表示,采用t检验,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清肿瘤标志物水平
化疗前,2组血清肿瘤标志物水平比较,差异无统计学意义(P>0.05);化疗后,2组血清SCC、CYFRA21-1、TGF-β1水平均较化疗前降低,且试验组均低于对照组(P<0.05),见表1。
2.2 血清T细胞亚群水平
化疗前,2组血清T细胞亚群水平比较,差异无统计学意义(P>0.05);化疗后,2组血清CD3+、CD4+、CD4+/CD8+水平均较化疗前升高,CD8+水平均较化疗前降低,且试验组均优于对照组(P<0.05),见表2。
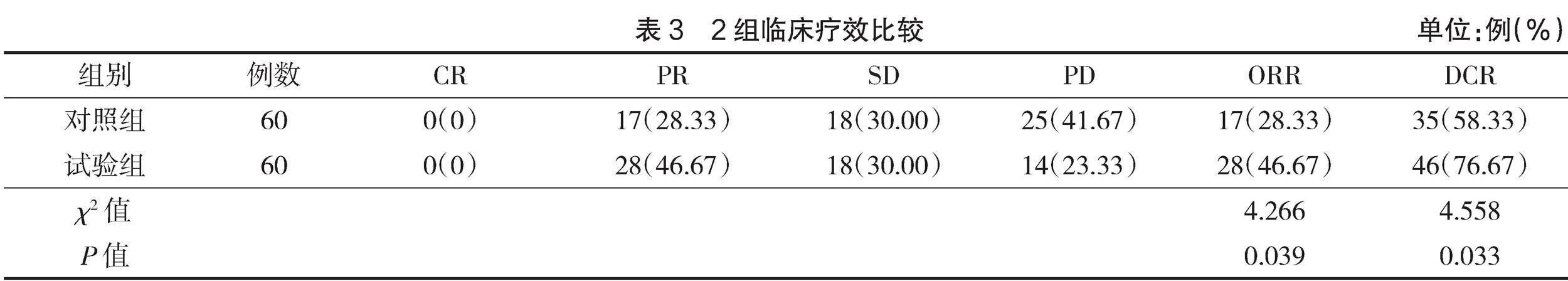
2.3 临床疗效
试验组ORR率、DCR率均高于对照组(P<0.05),见表3。
2.4 不良反应
试验组血小板减少、粒细胞减少、肌肉/关节痛发生率均低于对照组(P<0.05);2组恶心呕吐发生率比较,差异无统计学意义(P>0.05),见表4。
2.5 PFS和OS
试验组PFS[(5.02±0.54)个月]长于对照组[(4.71±0.49)个月](t=3.2931,P<0.05);试验组OS[(11.02±0.17)个月]长于对照组[(10.89±0.14)个月](t=4.5724,P<0.05)。
3 讨论
NSCLC是一类发病率较高的肺部恶性肿瘤。NSCLC患者发病早期常无典型症状,经影像学或病理检查等确诊时患者病情多处于较严重的阶段,如进展至晚期。目前,晚期NSCLC患者多采用化疗、免疫治疗等控制疾病进展,其中以铂类药物为基础的双药化疗方案是晚期无驱动基因突变NSCLC一线治疗方案[5]。吉西他滨可通过抑制核糖核苷酸还原降低脱氧核苷酸水平,从而抑制DNA的修复及合成[6]。卡铂具有细胞毒作用,可促进DNA裂解,抑制DNA合成。与顺铂相比,卡铂的不良反应显著减弱[7]。紫杉醇可通过抑制微管蛋白解聚、诱导微管蛋白聚合提高微管蛋白的稳定性,通过干预有丝分裂等进程发挥抗癌作用[8]。Nab-P治疗是将紫杉醇经内皮细胞转移至肿瘤细胞中,充分发挥紫杉醇抑制肿瘤细胞增殖的作用[9]。紫杉醇可精准进入肿瘤细胞,其细胞毒性对正常细胞影响较小,不良反应显著减少。有研究证明,Nab-P治疗晚期NSCLC疗效明显高于普通紫杉醇,不良反应也显著减少。本研究中,试验组血小板减少、粒细胞减少、肌肉/关节痛发生率均低于对照组(P<0.05);2组恶心呕吐发生率比较,差异无统计学意义(P>0.05),说明试验组化疗方案不良反应更小。
SCC可经趋化血管内皮细胞诱导形成肿瘤新生血管,促进肿瘤生长及转移。CYFRA21-1多存在于肺上皮细胞中。发生癌变后,肺上皮细胞大量破裂,CYFRA21-1被释放入血,导致血清CYFRA21-1水平大幅升高[10]。TGF-β1可通过调节NSCLC细胞上皮间质转化,诱导肿瘤细胞浸润和转移。周泽军等[11]以Nab-P为主治疗晚期NSCLC获得了较好的疗效,且不良反应均可控制。本研究中化疗后,试验组血清SCC、CYFRA21-1、TGF-β1水平均低于对照组,ORR率、DCR率均高于对照组,PFS、OS长于对照组(P<0.05),说明试验组化疗方案较对照组化疗方案降低血清肿瘤标志物水平的效率更高,疗效更好,有助于延长患者生存时间。
细胞免疫抗癌的核心是淋巴细胞浸润,而T淋巴细胞亚群是免疫应答的主要形式。CD3+分布于T淋巴细胞的表面,代表T淋巴细胞总量。CD4+可通过产生细胞因子正向增强细胞免疫,又可诱导B细胞增殖,促进抗体生成,与体液免疫协同发挥抗癌作用。CD8+可对抗原递呈细胞发挥细胞毒性,又可分泌细胞因子,抑制CD4+细胞表达,抑制机体免疫[12]。肿瘤细胞可诱导分泌免疫抑制因子,抑制正向免疫细胞增殖,促进负向免疫细胞生成,致使机体免疫功能紊乱,为肿瘤细胞增殖及免疫逃逸奠定了基础。本研究中,化疗后,试验组血清CD3+、CD4+、CD4+/CD8+水平均高于对照组,CD8+水平低于对照组,说明试验组化疗方案更有助于纠正患者机体免疫紊乱,改善T淋巴细胞水平,对肿瘤细胞具有更强的清除能力,且不良反应较少,对免疫系统影响较小,有助于T淋巴细胞恢复。
Nab-P联合卡铂一线治疗晚期NSCLC疗效较为显著,具有更强的杀灭肿瘤细胞、降低血清肿瘤标志物水平的作用,且不良反应少,对免疫系统影响小,有助于T淋巴细胞亚群恢复。
参考文献
[1] 黄亚,张西志.非小细胞肺癌综合治疗中的放疗联合免疫治疗[J].实用临床医药杂志,2019,23(14):7-11.
[2] 李玮,杨永丽,胡佳佳,等.参芪扶正注射液联合含铂双药化疗治疗晚期非小细胞肺癌的疗效评价[J].中国医院药学杂志,2022,42(3):299-303.
[3] EISENHAUER E A,THERASSE P,BOGAERTS J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[4] FREITES-MARTINEZ A,SANTANA N,ARIAS-SANTIAGO S,et al.Using the common terminology criteria for adverse events(CTCAE-Version 5.0)to evaluate the severity of adverse events of anticancer therapies[J].Actas Dermosifiliogr(Engl Ed),2021,112(1):90-92.
[5] 程少先,谭诗云,徐文礼.重组人血管内皮抑素联合奈达铂治疗非小细胞肺癌合并恶性胸腔积液的临床疗效分析[J].实用临床医药杂志,2019,23(13):56-59.
[6] 杨姣,陈松.吉非替尼联合吉西他滨和顺铂治疗晚期非小细胞肺癌的临床疗效[J].实用临床医药杂志,2020,24(19):63-66.
[7] 陈维英,净卫娟,辛玉珍,等.帕博利珠单抗联合卡铂、白蛋白紫杉醇治疗晚期非小细胞肺癌的疗效及安全性[J].山东医药,2021,61(13):65-68.
[8] 谷志彬,刘玲莉.中西医结合治疗晚期非小细胞肺癌患者的效果[J].实用临床医药杂志,2019,23(9):13-15,19.
[9] 杨科,李峻岭,杜斌,等.白蛋白结合型紫杉醇二线及以上治疗晚期非小细胞肺癌的单臂、单中心探索性临床研究[J].中国临床药理学与治疗学,2019,24(11):1281-1286.
[10] 刘亚杰,马晓波.肿瘤标志物GSTP1、CYFRA21-1及SCC-Ag对非小细胞肺癌的预后评估价值[J].中国现代医学杂志,2020,30(14):42-46.
[11] 周泽军,谢海燕,侯志波,等.白蛋白结合型紫杉醇治疗晚期非小细胞肺癌的疗效及安全性[J].江苏医药,2021,47(11):1169-1173.
[12] 李兴,马丽娜,李迅,等.PD-1抑制剂治疗晚期肺癌的疗效及对患者外周血T淋巴细胞亚群和细胞因子水平的影响[J].中国肿瘤生物治疗杂志,2021,28(11):1113-1118.
