ARK5蛋白在上皮性卵巢癌细胞卡铂耐药中的作用
2018-01-05潘洁雪林凤
潘洁雪,林凤
(温州医科大学附属第一医院,浙江 温州 325015,1.生殖医学中心;2.妇科)
ARK5蛋白在上皮性卵巢癌细胞卡铂耐药中的作用
潘洁雪1,林凤2
(温州医科大学附属第一医院,浙江 温州 325015,1.生殖医学中心;2.妇科)
目的:探索上皮性卵巢癌细胞卡铂耐药的机制,以提高卵巢癌患者化疗的疗效。方法:应用CCK8法检测卡铂处理后的上皮性卵巢癌细胞增殖,Western blot法检测上皮间质化转变相关蛋白E-Cadherin和Vimentin表达情况,流式细胞技术检测细胞表面CD133的变化情况,使用siRNA敲降AMP激活的蛋白激酶家族成员5(ARK5)后再观察卡铂的作用。结果:上皮性卵巢癌细胞系SKOV3与A2780的卡铂IC50分别为2.824 µg/mL与1.760 µg/mL,并且卡铂能诱导上皮性卵巢癌细胞发生上皮间质化转变;卡铂诱导ARK5显著上调,而不影响SNF1/AMP激活的蛋白激酶表达,敲降ARK5基因能显著减弱卡铂诱导卵巢癌细胞产生上皮间质化转变的效果。结论:ARK5在上皮性卵巢癌细胞卡铂耐药机制中具有重要作用,降低ARK5的表达可以减弱卡铂诱导卵巢癌细胞上皮间质化转变的作用。
上皮性卵巢癌;上皮间质化转变;卡铂;ARK5
上皮性卵巢癌在女性生殖系统恶性肿瘤死亡原因中居第一位[1],化疗耐药是卵巢癌患者预后较差的重要原因之一[2]。以铂类为基础的化疗方案是上皮性卵巢癌的一线治疗方案[2-3],但对大部分的进展期上皮性卵巢癌效果较差,导致疾病进展较快。AMP激活的蛋白激酶家族成员5(AMP-activated protein kinase family member 5,ARK5)是一个新型的AMP依赖的蛋白激酶。研究显示ARK5促进肿瘤细胞生长[4-5],在肿瘤中高度表达,并与肿瘤患者预后较差相关[6-9],但在卵巢癌中,尚未见ARK5相关的报道。本研究分析卡铂耐药与ARK5的关系,为减少卵巢癌患者耐药提供依据。
1 材料和方法
1.1 细胞培养 人上皮性卵巢癌细胞株A2780和SKOV3购自中国科学院上海生物科学研究院。使用美国Gbico公司的RPMI-1640培养基,添加10%胎牛血清、1%青霉素/链霉素以及2 mmol/L的谷氨酰胺。细胞在37 ℃和5% CO2条件下正常培养。
1.2 细胞活性检测 使用日本Dojindo公司的CCK8试剂盒检测细胞活性。将细胞接种在96孔培养板后,待细胞贴壁,分别加入指定浓度(分别为0、0.25、0.5、1、2、4、8、16、32 μg/mL)的卡铂,并继续培养48 h,加入CCK8试剂,并于490 nm处测OD值。
1.3 Real-time PCR检测细胞SNF1/AMP激活的蛋白激酶(SNF1/AMP activated protein kinase,SNARK)与ARK5的表达 将A2780和SKOV3细胞系分为对照组与卡铂处理组,分别提取A2780和SKOV3细胞总RNA,采用SYBR Premix Ex Taq Kit(日本Takara公司)进行Real-time PCR测定。该方法是将目的基因与内参基因的Ct值比较(△Ct)后,再将实验组与对照组进行比较(△△Ct)。
1.4 Western blot检测E-Cadherin、Vimentin、SNARK与ARK5蛋白水平 将细胞分为4组:对照组、卡铂处理组、卡铂+ARK5 siRNA转染组、ARK5 siRNA组。各组分别处理好细胞,裂解细胞,提取总蛋白。使用SDS-聚丙烯酰胺凝胶电泳,使蛋白分离,随后采用湿转法,将蛋白转到PVDF膜。之后用10%脱脂奶粉封闭,洗过之后,用E-Cadherin(1∶1 000,美国CST公司)、Vimentin(1∶1 000,美国CST公司)、SNARK(1∶1 000,美国Abcam公司)、ARK5(1∶1 000,美国Abcam公司)与GAPDH(1∶2 000,美国CST公司)一抗封闭缓冲液,4 ℃过夜。取出膜,使用TBST液洗涤3次,每次5 min。再使用相应的二抗缓冲液4 ℃孵育2 h。清洗结束,化学发光法检测印迹。使用Quantity One软件进行条带灰度定量(目的蛋白/GAPDH)。
1.5 免疫荧光检测E-Cadherin、Vimentin的水平取待检测的卵巢癌细胞置于盖玻片上,4%多聚甲醛固定15 min,0.5% TritonX-100/PBS室温通透30 min,5% BSA/PBS 37 ℃封闭1 h,再将一抗E-Cadherin(1∶300)与Vimentin(1∶300)溶于5%BSA/PBS中,均匀覆盖在细胞上,4 ℃孵育过夜。将相应荧光二抗抗体(1∶2 000)溶于5% BSA/PBS中,均匀覆盖在细胞上,室温避光孵育1 h。PBS洗涤,DAPI溶液均匀覆盖在细胞上,室温避光孵育5 min。荧光显微镜观察拍照。
1.6 流式细胞术检测CD133 将对照组与实验组(卡铂处理)细胞收集后,使用PBS清洗,重悬于适量的PBS中,加入PE标记的CD133(美国Biolegend公司)抗体1 μL,4 ℃避光孵育30 min。PBS清洗3遍后流式细胞仪检测CD133水平。
1.7 统计学处理方法 流式细胞学分析采用Flowjo 7.2软件,其余数据采用GraphPad Prism 6软件分析。两组间比较采用两独立样本t检验,多组间比较采用方差分析。p<0.05为差异有统计学意义。
2 结果
2.1 卡铂诱导上皮性卵巢癌细胞系发生上皮间质化转变 CCK8法检测结果显示,SKOV3与A2780细胞系的卡铂IC50分别为2.824 μg/mL与1.760 μg/mL,ARK5在SKOV3细胞系表达比在A2780高(0.86±0.04 vs. 0.66±0.07,p<0.05),见图1。进一步研究卵巢癌细胞系SKOV3与A2780在卡铂作用下上皮间质化转变相关蛋白的表达情况,发现在卡铂作用下E-Cadherin显著下调,而Vimentin显著上调(见表1),并且卡铂能诱导卵巢癌细胞的CD133比例明显上调(见图2)。
2.2 卡铂作用后ARK5显著上调 为进一步探索卡铂诱导上皮性卵巢癌细胞上皮间质化转变形成的机制,PCR法检测了ARK5与SNARK的表达,发现在卡铂的作用下ARK5发生了显著上调,SNARK无明显变化(见表2),进一步检测ARK5蛋白表达的水平,同样发现ARK5显著上调,而SNARK无明显变化(见表3)。
2.3 敲降ARK5能抑制卡铂诱导的卵巢癌细胞系的上皮间质化转变作用 使用ARK5 siRNA敲降ARK5在上皮性卵巢癌细胞中的表达,并与卡铂一起作用,发现在将卡铂与ARK5 siRNA一起作用时,其诱导卵巢癌细胞系形成上皮间质化转变的作用被削弱,Vimentin表达较卡铂单独作用显著下降,ECadherin则显著上调(见表4),使用免疫荧光方法观测到相同的现象(见图3),因此我们推测,卡铂诱导上皮性卵巢癌细胞系形成上皮间质化转变的作用有可能是通过ARK5这条通路。
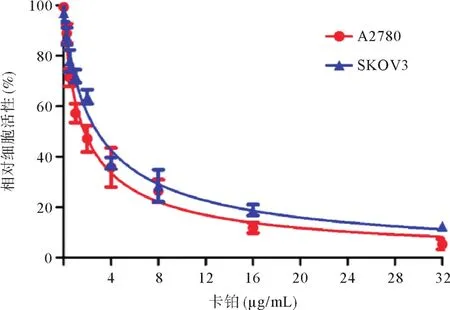
图1 上皮性卵巢癌细胞系(SKOV3与A2780)在卡铂作用后的细胞增殖变化
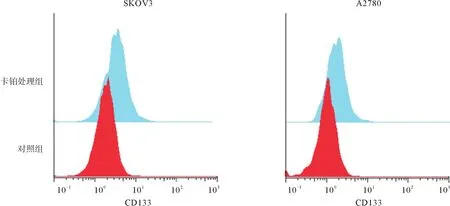
图2 上皮性卵巢癌细胞系(SKOV3与A2780)在卡铂作用后的CD133的比例变化
表1 SKOV3与A2780细胞系在卡铂处理后的蛋白表达(n=3,
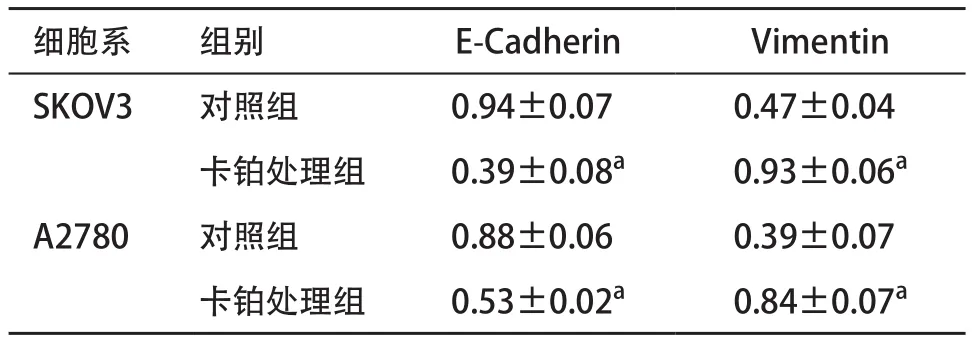
表1 SKOV3与A2780细胞系在卡铂处理后的蛋白表达(n=3,
与对照组比:aP<0.05
细胞系 组别 E-Cadherin Vimentin SKOV3 对照组 0.94±0.07 0.47±0.04卡铂处理组 0.39±0.08a 0.93±0.06a A2780 对照组 0.88±0.06 0.39±0.07卡铂处理组 0.53±0.02a 0.84±0.07a
表2 SNARK与ARK5在SKOV3与A2780细胞系卡铂处理后的mRNA表达(n=3,
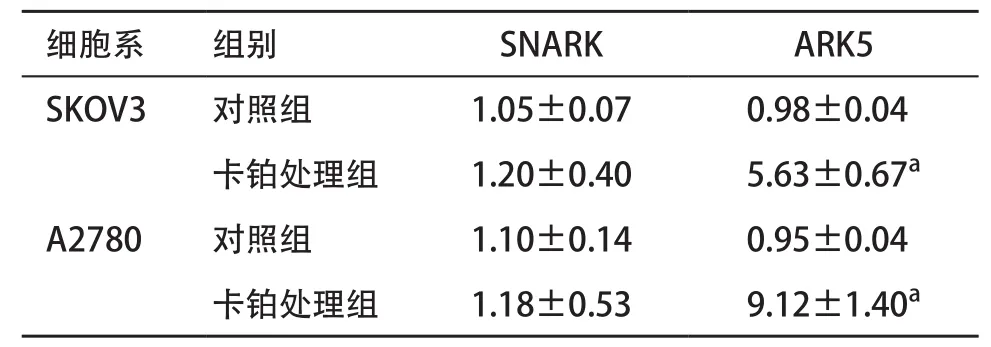
表2 SNARK与ARK5在SKOV3与A2780细胞系卡铂处理后的mRNA表达(n=3,
与对照组比:aP<0.05
细胞系 组别 SNARK ARK5 SKOV3 对照组 1.05±0.07 0.98±0.04卡铂处理组 1.20±0.40 5.63±0.67a A2780 对照组 1.10±0.14 0.95±0.04卡铂处理组 1.18±0.53 9.12±1.40a
表3 SNARK与ARK5在SKOV3与A2780细胞系卡铂处理后的蛋白表达(n=3,)
与对照组比:aP<0.05
细胞系 组别 SNARK ARK5 SKOV3 对照组 0.84±0.07 0.32±0.02卡铂处理组 0.83±0.09 0.87±0.01a A2780 对照组 0.72±0.07 0.23±0.10卡铂处理组 0.75±0.07 0.89±0.16a
3 讨论
卵巢癌患者的早期症状并不明显,大部分患者多因腹胀不适就诊,导致60%~70%的卵巢癌患者发现时即处于3期或者4期[10]。因此,卵巢癌患者的总体5年生存率不到50%,进展期的卵巢癌患者更低,只有不到25%[11]。 因此,解决卵巢癌的卡铂耐药,是进一步提高卵巢癌患者生存期的当务之急。有研究表明ARK5能促进卵巢癌细胞发生上皮间质化转变[9],而上皮间质化转变在卵巢癌患者的卡铂耐药中占有重要地位[12],因此ARK5与卵巢癌细胞卡铂耐药可能相关。
表4 SNARK与ARK5在SKOV3与A2780细胞系卡铂处理后的蛋白表达(n=3,)
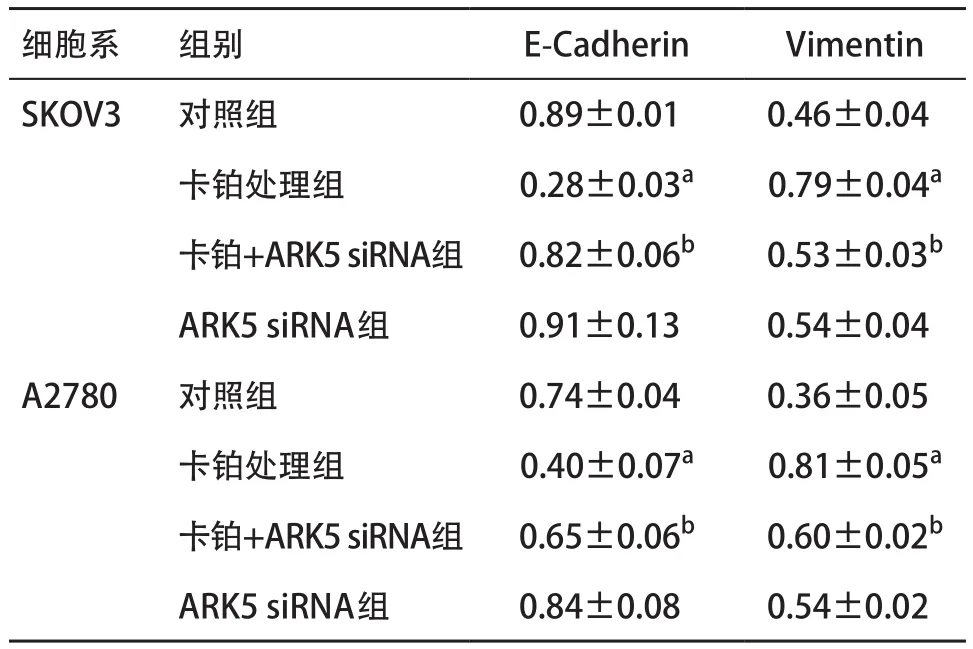
表4 SNARK与ARK5在SKOV3与A2780细胞系卡铂处理后的蛋白表达(n=3,)
与对照组比:aP<0.05;与卡铂处理组比:bP<0.05
细胞系 组别 E-Cadherin Vimentin SKOV3 对照组 0.89±0.01 0.46±0.04卡铂处理组 0.28±0.03a 0.79±0.04a卡铂+ARK5 siRNA组 0.82±0.06b 0.53±0.03b ARK5 siRNA组 0.91±0.13 0.54±0.04 A2780 对照组 0.74±0.04 0.36±0.05卡铂处理组 0.40±0.07a 0.81±0.05a卡铂+ARK5 siRNA组 0.65±0.06b 0.60±0.02b ARK5 siRNA组 0.84±0.08 0.54±0.02
上皮间质化转变在很多肿瘤的耐药中起重要作用[13-14]。在上皮间质化转变过程中,上皮细胞会转向为活跃的、侵袭的间质性细胞,失去上皮的标记如E-Cadherin,而间质的标记Vimentin会增强[15];另一方面上皮间质化转变会增强肿瘤细胞的干性,如CD133的表达上调,进而使这部分细胞具有更强的侵袭与转移的能力[16],并对肿瘤药物具有更明显的耐药。有报道显示,上皮间质化转变在肝癌中与肝癌多柔比星耐药相关[17]。本研究发现卡铂能显著诱导卵巢癌细胞系E-Cadherin表达下调,Vimentin表达上调,并且诱导卵巢癌细胞干性标志CD133表达比例上调,说明卵巢癌细胞系在卡铂作用下发生上皮间质化转变,并增强其干性,进而促进肿瘤细胞耐药。
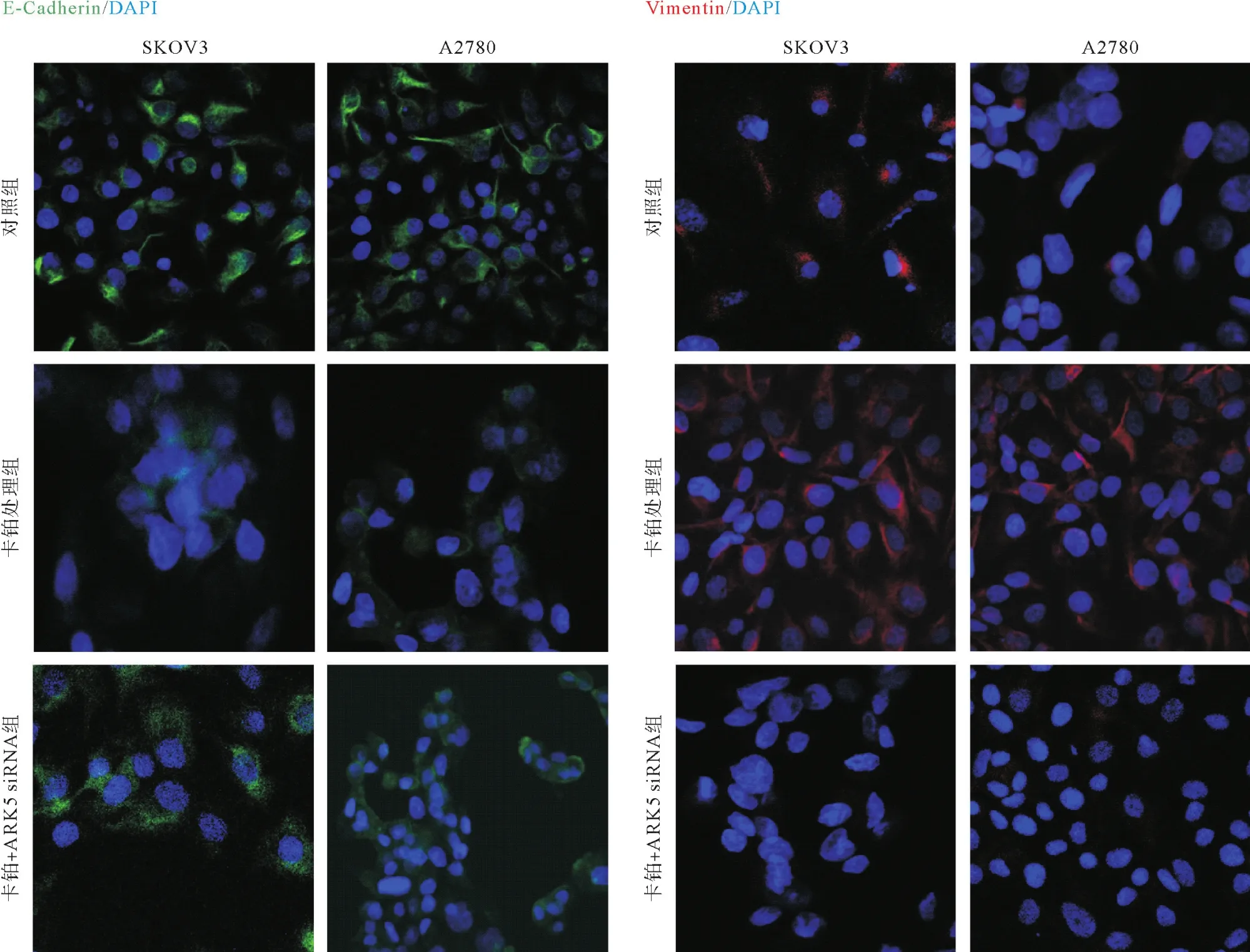
图3 免疫荧光法观察Vimentin与E-Cadherin的表达(×200)
铂类药物的耐药机制十分复杂,主要涉及PI3KAKT、Hippo与MAPK通路的异常,ARK5可以通过抑制caspase-8与caspase-6相关的FasL/Fas的活化,从而抑制肿瘤细胞死亡。本研究还发现卡铂诱导ARK5显著上调,而与ARK5同属于NUAK家族,且与ARK5具有55.0%作用同源性[18]的SNARK蛋白表达并没有上调,并且当敲减ARK5的表达时,卡铂引起上皮间质化转变的作用被减弱。因此,我们认为卡铂可能是通过ARK5这条通路引起上皮性卵巢癌细胞上皮间质化转变,进而引起卵巢癌细胞耐药。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics,2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30.
[2] ADAMS G, ZEKRI J, WONG H, et al. Platinum-based adjuvant chemotherapy for early-stage epithelial ovarian cancer: single or combination chemotherapy?[J]. BJOG, 2010,117(12): 1459-1467.
[3] KWON J S, MCGAHAN C, DEHAECK U, et al. The signif i cance of combination chemotherapy in epithelial ovarian cancer[J]. Int J Gynecol Cancer, 2014, 24(2): 226-232.
[4] SUZUKI A, KUSAKAI G, KISHIMOTO A, et al. Identif i cation of a novel protein kinase mediating Akt survival signaling to the ATM protein[J]. J Biol Chem, 2003, 278(1): 48-53.
[5] SUZUKI A, KUSAKAI G, KISHIMOTO A, et al. ARK5 suppresses the cell death induced by nutrient starvation and death receptors via inhibition of caspase 8 activation, but not by chemotherapeutic agents or UV irradiation[J]. Oncogene,2003, 22(40): 6177-6182.
[6] CHANG X Z, YU J, LIU H Y, et al. ARK5 is associated with the invasive and metastatic potential of human breast cancer cells[J]. J Cancer Res Clin Oncol, 2012, 138(2): 247-254.
[7] CUI J, YU Y, LU G F, et al. Overexpression of ARK5 is associated with poor prognosis in hepatocellular carcinoma[J].Tumour Biol, 2013, 34(3): 1913-1918.
[8] PHIPPEN N T, BATEMAN N W, WANG G, et al. NUAK1(ARK5) is associated with poor prognosis in vvarian cancer[J]. Front Oncol, 2016, 6, 213.
[9] ZHANG H Y, LI J H, LI G, et al. Activation of ARK5/miR-1181/HOXA10 axis promotes epithelial-mesenchymal transition in ovarian cancer[J]. Oncol Rep, 2015, 34(3): 1193-1202.
[10] COLEMAN R L, MONK B J, SOOD A K, et al. Latest research and treatment of advanced-stage epithelial ovarian cancer[J]. Nat Rev Clin Oncol, 2013, 10(4): 211-224
[11] TEO M C. Update on the management and the role of intraperitoneal chemotherapy for ovarian cancer[J]. Curr Opin Obstet Gynecol, 2014, 26(1): 3-8.
[12] JELOVAC D, ARMSTRONG D K. Recent progress in the diagnosis and treatment of ovarian cancer[J]. CA Cancer J Clin, 2011, 61(3): 183-203.
[13] FISCHER K R, DURRANS A, LEE S, et al. Epithelial-tomesenchymal transition is not required for lung metastasis but contributes to chemoresistance[J]. Nature, 2015, 527(7579): 472-476.
[14] ZHENG X, CARSTENS J L, KIM J, et al. Epithelial-tomesenchymal transition is dispensable for metastasis but induces chemoresistance in pancreatic cancer[J]. Nature, 2015,527(7579): 525-530.
[15] 陈潇, 周浩, 周希, 等. 松弛素对TGF-β诱导的内皮细胞间质化的抑制作用[J]. 温州医科大学学报, 2014, 44(3): 161-165.
[16] DING Q, MIYAZAKI Y, TSUKASA K, et al. CD133 facilitates epithelial-mesenchymal transition through interaction with the ERK pathway in pancreatic cancer metastasis[J].Mol Cancer, 2014, 13, 15.
[17] PAN J X, WANG F, YE L Y. Doxorubicin-induced epithelial-mesenchymal transition through SEMA 4A in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2016,479(4): 610-614.
[18] SUZUKI A, KUSAKAI G, KISHIMOTO A, et al. Regulation of caspase-6 and FLIP by the AMPK family member ARK5[J]. Oncogene, 2004, 23(42): 7067-7075.
The role of ARK5 in carboplatin resistance in epithelial ovarian cancer cell
PAN Jiexue1, LIN Feng2.
1.Reproductive Medicine Center, the First Af fi liated Hospital of Wenzhou Medical University, Wenzhou, 325015;2.Department of Gynecology, the First Af fi liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To investigate the mechanisms of carboplatin resistance in epithelial ovarian cancer(EOC) cells, and provide preliminary exploration on improving the effect of chemotherapy in ovarian cancer patients. Methods: Cell counting kit-8 was used to evaluate the effect of carboplatin on the proliferation of SKOV3 and A2780 cells, meanwhile the expression of epithelial-mesenchymal transition related proteins E-cadherin and vimentin were detected by Western blot. Flow cytometry assay was used to detect the expression of CD133. In addition, knockdown of ARK5 was to evaluate the role of ARK5 in the carboplatin-induced epithelial-mesenchymal transition. Results: The IC50of carboplatin in SKOV3 and A2780 was 2.824 µg/mL and 1.760 µg/mL, respectively. Furthermore, we also found that carboplatin could signif i cantly induce epithelial-mesenchymal transition in EOC cells. Carboplatin could increase the expression of ARK5, but not SNARK. Knockdown of ARK5 could attenuate the induction of epithelial-mesenchymal transition. Conclusion: ARK5 plays an important role in carboplatin resistance in EOC cells. Knockdown of ARK5 may reduce the carboplatin-induced epithelial-mesenchymal transition.
epithelial ovarian cancer cells; epithelial-mesenchymal transition; carboplatin; ARK5
R711
A
10.3969/j.issn.2095-9400.2017.11.006
2017-03-30
浙江省中医药管理局青年人才基金项目(2017ZQ0 20);浙江省医药卫生科技计划项目(2017KY462);温州市科技局科研基金资助项目(Y20160037)。
潘洁雪(1986-),女,浙江温州人,住院医师,博士。
林凤,副主任医师,Email:234898067@qq.com。
丁敏娇)
