数字PCR和荧光定量PCR检测转基因番木瓜中外源基因拷贝数方法的建立及其应用
2024-06-09谢秀菊夏启玉刘帅麦贤俊贾瑞宗郭安平徐志胜李峰孔祥义赵辉
谢秀菊 夏启玉 刘帅 麦贤俊 贾瑞宗 郭安平 徐志胜 李峰 孔祥义 赵辉

关键词:转基因番木瓜;拷贝数;内参基因;数字PCR;荧光定量PCR
中图分类号:S667.9 文献标志码:A
番木瓜(Carica papaya L.)是世界四大热带、亚热带畅销水果之一。番木瓜环斑病毒(Papayaringspot virus,PRSV)是危害番木瓜最严重的病毒,其侵染番木瓜植株后,造成番木瓜大面积减产甚至整片果园死亡。1986 年,ABEL 等[1]发现将病毒基因转入寄主植物,可以导致寄主植物对病毒产生抗性,此后转基因技术被应用到番木瓜的抗病育种中。第一个转基因番木瓜品种是将夏威夷PRSV 55-1 的外壳蛋白(coat protein, CP)基因转入Sunset 品种中[2],田间抗性表现相当良好,该转基因品种于1997 年在夏威夷获得商业化应用。随后,2009 年美国弗罗里达大学的转基因番木瓜X17-2 品系[3]也获得商业化应用。我国的番木瓜转基因育种是从1996 年开始的,华南农业大学研发出了抗病品系华农1 号,并且在2010 年获得了国家颁发的番木瓜农业转基因生物安全证书。我国台湾中兴大学的CHENG 等[4]和BAU 等[5-6]也研发出了转基因番木瓜抗病品系16-0-1、18-2-4等。近些年来,研究人员仍在不断进行新的番木瓜转基因育种研究。
在转基因植物育种研究中,外源基因整合进入受体植物基因组的拷贝数会影响外源目的基因的表达及其遗传稳定性[7]。当外源基因以1~2 个拷贝数整合到受体基因组时,一般能够稳定高效表达,而当外源基因以多拷贝数整合到受体基因组时,可能会出现表达水平较低甚至基因沉默,从而无法得到表现目的性状的转基因植株[8-9]。因此,研究人员往往会选择单低拷贝整合的株系,然而,单低拷贝整合的转基因株系往往需要从大量T0代植株中筛选得到。此外,纯合转基因植株的获得,也需要从大量性状分离的T1 代转基因植株中筛选。因此,高效的外源基因拷贝数检测方法对转基因育种至关重要。
传统的检测转基因植株中外源基因拷贝数的方法为Southern 杂交,该方法特异性强、灵敏度高,但其对样品DNA 的质量和含量要求较高,且成本高,周期长,难以满足高通量外源基因拷贝数检测的需求。因此,亟需建立简单、快速、高效的检测转基因植株中外源基因拷贝数的方法。本研究以已知外源基因为单拷贝整合的转CP基因番木瓜为参照,筛选出番木瓜基因组中的单拷贝基因;进一步以其为内参基因,建立基于绝对定量的数字PCR 技术(digital PCR, dPCR)和荧光定量PCR技术(fluorescence quantitative PCR,qPCR)检测转基因番木瓜中外源基因拷贝数的方法,为转基因番木瓜育种提供新的高通量拷贝数检测方法。
1 材料与方法
1.1 材料
1.1.1 植物材料转基因番木瓜株系来自中国热带农业科学院三亚研究院,包含:21 株转入海南PRSV 的CP 基因的T1 代番木瓜、55 株转入海南PRSV 的辅助成分-蛋白酶基因(HC-Pro)发夹结构的T0 代番木瓜苗和28 株转入海南PRSV 的复制酶基因(Nib)发夹结构的T0 代番木瓜苗。
1.1.2 试剂 广谱植物基因组DNA 快速提取试剂盒(CZ301-01)购自北京博迈德基因技术有限公司; QuantStudio? 3D 数字PCR 预混液v2、QuantStudio 3D 数字PCR 20K 芯片v2 、QuantStudio 3D 数字PCR 芯片罩盖v2 、QuantStudio 3D 数字PCR 上样刀片、注射器装浸液、浸液吸头等均购自赛默飞世尔科技(中国)有限公司;2X Q3 SYBR qPCR Master mix 购自吐露港生物科技有限公司,PCR 平盖八排管购自Labselect 公司。引物均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 番木瓜单拷贝内参基因的筛选及鉴定(1)番木瓜单拷贝基因的筛选及dPCR 引物与探针设计。在phytozome(https://phytozome-next.jgi.doe.gov/blast-search)网站的番木瓜基因组中,挑选出可能为单拷贝的2 个基因Cpa03g018830 和Cpa03g018770 作为候选内参基因,下载这2 个基因的DNA 序列。使用Premier 5.0 软件设计特异性引物(F/R)与探针(P),Cpa03g018830 和Cpa03g018770 的探针5端连接VIC 荧光基团,3′端连接MGB 荧光猝灭基团,该基团散发红色荧光。转基因番木瓜外源基因CP 和NPTⅡ(neomycin phosphotransferase)的探针5′端连接FAM 荧光基团,3′端连接BHQ1 荧光猝灭基团,该基团散发绿色荧光。本实验使用的所有引物及探针序列见表1。
(2)转CP 基因番木瓜的T1代阳性植株的筛选。以T0代经过Southern 杂交验证为单拷贝的转CP 基因番木瓜的T1代阳性植株幼苗作为内参基因拷贝数鉴定的参照,首先通过PCR 筛选出转CP 番木瓜的T1 代阳性植株。采集21 株转CP 基因番木瓜的T1 代幼苗的叶片,提取其基因组DNA,通过常规PCR 筛选阳性幼苗。反应体系为:Green Master Mix 12.5 μL,CP-F1(10 μmol/L)1 μL,CP-R1(10 μmol/L)1 μL,DNA 模板1 μL,Nuclease-free water 9.5 μL,总体积25 μL。扩增程序為:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,共35 个循环;最后72 ℃延伸10 min,4 ℃保存。PCR 扩增反应结束后,取10 μL PCR 产物在2%琼脂糖凝胶上进行电泳检测。
(3)dPCR 鉴定候选内参基因的拷贝数。从上述转CP 基因番木瓜的T1代阳性植株中随机选取8 株,编号为CP1~CP8。使用QuantStudioTM3DAnalysisSuiteTM 数字PCR 仪,通过dPCR 检测候选内参基因Cpa03g018830 在番木瓜基因组中的拷贝数。反应体系为:2×dPCR Master Mix 7.3 μL,CP 基因、Cpa03g018830 基因的正向引物和反向引物(10 μmol/L)各1.3 μL,探针(10 μmol/L) 0.36μL,DNA 模板(10 ng/μL)1 μL,Nuclease-free water0.28 μL,总体积14.50 μL。扩增程序为:96 ℃变性10 min;60 ℃ 2 min,98 ℃ 30 s,39 个循环;60 ℃ 2 min。反应结束后,将芯片放入dPCR 读取仪中读取FAM 和VIC 荧光信号,并使用对应软件进行荧光数据分析,得到检测样品DNA 中CP 基因和Cpa03g018830 基因的拷贝数( copy/μL ), 计算样品中CP 基因与Cpa03g018830 基因的拷贝数比值,通过比值判断Cpa03g018830 基因在番木瓜基因组中的拷贝数。
选取已确认为单拷贝杂合的植株CP7 作为Cpa03g018770 基因在番木瓜基因组中拷贝数鉴定的参照,通过数字PCR 检测Cpa03g018770 基因在番木瓜基因组中的拷贝数; 同时以Cpa03g018830 基因为单拷贝对照来进一步验证Cpa03g018770 基因的拷贝数。Cpa03g018770 基因和Cpa03g018830 基因的dPCR 实验各设3 个重复。1.2.2 dPCR 检测转基因番木瓜T0 代的外源基因拷贝数 以转番木瓜PRSV 病毒HC-Pro 基因的T0代阳性番木瓜苗为待测样品, 编号为HC-Pro-1~HC-Pro-11,采集11 株幼苗的叶片,提取其基因组DNA。以Cpa03g018770 基因和Cpa03g018830 基因为内参基因,以番木瓜转基因常用的筛选基因NPTⅡ 为外源目的基因,通过dPCR 检测外源基因在转HC-Pro 基因番木瓜基因组中的拷贝数。其中,以Cpa03g018770 基因为内参基因,检测6 株转HC-Pro 基因番木瓜苗(HC-Pro-1~HC-Pro-6);以Cpa03g018830 基因为内参基因,检测全部11 株转HC-Pro 基因番木瓜苗。数字PCR 仪反应体系和扩增程序同1.2.1。反应结束后,将芯片放入dPCR 读取仪中读取FAM 和VIC 荧光信号,并使用对应软件进行荧光数据分析,得到检测样品DNA 中NPTⅡ基因、Cpa03g018830 基因、Cpa03g018770 基因的拷贝数( copy/μL ), 计算样品中NPTⅡ 基因与Cpa03g018830 基因、Cpa03g018770 基因的拷贝数比值,通过比值判断NPTⅡ基因在番木瓜基因组中的拷贝数。
1.2.3 荧光定量PCR 检测转基因番木瓜T0代植株的外源基因拷贝数 (1)引物验证。荧光定量PCR 引物同数字PCR 引物一样,且不需要探针。以2 份已知拷贝数的转基因番木瓜的基因组DNA为模板,进行荧光定量PCR 实验,验证内参Cpa03g018830、Cpa03g018770 基因和外源基因NPTⅡ的引物有效性。反应在LighterCycler? 96荧光分析仪中进行,反应体系为:2X Q3 SYBRqPCR Master Mix(Universal)10 μL,正向引物和反向引物(10 μmol/L)各0.4 μL,Template DNA(50 ng/μL)1 μL,ddH2O 8.2 μL,总体积为20 μL。扩增程序为:95 ℃预变性30 s;95 ℃变性10 s,58 ℃退火30 s,40 个循环;熔解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。实验设置3 个重复,反应结束后,通过扩增曲线及溶解曲线判定引物是否有效。
(2)qPCR 检测待测样品的外源基因拷贝数。以转HC-Pro 基因的T0 代阳性番木瓜苗为待测样品,编号为HC-Pro-12~HC-Pro-55。以转Nib 基因的T0 代阳性番木瓜苗为待测样品,编号为Nib-1~Nib-28。分别采集番木瓜幼苗的叶片,提取其基因组DNA 。此外, HC-Pro-1~HC-Pro-11 和CP1~CP8 也作为待测样品通过qPCR 再次验证其拷贝数,待测样品共91 份。以Cpa03g018770 基因和Cpa03g018830 基因为内参基因,以NPTⅡ基因为外源目的基因,以单拷贝纯合的转基因番木瓜株系作为对照,通过qPCR 检测所有待测样品的外源基因在转基因番木瓜基因组中的拷贝数。qPCR 反应体系及扩增程序同引物验证,每个样品重复3 次。反应结束后,使用LightCycler?96SW 1.1 系统对数据进行分析,采用2?ΔΔCT法分析转基因植株中NPTII 基因的相对拷贝数。
2 结果与分析
2.1 番木瓜单拷贝内参基因的筛选及鉴定
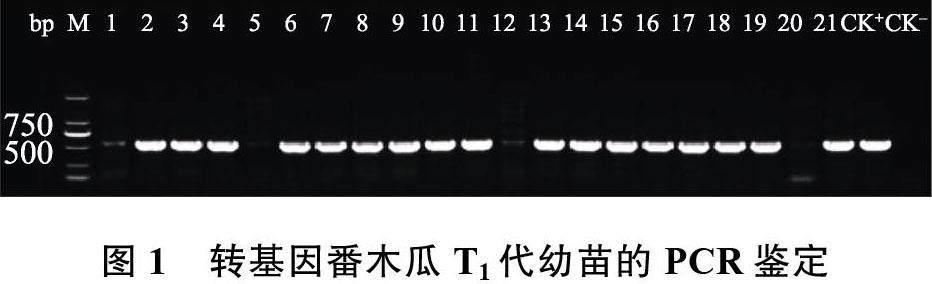
2.1.1 CP 基因阳性植株的PCR 鉴定 PCR 产物经电泳检测后,若出现500 bp 左右的目的条带则为转基因阳性植株,可能为CP 基因纯合或CP 基因杂合,若无目的条带则为非转基因植株。21 株T1 代幼苗的PCR 检测结果见图1,其中,有17株为CP 基因阳性植株,这17 株番木瓜植株可作为内参基因拷贝数鉴定的参照。
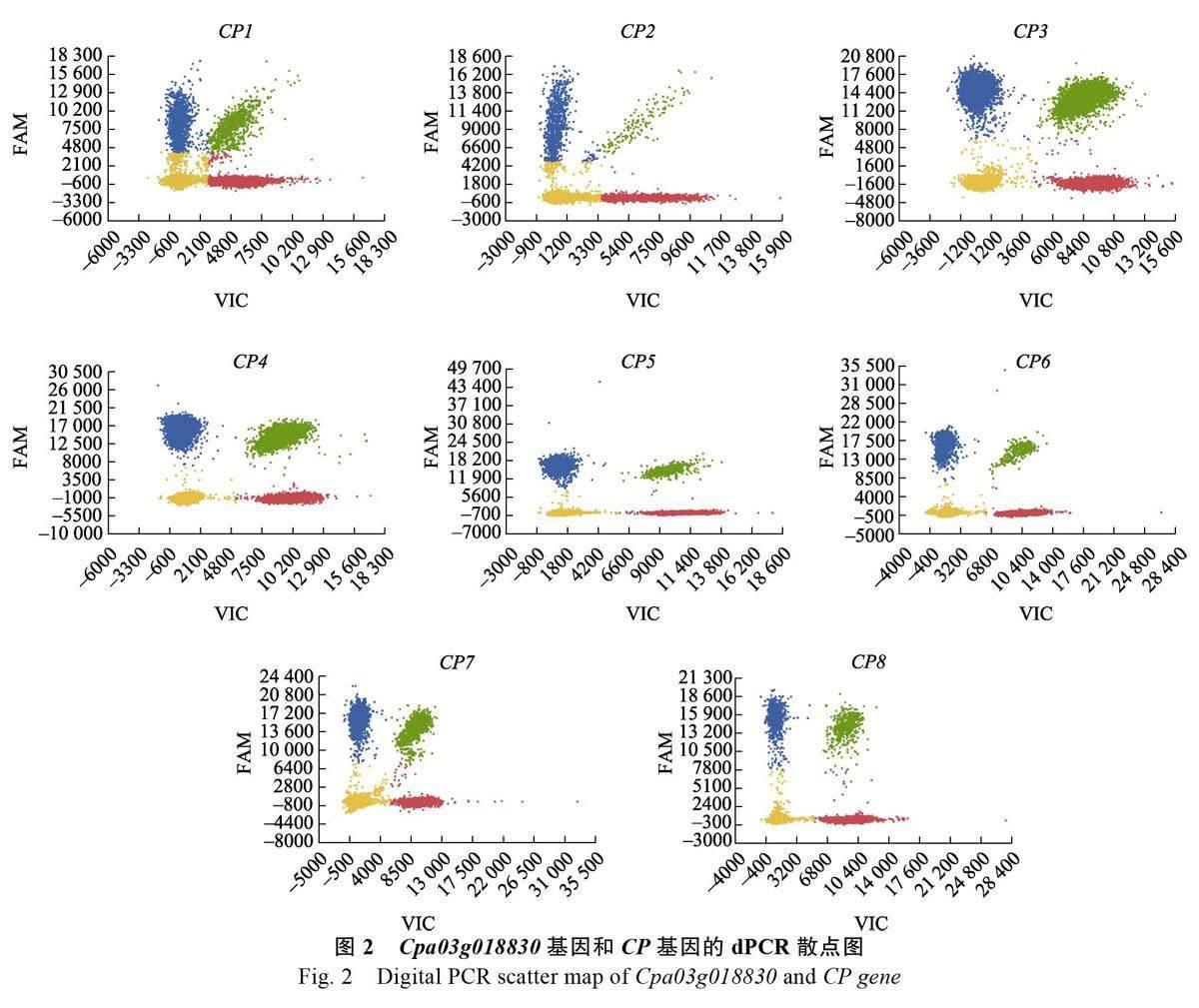
2.1.2 dPCR 鉴定候选内参基因的拷贝数 由于番木瓜属于二倍体植物,转CP 基因番木瓜单拷贝株系的T1 代阳性植株的CP 基因与Cpa03g018830基因的拷贝数比值为1 或0.5 时,Cpa03g018830基因为单拷贝基因。且根据CP 基因与目的基因的拷贝数比值,可得出转CP 基因番木瓜的T1 代阳性植株为纯合或杂合,拷贝数比值为1 时为单拷贝纯合CP 植株,拷贝数比值为0.5 时为单拷贝杂合CP 植株。8 个样品的数字PCR 散点图见图2,其中,蓝色散点为CP 基因荧光孔数;红色散点为Cpa03g018830 基因荧光孔数;绿色散点为CP 基因和Cpa03g018830 基因荧光孔数,黄色散点为无信号孔数。dPCR 实验的拷贝数结果(表2)显示,7 个样品的CP 基因与Cpa03g018830 基因的拷貝数比值接近为1 或0.5,CP8 样本的拷贝数比值为0.12, 结果异常, 将其排除。因此,Cpa03g018830 基因在番木瓜基因组中为单拷贝基因。且CP3 与CP4 样品为单拷贝纯合植株,CP1、CP2、CP5、CP6、CP7 样品为单拷贝杂合植株。
由于CP7 为单拷贝杂合植株,其CP 基因与目的基因的拷贝数比值为0.5 时,则目的基因为单拷贝基因。CP7 的dPCR 实验的结果(表3)显示,CP 基因与Cpa03g018770 基因和Cpa03g018830 基因的拷贝数比值均接近0.5。因此,Cpa03g018770基因和Cpa03g018830 基因在番木瓜基因组中均为单拷贝基因,可作为内参基因应用于转基因番木瓜中外源基因拷贝数的检测。
2.2 dPCR 法检测转基因番木瓜T0代植株的外源基因拷贝数
番木瓜是二倍体植物,因此单拷贝整合的外源基因片段与内参基因的拷贝数比值约为0.5,双拷贝整合的外源基因片段与内参基因的拷贝数比值约为1,三拷贝整合的外源基因片段与内参基因的拷贝数比值约为1.5,四拷贝、五拷贝等多拷贝外源基因片段整合拷贝数以此类推。
以Cpa03g018770 基因为内参基因,以NPTⅡ基因为外源目的基因,11 株转HC-Pro 基因的T0代阳性番木瓜苗的dPCR 检测结果表明,HC-Pro-1 、HC-Pro-2 、HC-Pro-3 、HC-Pro-4 、HC-Pro-5 检测为单拷贝,HC-Pro-6 检测为五拷贝(表4)。以Cpa03g018830 基因为内参基因的数字PCR 结果表明,HC-Pro-1、HC-Pro-2、HC-Pro-3、HC-Pro-4、HC-Pro-5 检测为单拷贝,HC-Pro-6 检测为五拷贝,HC-Pro-7、HC-Pro-8 和HC-Pro-10检测为四拷贝,HC-Pro-9 和HC-Pro-11 检测为六拷贝。其中,HC-Pro-1~HC-Pro-6 经2 个内参基因检测的结果一致(表5)。
2.3 qPCR 检测转基因番木瓜T0代植株的外源基因拷贝数
2.3.1 qPCR 引物的验证 3 对引物的扩增曲线及融解曲线表明,3 对引物均有明显的扩增曲线,且融解曲线均具有唯一的吸收峰,可作为qPCR检测引物(图3)。
2.3.2 qPCR 检测待测样品的外源基因拷贝数采用2?ΔΔCT法分析转基因植株中NPTII 基因的相对拷贝数,定义已知单拷贝純合转基因植株对照为参照因子,即为1,各样本相对于参照因子拷贝数的倍数为2?ΔΔCT。由于T0 代植株的插入为杂合型,因此单拷贝植株的相对定量值(RQ)应为纯合单拷贝参照的1/2,相对表达量约为0.5;而双拷贝植株的RQ 值与纯合单拷贝对照相等,相对表达量约为1;三拷贝植株的相对定量值RQ应该为纯合单拷贝对照的3/2,相对表达量约为1.5;多拷贝外源基因整合拷贝数以此类推。样品HC-Pro-12~HC-Pro-55 的qPCR 检测拷贝数的结果见图4,其中,有25 个是单拷贝转基因植株,有1 个是双拷贝转基因植株,有2 个是三拷贝转基因植株,其余均为三拷贝以上转基因植株。样品Nib-1~Nib-28 的qPCR 检测拷贝数的结果见图5,有5 个是单拷贝转基因植株,有2 个是双拷贝转基因植株,有6 个是三拷贝转基因植株,其余均为三拷贝以上转基因植株。样品CP1~CP8 和HC-Pro-1~HC-Pro-11 的qPCR 检测拷贝数的结果见图6,CP1、CP2、CP5、CP6 和CP7 样品为单拷贝杂合植株,CP3、CP4 和CP8 样品为单拷贝纯合植株,除CP8 号的dPCR 结果异常,其余均与dPCR 检测的拷贝数结果一致。HC-Pro-1、HC-Pro-2、HC-Pro-3、HC-Pro-4 和HC-Pro-5 均为单拷贝转基因植株, HC-Pro-7 、HC-Pro-8 和HC-Pro-10 为四拷贝转基因植株,HC-Pro-6 为五拷贝转基因植株,以上植株的拷贝数检测结果与dPCR 的检测结果一致;HC-Pro-9 和HC-Pro-11经qPCR 检测为十五拷贝和五拷贝,然而dPCR的检测结果均为六拷贝,结果不一致,这可能是因为荧光定量对外源基因单低拷贝整合的检测灵敏度较高,而对多拷贝整合的检测灵敏度低的缘故。
3 讨论
在转基因番木瓜检测中,外源基因的拷贝数检测是不可缺少的一环,因此获得一种简便、高效、精准的检测方法至关重要。传统的Southern杂交的结果准确可信,但其成本高,耗时长,一次检测样品少,操作要求高。qPCR 也常用于转基因植株中外源基因拷贝数的检测,可分为荧光染料法和探针法,探针法相比于染料法,能更精确地对低拷贝的目的DNA 片段进行定量分析,但探针价格较昂贵,成本高。染料法虽然相较于探针法精准度稍有降低,但在检测外源基因的单低拷贝整合时的准确性也足以满足育种工作需求,且其成本较低,更适宜高通量检测。目前,qPCR 测定外源基因拷贝数已成功应用于转基因水稻[10-11]和棉花[12]等作物的拷贝数检测。dPCR 技术是在qPCR 技术基础上的一次技术革新,其分析结果可直接得出DNA 分子的个数,对起始样品进行绝对定量。相比qPCR,dPCR 无需任何校准物,具有更高的灵敏度、特异性和准确性。dPCR 在基因表达研究[13]、miRNA 研究[14-16]、基因组拷贝数鉴定[17-18]等方面具有广阔前景。HINDSON 等[19]研究表明,dPCR 能够简单而准确地测定水稻、柑橘、马铃薯、玉米、番茄和小麦中的外源基因拷贝数。NARANCIO 等[20]比较了qPCR 和dPCR 方法在白三叶中外源基因拷贝数检测中的优劣,结果表明,dPCR 在白三叶中的拷贝数检测上具有更高的准确性。
要建立qPCR 和dPCR 检测转基因植株中外源基因拷贝数的方法,需要拷贝数明确的单拷贝基因作为内参基因。XUE 等[21]通过对甘蔗多个基因的检测发现,APRT 基因最适合作为甘蔗DNA含量定量的内源参考基因,可应用于转基因甘蔗中外源基因拷贝数的鉴定。本研究筛选出了2 个番木瓜单拷贝基因Cpa03g018830 与Cpa03g018770,验证了其作为内参基因准确可用,且可将2 个内参基因同时使用,若2 个内参结果相一致,则结果更准确,因此,这2 个基因可作为内参基因应用于qPCR 或dPCR 鉴定转基因番木瓜中外源基因拷贝数的研究。
本研究中,利用dPCR 与qPCR 方法分别测定了转基因番木瓜中外源基因的拷贝数,HC-Pro-9 和HC-Pro-11 经qPCR 检测为十五拷贝和五拷贝,然而dPCR 的检测结果均为六拷贝,可能是因为qPCR 对外源基因单的低拷贝整合的检测灵敏度较高,而对外源基因多拷贝整合的检测灵敏度低较低。相比较来说,数字PCR 不依赖标准曲线定量,并不受PCR 扩增效率影响,具有更高的灵敏度和检测准确度, 基于阵列式的QuantStudio 3D dPCR 系统等商业平台也已成为临床应用的关键设备,dPCR 的结果对外源基因拷贝数的检测更准确。qPCR 成本较低,简单快速,适合用来在大量转基因植株中初筛出单低拷贝整合的植株,经qPCR 初步筛选到的单低拷贝整合的株系可进一步用Southern 杂交进行验证,不仅进一步提高实验结果的准确性与权威性,还节省成本。本研究建立的利用dPCR 和qPCR 技术高通量检测转基因番木瓜中外源基因拷贝数的方法,可为番木瓜转基因抗病育种中单低拷贝株系的选育提供新的方法。
