水稻糊粉层蛋白酶体参与种子萌发的研究
2024-06-09陈文奕陈惠萍
陈文奕 陈惠萍


关键词:GA;蛋白酶体;水稻糊粉层;贮藏蛋白;种子萌发
中图分类号:S511 文献标志码:A
禾谷类种子的胚乳由淀粉性胚乳及外层的糊粉层构成。成熟的糊粉层细胞仍具有活性,其形态为规则的多边形,富含蛋白质、矿物质、淀粉和维生素等物质[1-2]。水稻糊粉层细胞内的贮藏蛋白以清蛋白及球蛋白为主,大多数积累在液泡内从而形成蛋白质贮藏液泡(protein storage vacuoles,PSVs)[3-4]。赤霉素(gibberellic acid, GA)是植物生长和发育过程中重要的调节激素。在禾谷类种子萌发过程中,胚会释放出GA 诱导糊粉层细胞合成一系列的酸性水解酶(如α-淀粉酶、核酸酶、蛋白酶等)[5-6],这些酶会在中央大液泡破裂后释放,并用于降解淀粉性胚乳中贮藏的营养物质,为种子萌发提供营养[7]。与此同时,糊粉层细胞内的贮藏蛋白在水稻种子萌发过程被胚生长所利用[8]。
26S 蛋白酶体是一种依赖ATP,并能水解泛素化蛋白的蛋白酶复合物,主要负责细胞质和细胞核中的蛋白质降解,对于蛋白质稳态至关重要[9-10]。26S 蛋白酶体控制著植物体内平衡的各种过程,包括植物发育、光反应、细胞分裂及响应植物激素反应等[9, 11-12],并且与植物防御相关[13],其功能的丧失会显著影响植物的生长[14]。研究表明,26S 蛋白酶体是种子萌发过程中所必需的,它能降解ABA 信号传导及合成的正调节因子,从而打破种子休眠并促进萌发[15];以及维持拟南芥地上部分器官的大小及细胞增殖速率等[16]。
DELLA 蛋白是GA 信号转导的核心,在植物生长调控中充当生长抑制因子[17-18]。外源GA 可通过诱导26S 蛋白酶体降解DELLA 蛋白来促进大麦幼苗的生长[19],而GA 生物合成抑制剂及26S 蛋白酶体抑制剂均能抑制DELLA 蛋白的降解[20]。由此可见,GA 信号传导在26S 蛋白酶体介导的蛋白质降解中起着重要的作用。
26S 蛋白酶体由2 个不同功能的亚复合体组成,即20S 蛋白酶体和19S 调节颗粒[21]。20S 蛋白酶体是一个桶形结构,由2 个相同的外α 环和2 个相同的内β 环堆叠组成,使20S 蛋白酶体具有α1-7β1-7β1-7α1-7的双重对称性结构,14 个α 亚基和14 个β 亚基的正确组装确保了20S 蛋白酶体的完整性[22-24]。20S 蛋白酶体上含有β1、β2 和β5三种蛋白酶活性位点,并形成蛋白水解室,而19S调节颗粒的作用是识别泛素化蛋白,并将其转运到20S 蛋白酶体的蛋白水解室内进行降解[25-26]。近年的研究发现,多种蛋白质可以被20S 蛋白酶体本身降解,而不需要与19S 调节颗粒结合后发挥其调节作用[27-28]。20S 蛋白酶体介导的蛋白质降解过程不依赖泛素化及ATP,在氧化应激后,20S 蛋白酶体活性升高,从而快速降解氧化损伤的蛋白质[29-30]。20S 蛋白酶体β 亚基1(20S proteasomeβ subunit1, PBA1)是一种具有催化活性的半胱氨酸蛋白酶,已证实其参与PCD 的发生[31]。在银诱导葡萄悬浮细胞的PCD 过程中,PBA1 专一性抑制剂AC-APnLD-CHO 可使26S 蛋白酶体功能受损,伴随着多泛素蛋白的增加[32]。
本研究通过借助酶联免疫吸附技术和实时荧光定量PCR 技术等,探究蛋白酶体及其亚基PBA1 参与GA 对萌发水稻种子糊粉层中贮藏蛋白的调节过程,为深入研究GA 调节泛素-蛋白酶体系统介导水稻糊粉层中蛋白质降解的分子机制提供理论依据。
1 材料与方法
1.1 材料
试验材料为水稻(Oryza sativa L.)杂交种特优128,购自海南省儋州市种子公司。
1.2 方法
1.2.1 材料培养 选取去除颖壳后的水稻种子,用0.1%高锰酸钾消毒10 min,用纯水将其洗干净后,分别置于添加不同处理液的培养皿中。根据实验需求,萌发水稻种子分别在浸泡1~9 d 后取出,使用手术刀片分离水稻种子糊粉层用于检测相应的指标。
本研究设置2 个处理组。处理1:(1)CK(纯水);(2)GA(50 μmol/L);(3)GA 合成抑制剂烯效唑(Uniconazole,Uni,75 μmol/L)。处理2:(1)CK(DMSO);(2)26S 蛋白酶体活性抑制剂MG132(50 μmol/L)。
1.2.2 植物糊粉层总蛋白提取及含量测定 本实验采用Solarbio 公司的植物蛋白提取试剂盒(BC3720)进行水稻糊粉层总蛋白的提取。称取100 mg 的水稻糊粉层放入液氮中速冻(最好过夜),取出糊粉层于含液氮的研钵中研磨成粉末,加入1 mL 裂解液后,置于4 ℃裂解20 min。4 ℃,14 000 r/min 离心30 min 后收集上清,上清即为水稻糊粉层总蛋白。采用BCA 法测定上清液中总蛋白含量,每组样品重复3 次。
1.2.3 26S 蛋白酶体、20S 蛋白酶体和PBA1 活性测定 称取糊粉层100 mg,使用液氮研磨成粉末,加入900 μL 0.01 mol/L PBS 缓冲液(pH7.2~7.4),在4 ℃下5000 r/min 离心15 min,吸取上清液至预冷离心管中备用。本试验分别采用江苏酶免实业有限公司的植物26S 蛋白酶体、20S蛋白酶体及20S 蛋白酶体β 亚基1(PBA1)的ELISA 检测试剂盒进行检测,使用全自动酶标分析仪(AMR-100)测定其在450 nm 处的吸光度。分别将原倍标准品稀释后,制作出26S 蛋白酶体、20S 蛋白酶体及PBA1 的标准曲线,依照其标准曲线计算出酶活性。每组样品重复3 次。
1.2.4 总RNA 提取及cDNA 合成 根据实验要求选取水稻糊粉层50 mg,采用天根生化公司产品(DP441)植物总RNA 提取试剂盒进行总RNA的提取,按照试剂盒说明书进行操作,并稍加修改。制取1.2%的琼脂糖凝胶进行电泳15 min,利用凝胶成像分析系统检测所提取的RNA 完整性。使用微量核酸检测仪检测RNA 纯度及浓度,然后将RNA 定量为100 ng/μL,以进行逆转录反应。
以定量的水稻总RNA 为模板,使用TaKaRa公司的产品PrimeScript RT reagent Kit with gDNAEraser(RR047A)合成cDNA。总反应体系为20 μL。
1.2.5 实时荧光定量PCR 本实验采用biosharp公司的产品荧光定量试剂盒SYBR Green MasterMix(BL705A)。以cDNA 为模板,OsActin 为内参基因,OsPBA1 为目的基因检测的表达水平,每个样品重复3 次。相应基因引物序列如表1 所示。
1.2.6 胚根长和胚芽长的测量 在不同处理中随机选取培养5 d 的萌发水稻种子10 粒,使用直尺測量其胚根长度和胚芽长度,并取3 次独立实验所测量的平均值进行差异显著性分析。
1.3 数据处理
实验数据采用Excel 软件进行处理,并用SPSS 23.0 软件进行差异显著性分析(P<0.05)。
2 结果与分析
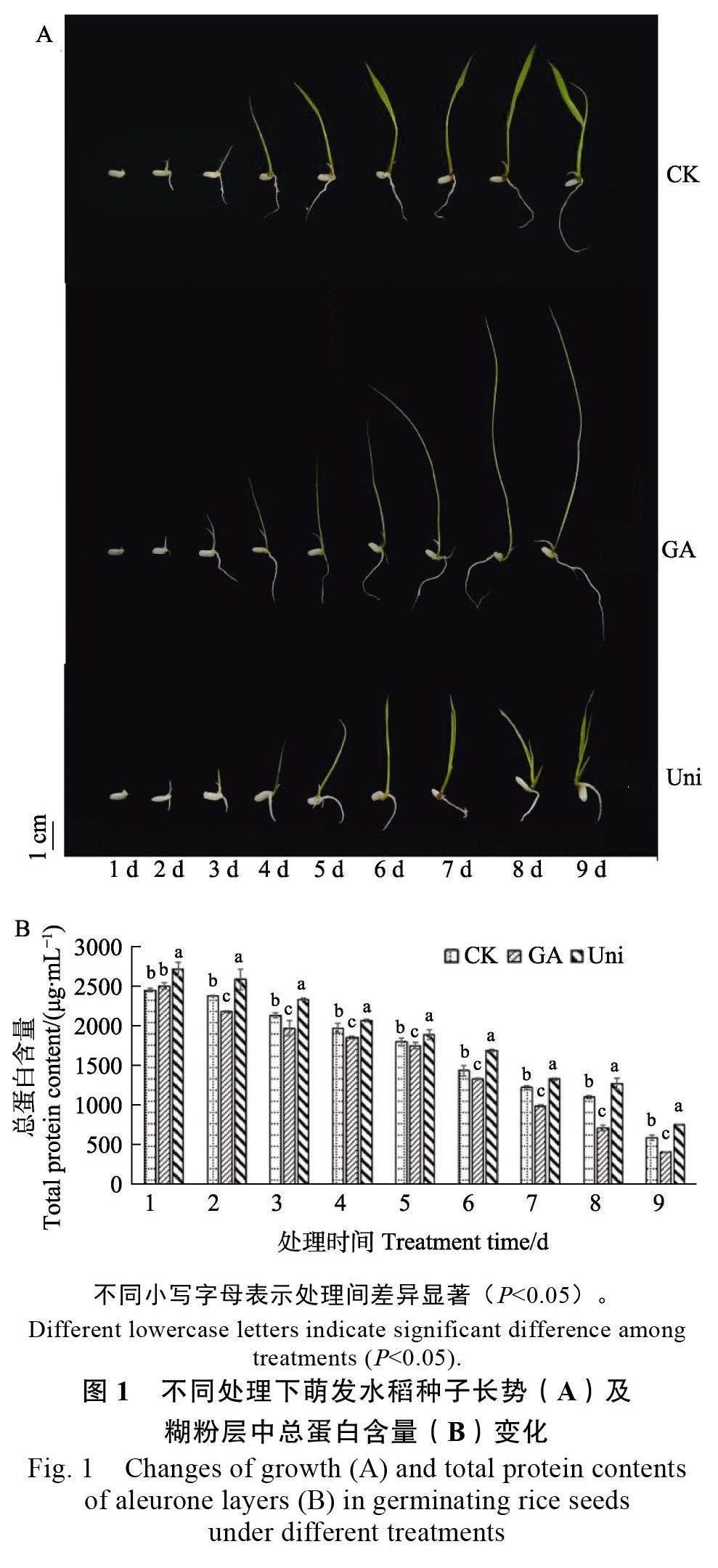
2.1 水稻种子萌发过程中糊粉层细胞总蛋白含量的变化
图1A 为水稻种子萌发1~9 d 的长势,与纯水培养相比,GA 处理明显促进水稻种子的萌发,而GA 合成抑制剂Uni 处理后,水稻种子的萌发受到抑制。如图1B 所示,纯水、GA 和GA 合成抑制剂Uni 处理的水稻糊粉层在种子萌发过程中,总蛋白含量均随着时间的增加而逐渐降低。在2~9 d,与对照相比,GA 处理的糊粉层中,总蛋白含量显著降低;而GA 合成抑制剂Uni 处理的糊粉层中总蛋白含量一直维持在较高水平。以上结果表明,外源GA 可加快糊粉层中蛋白质的降解,从而促进水稻种子的萌发,而GA 合成抑制剂Uni 则减缓糊粉层中蛋白质的降解,抑制水稻种子的萌发。
2.2 水稻种子萌发过程中糊粉层26S 蛋白酶体及20S 蛋白酶体活性的变化
由图2A 可知,26S 蛋白酶体活性在水稻种子萌发1~6 d 呈现上升的趋势,并在6 d 时达到最高活性水平;在7~9 d 时,26S 蛋白酶体活性水平逐渐下降。该结果表明在水稻种子萌发过程中糊粉层细胞中的26S 蛋白酶体活性具有依赖时间的效应。
如图2B 所示,在水稻种子萌发1~7 d 时,糊粉层中20S 蛋白酶体活性逐渐上升,并在第7 天时达到峰值,随后其活性逐渐下降。表明20S 蛋白酶体活性在水稻种子萌发过程中同样具有依赖时间的效应。
综合以上结果,在水稻种子萌发过程中,糊粉层细胞中含有活性的26S 蛋白酶体和20S 蛋白酶体,二者的活性均随着萌发时间的增加而变化,且20S 蛋白酶体活性比26S 蛋白酶体活性迟1 d达到最高峰。
2.3 水稻种子萌发过程中OsPBA1 表达水平及PBA1 活性的变化
OsPBA1 在水稻种子萌发过程出现2 个表达峰值,OsPBA1 的相对表达量在1~5 d 随时间的增加而上升,并在第5 天达到第一个表达峰值,约为1 d 的6.24 倍;在6~7 d,其相对表达量开始下降,而第8 天时,表达量明显升高,出现第二个表达峰值,其表达量约为1 d 的5.4 倍,随后糊粉层中OsPBA1 的表达量开始下降(图3A)。
如图3B 所示,在水稻种子萌发过程中,糊粉层细胞中PBA1 活性的变化趋势与OsPBA1 转录水平的变化趋势类似。在1~5 d,PBA1 活性随时间的延长而上升,并在第5 天达到第一个峰值;在6~7 d,PBA1 活性下降,第8 天时出现上升的趋势,并达到第二个峰值,该峰值低于5 d 的活性峰值;随后,水稻糊粉层细胞中的PBA1 活性开始下降。
以上结果表明,OsPBA1 表达水平和PBA1活性随着种子萌发时间的增加而变化,PBA1 可能以依赖时间的方式调控水稻种子的萌发过程。
2.4 GA 及GA 合成抑制剂对水稻糊粉层中26S蛋白酶体、20S 蛋白酶体及PBA1 活性的影响
如图4A 所示,与对照相比,GA 处理5 d 的水稻糊粉层中26S 蛋白酶体的活性升高了9.97%(P<0.05),而GA 合成抑制剂Uni 处理5 d 则使26S 蛋白酶体的活性降低了8.67%(P<0.05)。同样,与对照相比,GA 处理5 d 的水稻糊粉层中20S 蛋白酶体和PBA1 的活性分别提高了17%(P<0.05)和35.09%(P<0.05),而GA 合成抑制剂Uni 处理5 d 后,20S 蛋白酶体和PBA1 的活性则分别降低了22.92%(P<0.05)和24.93%(P<0.05)(图4B、图4C)。
以上结果表明GA 对水稻糊粉层中26S 蛋白酶体、20S 蛋白酶体和PBA1 的活性均具有促进作用,而GA 合成抑制剂Uni 则起着抑制作用。
2.5 MG132 对水稻生长状态及糊粉层中26S蛋白酶体、20S 蛋白酶体和PBA1 活性的影响
使用MG132 处理5 d 后,水稻种子的生长明显受到抑制,其胚根和胚芽的长度短于对照的长度(图5A、图5B、图5C)。由图5D 可知,与对照相比,MG132 处理的水稻糊粉层26S 蛋白酶体活性降低了31.75%(P<0.05),该结果表明MG132 能够有效抑制26S 蛋白酶体的活性,且在种子萌发过程中,26S 蛋白酶体的活性与其萌发表型相关。
从图5E 可知,与对照相比,MG132 处理的糊粉层中20S 蛋白酶体活性升高了25.63%(P<0.05),表明MG132 处理可以推进26S 蛋白酶体的解离,导致游离20S 蛋白酶体的活性上升。通过进一步检测MG132 对PBA1 活性的影响发现,在相同处理下,PBA1 活性的变化与20S 蛋白酶体活性的变化一致。与对照相比,MG132 处理的水稻糊粉层中,PBA1 活性升高71.37%(P<0.05),表明26S 蛋白酶体的正常组装受到抑制后,亚基PBA1 的活性会上调(图5F)。
以上结果表明,MG132 可抑制萌发水稻种子的生长,且对水稻糊粉层26S 蛋白酶体的组装亦具抑制作用,从而导致20S 蛋白酶体活性及其亚基PBA1 活性的上升。
3 讨论
通过泛素-蛋白酶体系统(ubiquitin-proteasomesystem, UPS)调节蛋白质水平是真核生物中最复杂和最普遍的途径之一,UPS 可通过降解受损蛋白质、错误折叠蛋白或短寿命的调节蛋白,从而保证功能蛋白的正常工作[33-35]。UPS 对蛋白质的降解是一个多步骤的复杂过程,底物蛋白质首先通过泛素激活酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)和泛素连接酶(ubiquitin-protein ligase, E3)的协同作用被多泛素化,随后泛素化蛋白质被UPS 的核心26S 蛋白酶体识别并降解为小肽或氨基酸[36-37]。26S 蛋白酶体在植物生长发育过程中起着重要的调节作用,可通过选择性降解蛋白质,从而高效控制许多细胞过程[38-39]。
研究表明,GA 可在种子萌发过程中促进水解酶的分泌,加速了贮藏物质的分解,为种子萌发提供营养[40]。在本研究中,通过观察萌发水稻种子的长势及检测总蛋白的含量发现,使用GA 处理水稻种子时,促进糊粉层中贮藏蛋白的降解,从而加快水稻种子的萌发进程;而在GA 合成受到抑制时,糊粉层中贮藏蛋白的降解受到阻碍,水稻种子的萌发则受到抑制。26S 蛋白酶体在激素信号传导方面是保守的,GA 可诱导26S 蛋白酶体靶向降解蛋白质,从而促进种子萌发及果实发育等[18, 41],但对于其中机制还待进一步研究。
在水稻种子萌发1~9 d,20S 蛋白酶体亚基PBA1 的活性及其编码基因OsPBA1 的表达水平出现2 个峰值,在5 d 达到第一个峰值,而26S蛋白酶体在其达到峰值的后1 d,26S 蛋白酶体的活性才随之达到峰值,由此可知,PBA1 水平的升高可促使26S 蛋白酶体活性升高。NGUYEN 等[42]研究证实,PBA1 的基因表达能以特异性方式调节26S 蛋白酶体活性。在本研究中,20S 蛋白酶体活性在7 d 达到峰值,该峰值在26S 蛋白酶体活性下降期间,可见,26S 蛋白酶体在解离为20S蛋白酶體及19S 调节颗粒后,游离20S 蛋白酶体水平增加并达到峰值。有研究表明,在植物发育和胁迫反应过程中,调节26S 蛋白酶体和20S 蛋白酶体之间的比例具有重要意义。在植物衰老过程,26S 蛋白酶体活性的下降通常伴随着20S 蛋白酶体活性的上升,以增加植物细胞降解氧化蛋白的能力[14, 43-44]。本研究中PBA1 的活性及OsPBA1 的表达水平在8 d 达到第二个峰值,该峰值出现在20S 蛋白酶体活性下降期间,即20S 蛋白酶体活性的降低推动PBA1 的活性及OsPBA1的表达水平达到第二个峰值。
在本研究中,使用GA 及GA 合成抑制剂Uni处理水稻种子,发现GA 能够诱导PBA1 活性升高,进而上调20S 蛋白酶体及26S 蛋白酶体活性,而Uni 对该过程起着抑制作用。有研究证实,RPX是植物体内的蛋白酶体基因表达调控因子,它与26S 蛋白酶体亚基的编码基因启动子结合后,能诱导PBA1 的蛋白质水平升高,并调节蛋白酶体的活性增加[42]。而敲除20S 蛋白酶体亚基PBE1会影响26S 蛋白酶体的组装,致使其活性下降[45]。
为了进一步研究在药物抑制26S 蛋白酶体活性时,水稻种子生长及20S 蛋白酶体和PBA1 的活性所受到的影响,本研究使用了26S 蛋白酶体活性抑制剂MG132 处理水稻种子。当抑制26S蛋白酶体活性后,萌发水稻种子的生长也受到抑制,表明26S 蛋白酶体在植物生长过程起着重要作用。CHIU 等[15]研究证实,使用MG132 处理抑制了拟南芥种子的萌发,直接处理拟南芥胚胎则完全抑制胚胎的生长。当26S 蛋白酶体活性受到抑制时,20S 蛋白酶体亚基PBA1 反馈上调,从而出现了20S 蛋白酶体活性的增加,这点得到了他人实验的支持。在19S 调节颗粒亚基基因突变或MG132 处理导致26S 蛋白酶体活性降低的植株中,出现其他亚基基因的反馈上调,伴随着20S蛋白酶体活性的增加[29, 46-47]。在哺乳动物中同样观察到26S 蛋白酶体活性受抑制后,其亚基基因反馈上调的情况[48]。
综合以上结果可知,在水稻种子萌发过程中,GA 通过诱导PBA1 的活性升高,调节20S 蛋白酶体的活性,进而介导26S 蛋白酶体的组装,并以此介导26S 蛋白酶体依赖性降解贮藏蛋白,加快种子萌发的进程。
