微创入路腹膜后胰腺坏死组织清除术:操作技术与围术期管理
2024-04-29朱帅魏伟黄耿文
朱帅,魏伟,黄耿文
[中南大学湘雅医院 普通外科胰腺外科/国家老年疾病临床医学研究中心(湘雅),长沙 410008]
急性胰腺炎是一种常见的消化系统疾病,发病率约为5~90/10 万[1]。约20%的患者发展为中度或重度重症胰腺炎,继发局部或全身并发症或器官衰竭。感染性胰腺坏死(infected pancreatic necrosis,IPN)是急性胰腺炎的严重并发症之一,约占急性坏死性胰腺炎的1/3,其病死率可高达10%~20%[2],是导致急性胰腺炎患者死亡的主要原因。准确把握IPN 外科干预的指征和时机,制定并执行合适的外科干预策略,对降低IPN 患者的病死率、改善临床预后具有重大意义[3-4]。
IPN 的外科干预方式主要包括经皮穿刺引流(percutaneous catheter drainage,PCD)、微创手术和开放手术(open pancreatic necrosectomy,OPN)[5]。目前,“升阶梯(step-up)”策略是IPN 治疗的重要方式之一,其核心思想是从微创到开放逐步升级的治疗方式,其中最先采用的是PCD,如果引流效果不佳,再采用内镜或微创技术进行坏死组织清除,如果治疗效果仍不佳,则最终采用开放坏死组织清除术[6]。“升阶梯”策略是一种基于PCD 为先导、微创为主体、逐步升级的治疗方式,对于IPN 的治疗具有可靠的疗效。微创手术包括内镜经胃或十二指肠清除坏死组织、视频辅助下小切口坏死组织清除术、腹腔镜(后腹腔镜)坏死组织清除术、微创入路腹膜后胰腺坏死组织清除术(minimal access retroperitoneal pancreatic necrosectomy,MARPN)等[7]。随着微创治疗手段的日益完善,IPN 的外科干预方法在胰腺病学界也引发了广泛讨论[8]。对于IPN 的治疗,需要根据患者的具体情况选择合适的微创干预方式,以达到个体化精准治疗的目的。
MARPN 对IPN 的治疗始于21 世纪初[9],是基于肾镜或软质内镜等可视化设备作为影像系统,以窦道作为手术路径,对腹膜后、胰周坏死组织进行清除[10-11]。已有研究证明,MARPN 具有创伤小、恢复快、针对性强、并发症少等优势,是治疗IPN 的一种十分有效的方法。相比于OPN,MARPN 可以减少病死率,降低手术相关并发症、多器官功能衰竭和脓毒症的发生率。一项纳入394 例IPN 患者的临床研究[12]中,274 例行MARPN,120 例行OPN,结果显示MARPN 术后并发症发生率低于OPN(63.5%vs.81.7%,P<0.001),多器官功能衰竭发生率低于OPN(20.4%vs.35%,P=0.01)。一项多中心研究[13]也显示,MARPN 是治疗IPN 的一种安全有效的微创手术方法,在接受MARPN 的164 例患者中,平均手术次数1 次,其中54.9%的患者需要接受多部位(处)的MARPN,7.9%的患者中转开腹,术后总体并发症发生率为62.8%,病死率为6.1%。
MARPN 是一种相对较新的技术,在多个中心得到了应用和研究,但是其普及程度还不是很高,其适应证、具体技术细节、术后管理等方面还需要进一步的研究和探讨。笔者所在中心于2013 年起开始行MARPN[14-18],目前其已成为本中心IPN 微创干预的常规术式。经过多年的探索和实践,笔者团队对于MARPN 已积累大量病例和经验,并对手术的步骤、流程和技术细节进行了标准化,本文对此进行详细阐述。
1 手术时机及适应证
以胰腺外科医生、消化内科医生、放射科医生、重症医学科医生为核心的MDT 讨论分析所有患者的总体治疗计划,并确定外科干预的适应证、手术方式和时机。
1.1 MARPN的时机
采用延迟性干预原则,一般在发病3~4 周后进行手术干预。外科干预的具体时机应根据患者的具体情况来决定。当患者的临床情况持续恶化,尤其是非手术治疗无效时,应果断进行外科干预。如果PCD 路径为腹膜后,一般在间隔3~5 d 后即可行MARPN。如果PCD 路径为经腹腔路径,则需要适当延长间隔时间,至少在1 周以后,一般在2 周或以上待形成牢固的窦道后进行手术。
1.2 MARPN的适应证
持续性感染的症状;持续性的脓毒症/脓毒性休克;术后肺、肾等器官功能衰竭持续性恶化或改善不明显;CT 评估胰周坏死积液未能完全消除;引流管引流不畅。
2 麻醉方式
大多数患者可采用利多卡因或罗派卡因局部浸润麻醉进行手术,必要时可联合静脉麻醉。第一次手术时由于需要钝性扩张窦道,引起的疼痛较为明显,可酌情采用全身麻醉。如患者存在呼吸衰竭、休克等严重情况时,宜采取全身麻醉。
3 主要手术设备和器械
建立手术路径:皮肤扩张器、导丝;冲洗液:生理盐水,可预热到37 ℃;视频辅助系统及手术器械:硬质经皮肾镜、取石钳(图1),必要时可使用软质胆道镜。
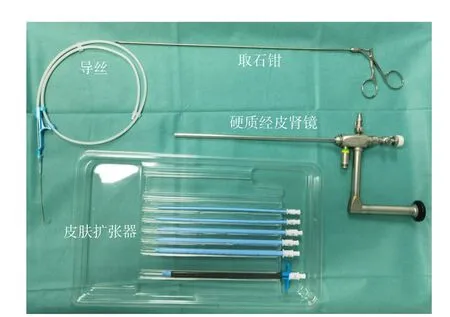
图1 MARPN手术器械Figure 1 The surgical instruments used in MARPN
4 手术步骤及技术细节
4.1 患者体位及防水措施
患者平卧位,必要时使用沙袋抬高手术侧(图2A),便于手术医生通过窦道深入胰腺周围清除坏死组织。若患者腹膜后存在广泛的坏死,脓腔较大,左右两侧腹膜后均有窦道引流,亦可双侧多个通道交替或者同时进行手术,可提高手术效率,减少手术时间。

图2 患者手术体位及防水措施 A:使用沙袋抬高手术侧;B:使用黄色塑料袋保护手术区域;C:常规消毒铺巾;D:手术区域覆盖脑外科引流膜;E:手术台下备水盆,冲洗液引流至盆内;F:手术医生采用坐姿进行手术 Figure 2 Figure 2 Patient positioning and waterproof measures A: Elevating the operative side with a sandbag;B: Protecting the surgical area with yellow plastic films;C: Standard disinfection draping;D: Covering the surgical area with neurosurgical drainage film;E: Water basin placed beneath the operating table,with irrigation fluid draining into the basin;F: Operating surgeon adopting a seated position for the surgery
术中会使用大量冲洗液,需要做好防水隔离措施。大号黄色塑料袋平铺于手术台,以免冲洗液污染手术床。另取4 张以引流管为中心相互交叠覆盖手术区域,以手术胶带封边,防止冲洗液湿透患者(图2B)。手术台下备大盆收集冲洗液。手术区域粘贴覆盖脑外科引流膜,冲洗液可引流至手术台下盆内,这样既可保护切口,也利于冲洗液的引流(图2C-E)。调整手术床至合适高度,使手术医生可以采用坐姿或站立位进行手术(图2F)。
4.2 建立手术路径
术前应详细阅读CT,了解预扩张窦道的路径,了解穿刺管进入窦道的深度和角度以及和周围器官的关系,经引流管置入导丝以做引导(图3A),拔除原引流管(图3B),导丝在坏死腔内可适当向前推进,以导丝为中心沿皮纹可左右切开3~5 mm(图3C)。注意固定住导丝不要脱落,保持位置和深度不变。不同型号扩张器经导丝做引导,逐级、连续扩张窦道一般以8 F 开始,直至24 F(图3D-F)。对于再次手术的患者,可直接使用较大型号扩张器。窦道扩张完成后,将24 F 导管鞘留在窦道内(图3G-I)。若由1 名术者操作,则一手固定导丝,另一手旋转扩张器向前推进。注意手法轻柔,循导丝和窦道前进。步骤连贯,特别注意不要意外脱管,避免窦道塌陷闭合,失去手术路径。注意观察是否有脓液或者坏死物质经扩张器流出,以判断扩张器是否循正确路径进入脓腔。

图3 建立手术路径 A:经引流管置入导丝;B:退出原引流管;C:以导丝为中心切开皮肤;D-F:不同型号扩张器由小至大扩张窦道;G-I:置入导管鞘,建立手术通道 Figure 3 Establishing surgical pathway A: Insertion of guidewire through the drainage tube;B: Removal of the original drainage tube;C: Incision of the skin centered around the guidewire;D-F: Gradual dilation of the sinus tract using dilators of different sizes from small to large;G-I: Placement of the cannula sheath to establish the surgical channel
4.3 使用硬质肾镜清除坏死组织
将肾镜经窦道到达坏死腔(图4A-B),利用温热生理盐水持续冲洗腔隙,获得良好视野,使用取石钳钳夹取出松动脱落的坏死组织(图4C-D)。对于尚未完全脱落的坏死组织,不做强行取出。坏死腔壁本身或腔内存在肠道、血管,注意保护,避免术后出现出血、肠瘘。术者需要仔细分辨正常组织和坏死组织,避免清除过度或不足。同时,要尽可能减少对正常组织的损伤,以降低术后并发症的发生率。笔者的经验是,在行首次MARPN 时,清除坏死组织宜相对保守,手术主要是去除脓液和松散即将脱落的坏死组织,并置入大号引流管。

图4 手术操作 A:肾镜经窦道进入坏死腔进行手术;B:坏死腔;C:使用取石钳清除坏死组织;D:手术清除的腹膜后坏死组织Figure 4 Surgical procedure A: Nephroscope entering the necrotic cavity through the sinus tract for surgery;B: Necrotic cavity;C: Use of stone forceps to remove necrotic tissue;D: Necrotic tissue removed from the retroperitoneum
4.4 置入引流管
当脓腔壁显示出红润颜色且所有松散坏死组织已被清除时,当次手术即可终止。引流液和清除的坏死组织常规送病原学和病理学检查。将20~28 F 的三腔引流管置于脓腔深部,尽可能靠近胰床(图5A-D),特别注意不可直接顶住脓腔壁,以免长久压迫导致肠瘘或出血。建议使用多功能多腔引流管,以便术后引流和持续冲洗(图6A)。对于引流管的固定,可使用3M 胶布剪成“E”字形螺旋固定引流管(图6B-E),以方便术后调整引流管,必要时可使用传统的缝线缝合固定。

图5 置入引流管 A:经导管鞘置入导丝;B-C:经导丝引导置入引流管,拔除导丝;D:将引流管置入脓腔深处Figure 5 Placement of drainage tube A: Guidewire insertion through the cannula sheath;B-C: Insertion of the drainage tube guided by the guidewire,followed by guidewire removal;D: Placement of drainage tubes deep into the abscess cavity

图6 引流管及固定方法 A:多功能引流管;B:3M胶布剪成“E”字形;C-E:胶布螺旋固定引流管Figure 6 Drainage tube and fixation method A: Multi-functional drainage tube;B: 3M tape cut into an "E" shape;C-E: Spiral fixation of the drainage tube with tape
5 术后管理
术后管理非常重要。每日的动态评估,尤其对细节的观察和精准把控,是必不可少的。抗生素的选择是基于第一次获取的脓液或者坏死组织的微生物培养及药敏结果,必要时重复培养。器官功能障碍的患者需转入重症监护病房进行密切监测。病情稳定的患者可在胰腺专科病房接受治疗。所有患者必须动态监测脉搏、血压、体温和尿量。需要特别关注的检验指标包括血红蛋白、白细胞计数、血小板计数、电解质、尿素、肌酐、血糖、白蛋白、肝酶、胆红素、血清C-反应蛋白和降钙素原。病情允许的情况下尽快进行肠内营养,可以通过补充性肠外营养补充热量和其他营养需求。
引流管的管理同等重要,引流管切勿意外脱出。须保持引流管的通畅,可经常挤压和冲洗引流管。对于引流管的冲洗,可选择持续灌洗或者注射器冲洗。一般前期笔者选择注射器冲洗,后期无大块坏死组织且明确引流管通畅后,可选择持续灌洗。一定注意冲洗液的冲入量和流出量需要大概一致,避免人为导致的腹膜后积液。
术后需进行腹腔、盆腔增强CT 动态评估病情,尤其是对腹膜后坏死物的清除及引流效果的评价。可常规在术后1 周复查CT,当病情出现变化时需随时复查CT。随着病情的稳定,可逐渐延长复查CT 的间隔时间。如脓腔内有较多的坏死组织残留,可再次进行手术。
患者临床表现良好,无腹痛、腹胀及发热,CT 提示脓腔已消失,引流液逐渐减少,如少于5 mL,复查引流液淀粉酶不高,可考虑拔除引流管。较为安全妥当的方式是,可将引流管更换为管径较小的引流管,逐步退管,如每2~3 天退2 cm,当深度少于5 cm 时,可以直接拔管。
6 患者及家属的健康教育
IPN 患者的病情危重、病程周期长,因而对患者及家属的健康教育显得尤其重要。有相当一部分患者带管回家康复,因而需要患者及家属注意保护引流管,确保管道不打折、受压或脱落。需要积极指导家属掌握正确的冲管方法,以确保管道的通畅。同时,家属也要认真学习和实践,严格按照医生的建议进行操作,以确保患者的舒适和安全。为了及时发现病情变化,患者和家属需要自我监测。如出现发热、腹痛等症状、引流管内有血性液体或肠液、胆汁等,应及时复查,必要时再次住院治疗。
7 讨论
IPN 治疗的微创化已是大势所趋,但由于患者较大的个体差异及各中心治疗经验的不同,微创治疗的策略与方式有较大差异[19]。自21 世纪初开始,随着治疗理念和技术的不断发展,MARPN 逐渐进入临床应用。在国内外一些大规模的胰腺外科中心,包括笔者所在中心,MARPN 已经成为治疗IPN 的主要手段,并且各中心均有各自的临床经验,从已发表的数据来看均取得了较好疗效[20-22]。
MARPN 作为一种通过微创方法清除胰腺及周围坏死组织的手术,在IPN 的治疗中发挥着重要的作用。通过PCD 窦道,可视化显像设备进入脓腔,通过器械钳夹清除坏死组织,术后置入引流管进行冲洗。借助CT 或超声引导,PCD 可以精确地定位坏死组织,这提高了MARPN 的精确性。相比于OPN,MARPN 通过原有PCD 窦道进行操作,显著减少手术创伤,减轻术后疼痛,缩短恢复时间。由于手术创伤小,术后感染、出血和器官损伤等并发症的风险也相应降低。如果需要多次手术处理坏死组织,MARPN 的微创入路使得重复手术更加容易实施,减轻了患者的痛苦和手术风险。作者团队依据多年的MARPN 经验以及成功救治的大量IPN 病例,从手术适应证和禁忌证到麻醉方式,从手术流程到技术细节,从术后管理到患者及家属的健康教育,将MARPN 标准化和流程化,提高了手术的准确性和安全性,也便于技术的普及和推广。
MARPN 充分利用原有通向脓腔的路径,只需要钝性扩张原有窦道,不需要另做手术切口。笔者团队在最初选择微创设备时,曾尝试过硬质肾镜、纤维肾镜、输尿管镜、腹腔镜等,但最终选定了硬质肾镜作为视频设备。硬质肾镜满足小口径要求,具有操作通道可引入操作器械,因此只需要1 个窦道即可完成手术。相比于纤维肾镜,硬质肾镜操作通道宽大,可单次夹取较大块的坏死组织使得清理效率也相对较高。此外,硬质肾镜作为常用设备在各级医院普及率高,使开展MARPN 的设备门槛几乎不存在,同时也降低了术者的学习曲线。
MARPN 治疗IPN 的优点主要包括手术创伤小、术后恢复快、并发症发生率低等,其病死率低于传统OPN。然而,MARPN 也存在一定的局限性。由于器械设备和入路的限制,MARPN 难以一次性清除所有的坏死组织,尤其是感染坏死范围大、液化不完全的IPN。因此,对于IPN 的外科干预,往往需要多次的MARPN 治疗,已有研究[23]显示,MARPN 治疗IPN 平均需3 次手术。反复多次的手术会增加出血和肠瘘等并发症的风险。此外,对于IPN 合并腹腔出血、肠瘘等,MARPN 也无法处理。因此,MARPN 无法完全替代OPN[24-25]。若MARPN无法控制感染或出现腹腔出血、肠瘘等情况应果断进行OPN[26]。OPN 仍然是“升阶梯”治疗模式的重要组成部分。在特定情况下,如腹腔高压、持续的器官功能衰竭、腹腔出血、肠瘘、肠梗阻等,OPN 是唯一选择[8,27-28]。包括MARPN 在内的微创手术和OPN 两种治疗方法并不是相互排斥的,而是相辅相成的[29]。
未来,随着科技的不断进步和发展,我们相信MARPN 技术将会得到进一步的完善和提高。未来研究方向主要包括改进手术操作技巧、研发新型的医疗器械和手术方法、加强围手术期管理和护理等方面的内容。同时,也需要进一步探讨MARPN 的适应证和禁忌证,为患者提供精准的个体化治疗方案。
总之,MARPN 是治疗IPN 的重要方法之一。然而,对于特定的患者,需要在术前进行全面的评估,选择微创或者开放等合适的手术方法[30]。未来,需要进一步研究和改进MARPN 技术,以更好地为患者提供安全和有效的治疗。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:朱帅负责图片采集和编辑、文章撰写;魏伟负责实施手术、文章修改;黄耿文负责手术设计、技术指导、文章修改。
